稳定表达流感病毒PR8株NS1蛋白MDCK细胞系的建立
张 旭,滕巧泱,闫丽萍,周洁文 ,徐大伟,颜丕熙,姬希文,戴晓光,王洪斌,高 利,李泽君
(1.中国农业科学院上海兽医研究所农业部寄生虫重点开放实验室,上海 200241;2.东北农业大学动物医学学院,哈尔滨 150030)
流感病毒(Influenza virus)属正黏病毒科流感病毒属,是一种带囊膜,基因组为单股,负链、分节段的RNA病毒。流感病毒的基因组分为8个片段,编码11个蛋白。NS基因是流感病毒基因组中最小的基因节段。NS基因编码NS1和NS2两种蛋白,研究表明,NS1为流感病毒唯一的非结构蛋白(nonstructural protein, NS)[1]。NS1蛋白含有两个核定位区,分别为第34~38位氨基酸残基和第203~230位氨基酸残基处。在这两个核定位信号的作用下,NS1蛋白在细胞质中合成后很快向核内转移,并积聚在病毒感染早期的细胞核内,在感染后期NS1则聚积于核仁中[2]。NS1除了在核内聚集之外,在多核糖体上也有发现。在NS1表达的情况下,与病毒mRNA结合的多核糖体明显增多,增加了病毒mRNA的翻译起始率,说明NS1蛋白在病毒基因表达或病毒mRNA复制方面起到很重要的作用[3]。除此以外,另有学者发现流感病毒的NS1蛋白在病毒逃离宿主免疫反应的过程中起着重要的作用。NS2蛋白的主要功能是介导组装好的vRNPs从细胞核输出到细胞质中,该功能通过M1蛋白与vRNPs发生联系,也有研究表明NS2在病毒RNA合成过程中具有调节作用[4]。
为了将外源基因片段插入到流感病毒不同基因片段的包装信号之间,研究人员尝试拯救含外源基因的流感病毒。本研究中,为扩增在NS1基因的包装信号之间插入外源基因的流感病毒,我们用逆转录病毒系统,成功的将流感病毒PR8株的NS1基因整合进入MDCK细胞基因组中,建立了稳定表达NS1蛋白的MDCK-PR8-NS1细胞系。该细胞系的建立为更好地开展流感病毒NS1基因功能研究以及为扩增含有外源基因流感病毒提供有利的工具。
1 材料和方法
1.1 材料
1.1.1 菌种和质粒E.coliDH5感受态、E. coliBL21(DE3)感受态、PET30a载体、pMX载体、pMDSV、pCI-VSVG、pCI-MDSV(gag/pol),pCINF-KB质粒均由本实验室保存。
1.1.2 病毒株与细胞 流感病毒A/ Puerto Rico/8/ 34株,293T细胞和MDCK细胞由上海兽医研究所水禽流感实验室提供。
1.1.3 主要试剂与材料 rTaq DNA 聚合酶、Pyrobest DNA聚合酶、T4 DNA 连接酶、XhoI、NotI、提取基因组试剂盒和Reverse Transcriptase M-MLV试剂盒购自宝生物工程(大连)有限公司;DMEM 培养基、小牛血清(NCS)和转染试剂 LipofectamineTM2000购 自Invitrogen公 司;Puromycin购自Amresco公司;去内毒素质粒提取试剂盒购自 Omega 公司。
1.2 方法
1.2.1 pMX载体重组流感病毒A/ Puerto Rico/ 8/34株NS1基因质粒构建 根据NCBI登录的流感病毒PR8株NS1基因(Genbank登录号:J02150.1)序列设计引物(表1),采用TRIzol法提取本实验室保存的流感病毒PR8株的总RNA,利用流感病毒通用引物进行反转录后,用引物PR8-NS-NotI-F和PR8-NS-XhoI-R扩增NS1基因的的完整开放阅读框。PCR产物经割胶纯化后用NotI和XhoI酶切,连接于同样酶切的 pMX 载体中,构建的重组质粒经酶切鉴定无误后测序。
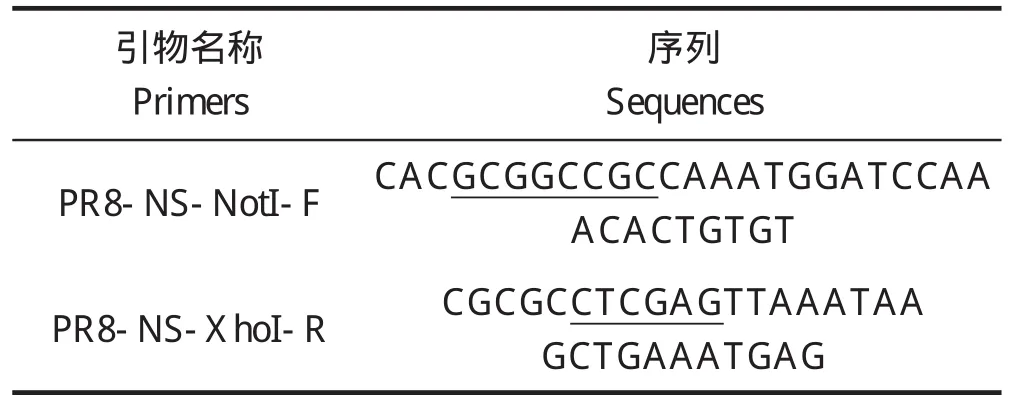
表1 pMX载体克隆PCR扩增引物Table 1 PCR primers of pMX vectors clone
1.2.2 重组质粒共转染 293T 细胞 按照OMEGA Endo-free Plasmid Mini Kit I说明书操作,提取高纯度的pCI-NF-KB、PMDSV(VSVG)、MDSV(gag/pol)和pMX -PR8 M四个质粒,测定质粒浓度后,用Lipofectamine 2000转染试剂将4种质粒共转染于293T细胞中,转染6 h后换培养液,用含5% NCS的DMEM培养液替换原先的OPTI-MEM 培养液。
1.2.3 表达NS基因MDCK细胞系的制备与阳性细胞株的筛选 待转染293T细胞72 h后,将含逆转录病毒样颗粒的293T细胞培养上清液转移至 MDCK细胞上,感染24 h后用含嘌呤霉素 (5 g/mL)培养基进行抗性筛选,每隔3 d弃去细胞培养上清液,换含嘌呤霉素的新培养液。15 d后将阳性细胞株在含嘌呤霉素的条件下连续传代,取第5代细胞进行鉴定。
1.2.4 PR8-NS多抗的制备
1.2.4.1 PET30a重组流感病毒PR8株NS基因质粒构建 提取本实验室保存的流感病毒PR8株总RNA并进行反转录后,用下述引物PR8-NSEcoRI-U和PR8-NS-XhoI-L扩增NS1基因的完整开放阅读框。PCR产物经割胶纯化后用EcoR I和XhoI酶切,连接于同样酶切的 PET30a原核表达载体中。构建的重组质粒经酶切鉴定无误后测序,测序正确命名为PET-PR8NS1.

表2 PET30a载体克隆PCR扩增引物Table 2 PCR Primers of PET30a vectors clone
1.2.4.2 NS1蛋白的原核表达 将构建好的PET-PR8NS1重组质粒转化E.coliBL21,挑选酶切鉴定阳性的菌落接种LB培养基,37 ℃振荡培养至对数生长期,加入终浓度1.0 mmoL/L的IPTG进行诱导表达。
1.2.4.3 小鼠免疫 将表达后的NS蛋白进行粗纯化,取50 μg粗纯后蛋白与等体积的弗氏完全佐剂混合,充分乳化后选择体重 18~20 g、6~8周龄的 BALB /c雌性小鼠,进行肌肉注射免疫, 每只0.2 mL。2周后,进行2次免疫。二免3周后,进行第3次免疫,免疫剂量同前2次免疫。第3次免疫后10 d,取血清分装后,保存于-70 ℃冰箱保存。
1.2.5 表达NS基因 MDCK细胞系的鉴定
1.2.5.1NS基因 mRNA 表达水平和基因组插入水平检测 提取细胞的总基因组DNA和总mRNA,mRNA用OligodT引物进行反转录获得cDNA,以cDNA和细胞的基因组DNA为模板,用引物PR8-NS-EcoRI-U和PR8-NS-XhoI-L进行PCR扩增。PCR反应程序: 95℃预变性5 min;94℃变性 45 s,53 ℃退火 30 min,72 ℃延伸 1 min,30个循环;72 ℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳检测。
1.2.5.2 NS1蛋白检测 将培养的细胞用PBST反复清洗3次后,用4%的甲醛渗透固定5 min。PBST清洗5次,用1% BSA 37 ℃封闭45 min。PBST清洗5次,加入1:100稀释的NS多抗血清,室温下孵育1 h。PBST清洗5次,加入1:500稀释的FITC标记羊抗鼠IgG二抗稀释液,室温下孵育1 h。PBST清洗5 次,最后置于倒置荧光显微镜下观察并记录结果。
2 结果
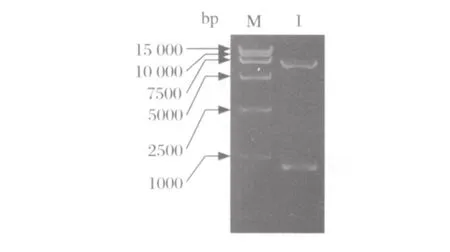
图1 pMX-PR8-NS重组质粒酶切鉴定图Fig.1 Digestion of the pMX-PR8-NS recombinant plasmid
2.1 流感病毒NS基因的克隆 从流感病毒PR8株提取的总RNA,通过反转录并用表1和表2中的NS的特异性引物进行PCR,产物经1%琼脂糖凝胶电泳后可见大小约838 bp的特异性条带。
2.2 重组质粒鉴定 pMX-PR8-NS重组载体经NotI和XhoI酶切鉴定后,在1%琼脂糖电泳中可见7037 bp的目的载体条带和约838 bp的片段条带(图1),与目的片段预期大小相符。将PET-PR8-NS重组载体用EcoR I和XhoI进行酶切鉴定,从1%琼脂糖电泳结果可见838 bp 的目的基因条带和约5421 bp的载体条带(图2),与预期相符。将重组质粒送测序分析,结果证实序列正确。
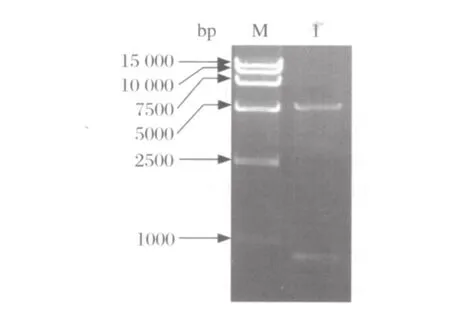
图2 PET-PR8-NS重组质粒酶切鉴定图Fig.2 Digestion of the PET-PR8-NS recombinant plasmid byEcoR I and Xho I
2.3 稳定转染细胞系的鉴定
2.3.1 稳定表达细胞系的RT-PCR及细胞基因组PCR鉴定 提取细胞基因组DNA,然后进行PCR鉴定,结果出现预期大小的条带(图3),表明PR8-NS基因已经整合到MDCK细胞系的基因组上。提取PR8-NS稳定转染细胞系mRNA,反转录做RT-PCR鉴定与预期结果相符(图4),说明细胞基因组中插入的PR8-NS基因在特定的条件下能成功转录成NS的RNA。

图3 含NS基因的MDCK细胞基因组PCR鉴定Fig.3 PCR of MDCK cell genome with NS

图4 PR8-NS转染细胞系的PT-PCR鉴定Fig.4 PT-PCR analysis of PR8-NS transfected cell line
2.3.2 间接免疫荧光鉴定(immuno fl uorescence assay,IFA) 在倒置荧光显微镜下进行IFA检测,结果显示,细胞系表达的NS蛋白可以被NS多抗特异性识别(图5)。

图5 间接免疫荧光检测细胞中NS蛋白的表达(400×)Fig.5 Detection of NS protein expression in cells by indirect immuno fluorescence assay(400×)
3 讨论
筛选与建立细胞系有许多种方法,比如用脂质体转染、或用逆转录病毒载体系统等将外源目的基因递入细胞内。本研究所采用的逆转录病毒载体系统在建立稳定表达细胞系中具有更大的优点。通过分子克隆技术将目的基因插入此逆转录病毒载体中,而包装细胞系能提供病毒载体包装成病毒粒子所需的结构蛋白。当重组病毒载体导入包装细胞后293T后,缺陷病毒载体和包装细胞的互补作用共同完成病毒装配,该病毒颗粒可感染其他宿主细胞,此时目的基因进入该细胞并整合到细胞基因组中,导致插入序列在宿主细胞中表达,产生目的蛋白[5]。MDCK 细胞是流感病毒增殖的良好宿主细胞,我们利用逆转录病毒操作系统[6]将 PR8 流感病毒NS基因整合到MDCK细胞的基因组中,建立稳定表达PR8 NS基因的细胞系。
在流感病毒的蛋白功能以及疫苗研究中,稳定表达细胞系起了关键的作用。黄海碧等[7]通过反向遗传操作技术拯救含外源基因的病毒。Watanabe等[8]利用M2表达细胞系增殖M2基因缺失病毒,为流感病毒基因缺失疫苗的研究提供了基础。Li等[9]利用NP表达细胞系发现了NP突变的位点决定着流感病毒核糖核酸,蛋白质复合物间的相互作用。研究表明,流感病毒每条基因片段 5'和3'末端非编码区和编码区内部分碱基具有包装信号(packaging signal)的作用,对于包装病毒RNA具有关键作用[10,11],通过在NS基因不同的包装信号之间插入GFP报告基因,并与其他7个质粒共转染后检测GFP表达量,证明了非编码区与相邻的编码区的(尤其是在3'末端)不同的碱基数对于病毒vRNA包装效率影响很大。由此提示,通过建立稳定表达NS基因的细胞系,可以在该细胞系上拯救出含有报告基因的一过性的病毒粒子,为后期疫苗的研制提供有力的平台,同时为研究NS蛋白与其它流感病毒基因蛋白之间的相互作用机制提供了有利的工具,便于后期对其功能进行更深入的研究。
[1]于孟斌. H5N1亚型禽流感病毒NS1蛋白与宿主蛋白PARP10相互作用研究[D].北京: 军事医学科学院,2009.
[2]Geiss G K, Salvalore M, Tumpey T M, et al. Cellular transcriptional profiling in influenza A virus-infected lung epithelial cells:The role of the nonstructural NS1 protein in the evasion of the host innate defense and its potential contribution to pandemic influenza[J]. Proc Natl Acad Sci,2002, 99(16): 10736-10741.
[3]Luna S D L, Fortes P, Beloso A, et al. Influenza virus NS1 protein enhances the rate oftranslation initiation of viral mRNAs[J]. J Virol, 1995, 69(4): 2427-2433.
[4]殷震, 刘景华. 动物病毒学[M]. 2版. 北京: 科学出版社,1997: 704-742.
[5]Clontech Laboratories, Inc. Retroviral Gene Transfer and Expression User Manual[EB/OL]www.clontech.com. 2006 13(3).
[6]Galanis E, Vile R, Russell S J. Delivery systems intended for in vivo gene therapy of cancer: targeting and replication competent viral vectors[J]. Crit Rev Oncolo Hematol,2001, 38(3): 177-192.
[7]黄海碧, 滕巧泱, 王朝霞, 等. 稳定表达流感病毒 PR8HA蛋白MDCK细胞系的建立及鉴定[J].中国预防兽医学报,2010, 32(7): 517-520.
[8]watanabe S, Watanabe T, Kawaoka Y. Influenza A virus lacking M2 protein as a live attenuated vaccine[J]. J Virol,2009, 83(11): 5947-5950.
[9]Li Z, Tokiko W, Masato H, et al. Mutational analysis of conserved amino acids in the influenza A virus nucleoprotein[J]. J Virol, 2009, 83(9): 4153-4162.
[10]Tchatalbachev S, Flick R, Hobom G. The packaging signal of influenza viral RNA molecules[J]. RNA, 2001,7(7): 979-989.
[11]Fujii K, Fujii Y, Noda T, et al. Importance of both the coding and the segment-specific noncoding regions of the influenza A virus NS segment for its efficient incorporation into virions[J]. J Virol, 2005, 79(6): 3766-3774.

