编码日本血吸虫CIAPIN1 cDNA的克隆及其重组蛋白的原核表达
罗 荣, 于金波,周春景 ,杨德浩, 程国锋
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2.河北省高碑店市农业局,保定074000;3.河北北方学院,石家庄 075000)
细胞因子诱导的凋亡抑制因子CIAPIN1(cytokine induced apoptosis inhibitor 1) 是 一 类细胞因子依赖性凋亡抑制分子,并已经被证实是独立于Bcl家族、Caspase家族等之外的参与Ras信号转导通路中的另一个调节蛋白[1,2],研究表明CIAPIN1与肿瘤发生发展密切相关[3]。在白血病细胞中,CIAPIN1蛋白通过调控Bcl-2、MDR-1以及Bax的表达来介导多药抗性[4]。鉴于CIAPIN1蛋白功能重要性,本研究结合生物信息学和分子生物学实验对日本血吸虫CIAPIN1基因编码cDNA进行初步研究,将其命名为SjCIAPIN1(Schistosoma japonicum cytokine induced apoptosis inhibitor 1),并且制备了特异识别SjCIAPIN1蛋白多克隆抗体,为深入研究其功能奠定了初步基础。
1 材料与方法
1.1 生化试剂 ExTaq DNA聚合酶、T4 DNA连接酶、pMDTM19-T simple Vector、限制性内切酶BamH I和EcoR I等均购自TaKaRa生物工程(大连)有限公司;His-Bind Purification Kit购自Novagen公 司;AxyPrepTMDNA Gel Extraction Kit 购自爱思进生物技术(杭州)有限公司;DNA Marker DL2000、DNA Marker Ⅳ、预染蛋白 质MarkerⅡ购自天根生化科技(北京)有限公司;硝酸纤维素膜(Whatman)购自北京经科宏达生物技术有限公司;羊抗兔IgG-AP、AP显色底物试剂盒购自北京康为世纪生物科技有限公司;预染蛋白质Maker SM6071购自Fermentas公司;TRIzol reagent购自上海英骏生物技术公司。
1.2 生物材料 新西兰大耳兔购自上海罗泾飞达实验动物养殖场;日本血吸虫中国大陆株尾蚴由中国农业科学院上海兽医研究所钉螺室提供;新西兰大耳兔以腹部贴片法感染约4000条日本血吸虫尾蚴,在感染尾蚴21 d后剖杀兔子,通过肝门静脉灌注法收集血吸虫虫体,PBS充分洗涤虫体以去除粘附物,液氮冻存待用;大肠杆菌菌株Top10、DE3(BL21)购自天根生化科技(北京)有限公司;原核表达质粒pET28a(+)购自Novagen公司。
1.3 生物信息学分析 在线工具(http://www.expasy.ch/tools/dna.html)预测分析SjCIAPIN基因已知cDNA序列,寻找其正确开放阅读框;利用ClustalW (http://www.ebi.ac.uk/clustalw/)软件进行同源性比较分析,并且通过MEGA 5软件对多物种CIAPIN1基因构建系统发生树;采用Primer Premier 5.0和Oligo 6软件进行引物设计。
1.4 日本血吸虫cDNA制备 TRIzol 法抽提日本血吸虫总RNA,DNase处理总RNA消除基因组污染,并且通过分光光度计对其进行浓度测定;以Oligo(dT)作为逆转录引物,预处理的1μg总RNA作为逆转录模板,在逆转录酶MMLV RTase的作用下制备日本血吸虫cDNA。
1.5 重组质粒pET28a(+)-Sjciapin构建 日本血吸虫cDNA作为模板,PCR扩增SjCIAPIN1基因CDS区域,上游引物序列:5'-CCGGATCC ATGGAACCGTATGTCGTTGAT-3',下游引物序 列:5'-CCGAGCTCCAA ATCGGCTTTCAA AACGTC-3';通过BamH I和EcoR I对已纯化的PCR扩增产物和原核表达质粒pET28a(+)进行双酶切,然后在T4 DNA连接酶的作用下连接转化感受态细胞Top10,涂LB(Luria-Bertani)培养平板(Kan+),37℃恒温过夜培养;挑取生长良好的单克隆摇菌,进行PCR检测,阳性样本进行测序与双酶切验证。
1.6 重组蛋白表达纯化 重组原核表达质粒pET28a(+)-SjCIAPIN1转化DE3菌株,挑取单克隆于1 mL LB(Kan+)液体培养基中过夜培养(37℃,200 r/min);将过夜培养的菌液接种于2×YT培养基中,37℃、220 r/min恒温培养3 h,待菌液OD600至0.5时,加入终浓度为1 mmol/L的IPTG进行诱导,诱导培养6 h后3000×g离心10 min收集菌体,SDS-PAGE检测重组蛋白表达情况;包涵体洗涤溶解,镍柱亲和层析纯化重组蛋白,SDSPAGE检测纯化效果,梯度透析进行蛋白复性。
1.7 抗SjCIAPIN1蛋白多克隆抗体制备 约1 mg重组蛋白与206佐剂等体积混合,在漩涡振荡器上乳化1 h,通过皮下注射免疫新西兰大耳兔,每两周加强免疫1次,3次免疫后7 d心脏取血,低速离心分离免疫血清。
1.8 Western blot分析 重组蛋白进行SDSPAGE,通过电转法将蛋白转移至硝酸纤维薄膜上,然后于含5%脱脂奶粉的TBST溶液中室温封闭至少2 h;封闭结束后,将膜转移至稀释好的免疫血清中,4℃孵育过夜,TBST洗膜3次,每次约5 min;碱性磷酸酶标记的抗兔二抗稀释5000倍,与硝酸纤维薄膜室温孵育至少2 h,同样TBST溶液洗膜3次,每次约5 min;将现配的碱性磷酸酶底物反应液滴于硝酸纤维薄膜上,暗室反应5 min,显色结束后终止反应。
2 结果
2.1SjCIAPIN1基因生物信息学分析SjCIAPIN1基因已知mRNA(GenBank 登录号:AY223353)长1143 bp, 编码区为828 bp(ATG154-TGA984),编码蛋白由276 氨基酸组成,预测分子量30.55863 kDa;多序列比对分析显示其属于细胞因子诱导凋亡抑制因子家族成员(图1);系统发生树揭示其与曼氏血吸虫CIAPIN1蛋白具有较为相近的亲缘关系 (图2)。

图1 多序列比对分析Fig. 1 Multiple sequences alignment among CIAPIN1 proteins

图2 CIAPIN1蛋白系统发生树Fig. 2 Phylogenetic tree of CIAPIN1 proteins
2.2 PCR扩增SjCIAPIN1基因CDS 聚合酶链式反应扩增SjCIAPIN1基因编码区,1.5%琼脂糖凝胶电泳结果显示获得单一目的条带(图3),条带大小约800 bp;切胶纯化目的带,将其克隆至pMDTM19-T simple Vector中进行测序,测序结果显示序列长度为828 bp,与生物信息学预测编码区大小完全一致。

图3 PCR扩增SjCIAPIN基因CDSFig.3 Amplifying CDS of SjCIAPIN gene by PCR
2.3 原核表达载体pET28a(+)-SjCIAPIN1构建利用限制性内切酶BamH I和EcoR I对纯化的PCR产物和pET28a(+)载体进行双酶切,胶回收后在T4 DNA连接酶的作用下连接克隆,转化涂板PCR筛选阳性克隆,双酶切结果表明成功克隆目的片段(图4 ),同时测序结果显示序列完全正确。
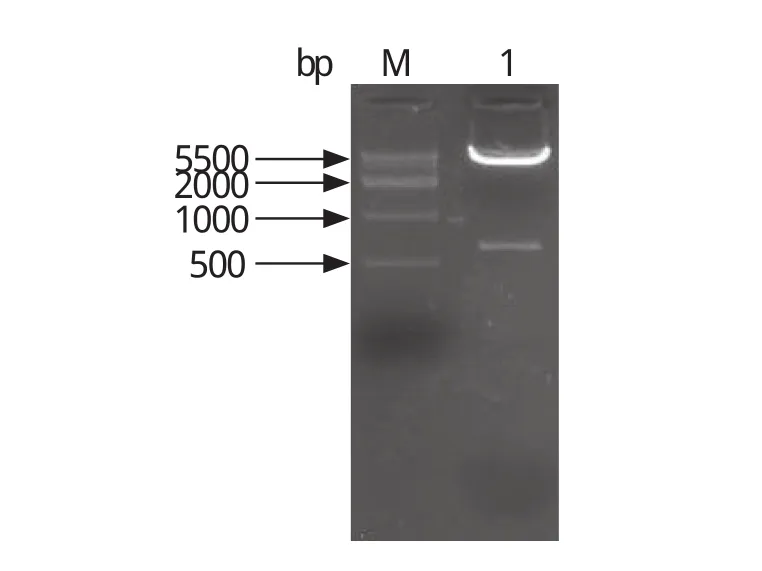
图4 pET28a(+)-SjCIAPIN1双酶切Fig.4 Double Digestion of pET28a(+)-SjCIAPIN1 plasmid
2.4 重组蛋白表达纯化 重组质粒pET28a(+)-SjCIAPIN1转化BL21(DE3)感受态细胞,挑取单克隆扩大培养至OD600到0.5左右时加入终浓度1 mmol/L IPTG诱导表达融合蛋白,超声洗涤且尿素溶液溶解包涵体后,通过镍柱亲和层析得到高纯度的重组融合蛋白(图 5)。
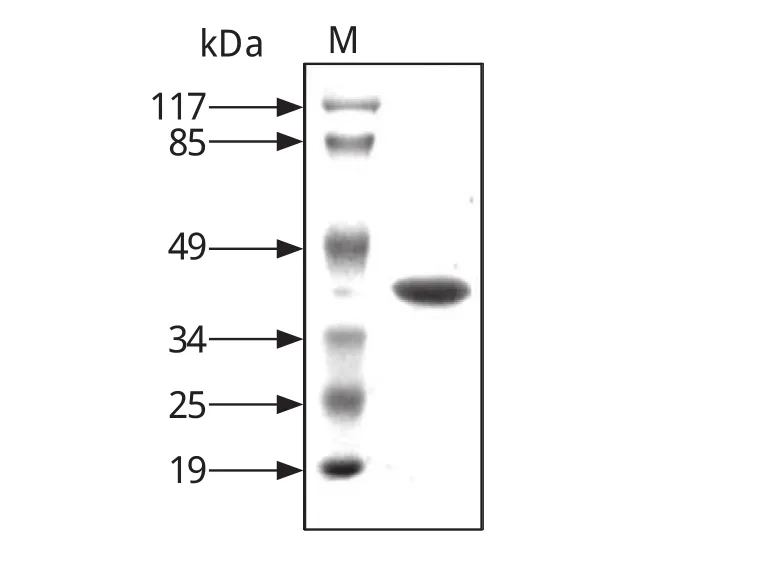
图5 纯化重组蛋白的10% SDS-PAGE检测Fi. 5 10% SDS-PAGE analysis of purified recombinant protein
2.5 Western blot分析 Western blot结果显示在约41kDa位置出现单一条带,与日本血吸虫重组蛋白CIAPIN1分子量一致,表明免疫血清能识别日本血吸虫重组蛋白SjCIAPIN1,并且具有较好的特异性(图6)。

图6 重组蛋白SjCIAPIN1的Western blot分析Fig 6 Western blot analysis of purified recombinant protein
3 讨论
细胞凋亡在生物体的正常发育、器官分化、生理更新等生命过程中扮演着不可或缺的角色[5]。在病理状态下,凋亡缺陷会引起细胞过度或者恶性增长,反之,过度凋亡则会导致生理器官损伤[6]。因此,细胞凋亡的准确调控对生命进程显得极为重要。CIAPIN1是近年新发现的一个细胞凋亡抑制分子,又名V62或Anamorsin,因其表达受白介素3(IL-3)、血小板生成素(thrombopoietin, TPO)、红细胞生成素(erythropoietin, EPO)和干细胞因子(stem cell factor)等细胞因子激活而得名[1,2]。目前,CIAPIN1基因已在多个物种被成功克隆,如人CIAPIN1,小鼠Anamorsin,酵母Dre2等。 最早,CIAPIN1基因是在研究胃癌多药耐药(MDR)相关分子时被发现,在SGC7901/VCR耐药细胞中CIAPIN1基因表达上调,提示其在胃癌DMR中发挥重要作用[7]。Shibayama等[2]报道Anamorsin可介导小鼠的前B细胞系Ba/F3抵抗细胞因子IL-3撤除所致凋亡;基因敲除实验显示,敲除CIAPIN1的小鼠因为贫血而在胚胎期死亡,说明CIAPIN1最显著的作用是促进胎肝红系前体细胞的存活和定向分化,其次敲除CIAPIN1的小鼠心肌发育也出出异常。同时,免疫组化实验结果揭示CIAPIN1广泛分布于细胞质、细胞核中,但在核仁处尤为集中[8]。 这些研究结果提示CIAPIN1在生物体生命过程中扮演着重要角色。
本研究利用生物信息学并结合分子生物学实验对日本血吸虫SjCIAPIN1基因进行初步研究,克隆了日本血吸虫SjCIAPIN1蛋白,获得了重组表达蛋白,制备了针对SjCIAPIN1蛋白特异性较强的多克隆抗体,为进一步研究SjCIAPIN1蛋白功能奠定了初步基础。
[1]Hirohiko S, Emi T, Itaru M, et al. Identification of a Cytokine-induced Antiapoptotic Molecule Anamorsin Essential for Definitive Hematopoiesis[J]. J Exp Med,2004, 199(4): 581-592.
[2]Kanakura Y. Regulation and dysregulation of hematopoiesis by a cytokine-induced antiapoptotic molecule anamorsin[J].J Hematology, 2005, 10 Suppl 1: 73-75.
[3]Li X, Hao Z, Fan R, et al. CIAPIN1 inhibits gastric cancer cell proliferation and cell cycle progression by downregulating cyclin D1 and upregulating p27[J]. Cancer Biol Ther, 2007, 6(10): 1539-1545.
[4]Li X, Liu H, Zhao Y, et al. A new apoptosis inhibitor,CIAPIN1 (cytokine-induced apoptosis inhibitor 1),mediates multidrug resistance in leukemia cells by regulating MDR-1, Bcl-2, and Bax[J]. Biochem Cell Biol,2007, 85(6): 741-750.
[5]Thompson C B. Apoptosis in the pathogenesis and treatment of disease[J]. Science, 1995, 267: 1456-1460.
[6]Li J, Christopher A B, Yang S, et al. Nitric oxide suppresses apoptosis via interrupting caspase activation and mitochondrial dysfunction in cultured hepatocytes[J].Biol Chem, 1999, 274(24): 17325-17333.
[7]Zhao Y, You H, Liu F, et al. Differentially expressed gene Profiles between multidrug resistant gastric adenocarcinoma cells and their parental cells[J]. Cancer Lett, 2002, 185(2): 211-218.
[8]Hao Z, Li X, Qiao T, et al. Subcellular Localization of CIAPIN1[J]. J Histochem Cytochem, 2006, 54(12): 1437-1444.

