纳米粒子基因复合体应用于脊髓损伤治疗的实验研究*
刘忠瑞,邵国喜,徐峰,刘钦毅,呼春
吉林大学第二医院骨科,长春130041
细胞生物学和分子生物学的发展为脊髓损伤(spinal cord injury,SCI)的治疗提供了新的手段,其中细胞移植和基因治疗是两种最有前途的方法。本实验将壳聚糖纳米粒子胶质细胞源性神经营养因子基因复合体(Complex of Chitosan Nanoparticle and Glial Cell Line Derived NeurotrophicFactor,CS-nano/pcDNA3.1/GDNF)转入SCI部位,观察GDNF的表达效率及对损伤脊髓的营养作用。
1 材料与方法
1.1 材料 ①实验动物:健康Wistar大鼠170只,体质量 200~ 250 g,雌雄不拘,随机分为5组:A组(椎板切除+SCI+CS-nano/pcDNA3.1/GDNF,n=40),B组 (椎板切除+SCI+GDNF基因治疗,n=40),C组(椎板切除+SCI+壳聚糖纳米粒子,n=40),D组为单纯损伤组(椎板切除+SCI,n=40),E组为对照组(椎板切除,n=10)。②主要材料:CS-nano/pcDNA3.1/GDNF已制备。
1.2 方法
1.2.1 SCI模型制备与给药 SCI模型制备应用改良 Allen氏垂直重量打击法(weight-drooping)法。应用质量为10 g的冲击棒自10 cm长玻璃管垂直自由下落击打脊髓背侧圆形垫片,同时对脊髓造成打击,冲击棒直径为3 mm。采用脊髓内直接注射法给药,用微量注射器吸取3~4 μ L混合液,注入A~D组损伤部头端的脊髓组织内,分不同方向选 3点注射,缓慢注射,留针 10~15 min。随后缓慢取出微量注射器,逐层缝合伤口。
1.2.2 石蜡切片制作及HE染色 大鼠SCI后10 h处死,取脊髓组织,置福尔马林固定液中固定24 h,用自来水冲净固定液后浸于70%酒精中4℃保存。系列脱水后石蜡包埋,切片厚度4 μ m,常规 HE染色,取受损部脊髓做连续冰冻切片,片厚20 μ m,染色流程为:蒸馏水洗,Mayer苏木精2 min,自来水蓝化20 min,蒸馏水洗,1%伊红15 min,蒸馏水洗,梯度酒精脱水,二甲苯透明,中性树胶封片,光镜下观察SCI情况。
1.2.3 大鼠脊髓组织的GDNF免疫组织化学染色 大鼠 SCI后 5、10、20、48 h分别处死大鼠,取脊髓组织,制作石蜡切片,然后进行如下操作:①石蜡切片常规脱蜡,PBS洗5 min×3次,阻断(0.3%H2O2和甲醇)20 min,PBS洗 5 min×3次;②加正常 10%羊血清封闭20 min,倾去血清后加GDNF抗体,置于湿盒4°C过夜。PBS洗5 min×3次;③滴加生物素标记的二抗,37°C孵育30 min,PBS洗5 min×3次;④加链霉亲合素标记的 HRP,37°C孵育 30 min,PBS洗5 min×3次;⑤DAB显色,室温 10 min,苏木素复染,脱水透明,中性树胶封片;⑥光镜下观察脊髓染色情况,胞浆显棕黄色者为阳性染色。
1.2.4 TUNEL检测脊髓细胞凋亡 大鼠SCI后 5、10、20、48 h 分别处死大鼠,取脊髓组织,制作石蜡切片,然后进行如下操作:①将切片常规系列酒精下行入水,蛋白酶K液(0.01 mol/L Tris-HCl配置)浸泡(20 ℃)15 min,入0.3%H2O2甲醇中以封闭内源性过氧化物酶;②PBS洗后,0.1%TritonX-100的0.1%枸橼酸钠液中(4℃)冰浴2 min;③PBS洗后,正常山羊血清封闭10 min,加标记液(POD液)37℃反应30 min;④PBS洗后二氨基联苯胺(diaminobenzidine,DAB)显色 10 min;⑤Mayrow's苏木精复染,脱水透明封片,光镜下观察。
1.3 统计学处理 采用SPSS 14.0统计软件进行Student't检验,结果以(±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 HE染色 光镜下可见损伤段有广泛出血,脊髓结构破坏,出现神经元死亡,白质中可见肿胀轴突和大量空泡,见图1A。
2.2 GDNF免疫组织化学染色 脊髓内GDNF阳性细胞的细胞浆呈棕黄色,表达越高,染色越深。GDNF在E组未见表达,见图1B。SCI后5 h,A~D组均偶尔表达,见图1C。SCI后 10 h,B、C、D 组 GDNF阳性细胞数增高,但在 A组却表达最高,见图1D。SCI后20 h,B、C、D组GDNF 阳性细胞数较10 h略降低,但A组GDNF阳性细胞数仍较高,见图1E。SCI后48 h,A~D组的GDNF阳性细胞数均降低,但A组GDNF阳性细胞数仍明显高于B~D组,见图1F。
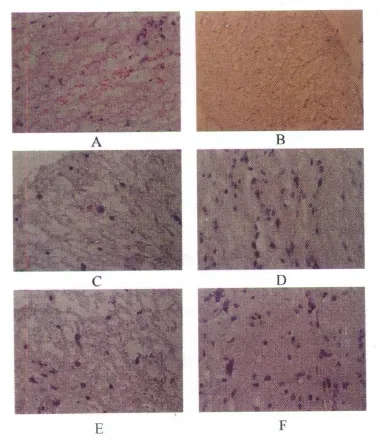
图1 A-F SCI后各组染色 A:HE染色(×400);B:E组免疫组化染色显示GDNF无表达(×100);C:SCI后5 h A~D组免疫组化染色显示GDNF 偶见表达(×400);D-F:SCI后10、20、48 h A组免疫组化染色显示GDNF高表达(×400)
2.3 TUNEL标记及计数结果 SCI后10 h镜下可见,TUNEL阳性细胞的细胞核呈棕褐色颗粒,E组偶见细胞凋亡,B、C、D组均可见较多的细胞凋亡,A组阳性细胞数较B、C、D组明显减少,见图2A-C、表1。
3 讨论
3.1 基因治疗与SCI SCI后,由于中枢神经系统内存在很多抑制神经生长的因素,导致神经元坏死、凋亡增加,轴突生长缓慢,中枢神经系统内环境缺乏神经生长因子,又有许多抑制因子存在,使SCI的恢复十分困难。细胞移植和基因治疗能使基因在损伤局部持续表达,并能替代局部受损的脊髓组织。Ohori等[2]将神经营养因子与绿色荧光蛋白的基因通过逆转录病毒转入神经干细胞,发现能表达多种神经营养因子的神经干细胞能更好地扩增,并能向神经元与少突胶质细胞转化。Tobias等[3]用基因修饰的成纤维细胞移植到大鼠的脊髓半横断区,通过示踪技术观察到它能明显促进红核脊髓束轴突的再生,肢体运动功能也明显改善。吴军等[4]观察神经营养素-3(neurotrophin-3,NT-3)基因转染嗅鞘细胞移植对急性大鼠SCI的作用,发现移植转染后的嗅鞘细胞能在体内长期存活,表达NT-3基因,与对照组比较能更好地促进SCI区轴突的再生和后肢功能的恢复。
3.2 GDNF在SCI中的保护与营养作用GDNF是运动神经元(motor neuron,MN)最强有力的营养因子之一。在体外和体内的试验中,GDNF都能提高胚胎MN的存活及分化,减少MN的凋亡,具有明显的营养作用。Iannotti等[5]制造大鼠脊髓挫伤模型后灌注GDNF,发现34%~42%的受损脊髓功能可以恢复,10%~13%的白质恢复,可以提高损伤部位远近端神经元的数量,这些神经元的轴突还可通过受损的脊髓界面支配下段的脊髓。Zhou等[6]观察大鼠 SCI模型中应用GDNF的最佳时间窗,发现在伤后2周应用GDNF能明显提高MN存活,减少凋亡,增加感觉恢复区域,并能上调一氧化氮合酶,而在4周与6周应用时,GDNF很难发挥神经元保护作用。GDNF家族对调节运动神经轴突的生长和发出分枝发挥重要作用,体外试验发现GDNF可明显提高运动轴突的生长能力[7]。Tang等[8]报道在电烧伤大鼠SCI模型应用腺病毒重组GDNF质粒转入损伤部位,伤后2~3周发现基因移植组运动学评分较对照组明显提高,认为GDNF基因移植能保护神经元并能促进M N功能恢复。本实验神经细胞的凋亡与GDNF的表达呈负相关,表明GDNF具有明显的神经元保护功能。
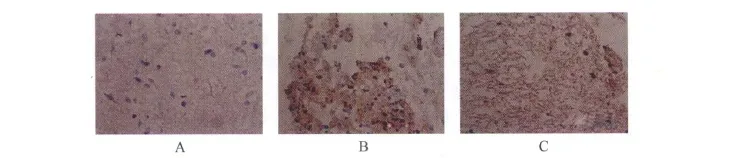
图2 A-C SCI后10 h各组TUNEL染色 A:E组偶见阳性细胞;B:B、C、D组可见较多阳性细胞;C:A组可见较少阳性细胞
表1 各时间点每张切片TUNEL阳性细胞计数(个,±s)

表1 各时间点每张切片TUNEL阳性细胞计数(个,±s)
与E组比较,①P<0.01;与D组比较,②P<0.01
?
3.3 壳聚糖纳米粒子作为基因载体的研究
研究表明,利用纳米技术,如利用金纳米微粒结合杂交DNA片段,很容易进入机体细胞核并与核内染色体组合,具有较高的特异性[9]。在基因治疗中,质粒DNA插入目的细胞的基因组后,可修复遗传错误或产生治疗因子(如多肽、蛋白质、抗原、抗体等)。将质粒DNA浓缩成纳米微粒并带上负电荷,将更容易进入细胞核主动靶向作用于肿瘤细胞。壳聚糖纳米粒子作为载体,能够携带基因实现细胞内转移,并具有明显的靶向性作用。Chandy等[9]制备壳聚糖包衣的PLA/PLGA微球,用于5-氟尿嘧啶的脑胶质瘤的靶向治疗,发现药物初次突释后呈典型的二相释药,可靶向治疗脑胶质瘤,且稳定释放≥30 d。本实验中,A组脊髓组织GDNF明显表达,并对脊髓呈现明显的保护作用,而单纯应用质粒基因治疗由于没有壳聚糖载体的协助,不能转移到细胞内有效表达GDNF,对SCI无明显保护作用。本实验还表明单纯应用质粒基因组与单纯损伤组的细胞凋亡和GDNF表达比较无统计学差异。
如何选择合适的基因载体,如何充分利用纳米粒子的特性,提高其穿梭效率,使目的基因在受体中高效持续表达,是纳米粒子基因载体研究的重要任务。
[1]Kwon BK,Dvorak MF,Fishera CG.Spinal cord injury regenerative strategies and obstacles[J].Curr Opin in Orthop,2004,15(3):196-201.
[2]Ohori Y,Yamamoto S,Naqao M,et al.Growth factor treatment and genetic manipulation stimulate neurogenesis and oligodendrogenesis by endogenous neural progenitors in the injured adult spinal cord[J].Neurosci,2006,26(46):11948-11060.
[3]Tobias CA,Shumsky JS,Shibata M,et al.Delayed grafting of BDNF and NT-3 producing fibroblasts into the injured spinal cord stimulates sprouting,partially rescues axotomized red nucleus neurons from loss and atrophy,and provides limited regeneration[J].Exp Neurol,2003,184(1):97-113.
[4]吴军,孙天胜,王献章,等.神经营养素-3基因修饰嗅鞘细胞移植对急性脊髓损伤作用的实验研究[J].中国脊柱脊髓杂志,2006,12(2):147-151.
[5]Iannotti C,Zhang PY,Shields CB,et al.A neuroprotective role of glial cell line-derived neurotrophic factor following moderate spinal cord contusion injury[J].Exp Neurol,2004,189(2):317-322.
[6]Zhou LH,Wu W.Survival of injured spinal motoneurons in adult rat upon treatment with glial cell line-derived neurotrophic factor at 2 weeks but not at 4 weeks after root avulsion[J].J Neurotrauma,2006,23(6):920-927.
[7]Markus A,Patel TD,Snider WD.Neurotrophic factors and axonal growth[J].Curr Opin Neurobiol,2002,12(5):523-531.
[8]Tang XO,Wang Y,Huang ZH,et al.Adenovirus-mediated delivery of GDNF ameliorates corticospinal neuronal atrophy and motor function deficits in rats with spinal cord injury[J].Neuroreport,2004,15(3):425-429.
[9]Csaki A,Moller R,Fritzsche W.Gold nanoparticles as novel label for DNA diagnostics[J].Expert Rev Mol Diagn,2002,2(2):187-193.

