黑曲霉糖化酶分离纯化与酶学性质研究
梁新红,孙俊良,唐玉,郭祖峰
(河南科技学院,河南新乡453003)
糖化酶又称葡萄糖淀粉酶(Glucoamylase EC 3.2.1.3),是一种外切型糖苷酶,从淀粉的非还原性末端依次水解α-1,4糖苷键,水解下一个个葡萄糖单元,工业上用于将淀粉转化为葡萄糖,因而广泛地用于制药、制酒及氨基酸、有机酸行业,是最重要的工业酶制剂之一[1-2].黑曲霉(Aspergillus niger)是生产葡萄糖淀粉酶重要菌株之一[3-4].发酵液中糖化酶的分离纯化及酶学性质研究对糖化酶在工业中应用至关重要[5].本研究拟对已筛选到的A.niger FJL 0801进行分离纯化,并研究其酶学性质,以丰富糖化酶研究内容,为可能的工业应用开发新的糖化酶资源.
1 试验材料与方法
1.1 试验材料
菌种:黑曲霉(Aspergillus niger FJL0801),河南科技学院食品学院微生物实验室冷藏保存.
DEAE-Fast Flow阴离子交换柱(16 mm×100 mm),Superdex-75层析柱(26 mm×600 mm),美国惠普公司.
1.2 试验方法
1.2.1 发酵产酶条件 发酵摇瓶培养基:淀粉 10 g;NaNO32 g;K2HPO41 g;KCl 0.5 g;MgSO4·7H2O 0.5 g;FeSO4·7H2O0.01 g;蒸馏水 1 000 mL,自然 pH.
发酵摇瓶培养:把发酵摇瓶培养基装入250 mL三角瓶中,装液量为80 mL.按5%接种量把半干体培养基接种于发酵摇瓶培养基中,于33℃下恒温摇床培养,转速为210 r/min.
1.2.2 糖化酶的分离纯化 发酵液6 000 r/min离心15 min去菌体,所得上清液为粗酶液,总量为200 mL.粗酶液进行80%饱和的硫酸铵盐析沉淀,8 000 r/min离心30 min,沉淀经去离子水透析,进行冷冻干燥.冻干后,用3mL柠檬酸-磷酸氢二钠(pH4.5)缓冲液溶解后,上DEAE-52阴离子交换柱(16mm×100mm),采用10 mmol的Tris-HCl缓冲液(含2 mmol CaCl2,pH8.4)进行平衡,上样后使用含有0~1 mol NaCl的同样缓冲液进行梯度洗脱,洗脱速度为2 mL/min,收集合并酶活峰后,上预先经10 mmol的Tris-HCl(pH6.5)缓冲液平衡好的Superdex-50层析柱(26 mm×600 mm)进行洗脱,洗脱速度2 mL/min,收集合并酶活峰,经去离子水透析,冻干,用于酶学性质研究.
1.2.3 糖化酶活力测定方法 粗酶液活力按照GB/T1805.2-93测定[6].
1.2.4 蛋白含量测定 按Bradford方法测定[7],以牛血清白蛋白绘制标准曲线.
1.3 酶学性质
1.3.1 最适反应温度及热稳定性 在不同温度下按照标准方法测定酶活,以酶活最高者为100%.热稳定性试验中测残余酶相对活力,以未保温的酶液的酶活为100%.
1.3.2 酶的最适反应pH值及pH值稳定性 将酶液分别用pH3.0~6.0柠檬酸-柠檬酸钠缓冲液,pH6.0~8.0磷酸氢二钠-柠檬酸缓冲液稀释,按标准方法测酶活力.
1.4 数据处理
试验平行重复4次.采用DPSv7.55数据处理软件对试验数据的方差显著性进行分析.
2 结果与分析
2.1 酶的分离纯化
黑曲霉糖化酶粗酶液经硫酸铵盐析、DEAE-52阴离子交换柱和SephadexG-50凝胶层析后,酶蛋白得到明显纯化.糖化酶的纯化结果如表1.

表1 糖化酶纯化结果

图1 温度对A.niger FJL 0801糖化酶活性的影响
由表1可知,纯化后酶的比活力达到了58.40 U/mg,较粗酶液纯化了38.42倍.但在纯化过程中,酶活回收率达到17.45%,酶蛋白的损失主要在DEAE-52阴离子交换柱及SephadexG-50凝胶层析.
2.2 酶的最适反应温度
把经分离纯化的糖化酶在不同温度下测定酶的活力,以探索糖化酶最适作用温度,结果如图1.
由图1可知,A.niger FJL 0801糖化酶在30~60℃的温度范围内随着温度升高,相对酶活力(相对酶活规定方法:在一定温度下所测最高酶活,其相对酶活为100%)逐渐升高,在温度为60℃时,相对酶活达最高100%.反应温度高于60℃后,相对酶活急剧下降,温度为70℃时,相对酶活只有16.57%±0.94%,当温度达到90℃时,酶活为零.因此,糖化酶最适作用温度为60℃.
2.3 酶的温度稳定性
把经分离纯化的糖化酶分别在30~60℃下保温2 h,然后测定其残留酶活,即为糖化酶在此温度下稳定性,结果如图2.
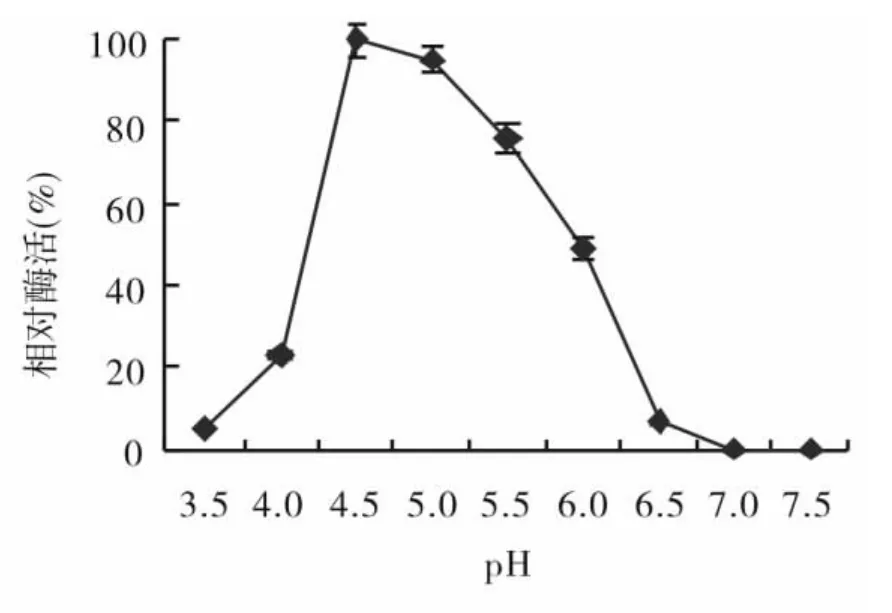
图3 pH值对A.niger FJL 0801糖化酶活性的影响

图2 A.niger FJL 0801糖化酶的温度稳定性
由图2可知,糖化酶经2 h保温后,在30~60℃温度范围内其酶活均有损失,温度越高,酶活损失越多.在30℃下,保温2 h后,相对酶活(在不同温度下未保温前测定酶活力的相对酶活力为100%.然后在同样温度下保温2 h,再次进行酶活力的测定,测定残留酶活与未保温酶活之比为保温后的相对酶活)为92%±3.2%;在最适作用温度60℃下,保温2 h后,相对酶活只有42%±2.8%.因此,在糖化酶应用时,应同时考虑酶的最适作用温度及应用温度的稳定性,以达到最优糖化效果.
2.4 酶最适作用pH值
考察在pH值范围为3.5~7.5的经分离纯化的A.niger FJL 0801糖化酶的最适反应pH值.结果如图3.由图3可知,该酶的的最适反应pH值为4.5,在pH4.5~5.5有较高的活力,其相对酶活(规定0 h测定酶活值的相对酶活为100%,其它时间相对酶活为测定酶活值与0 h酶活值之比)为100%±4.13%~76.23%±3.25%.在pH为3.5和6.5时,酶活极低,相对酶活分别只有5.1%±0.26%和6.59%±0.36%,在pH为7.0时,检测不到酶活,酶活为0.因此,糖化酶最适作用pH值为4.5,酶应用中,溶液pH值应高于4.0及低于6.0.
2.5 酶的pH值稳定性
在pH值为4.5时60℃保存一定时间,考察最适作用pH值稳定性.保存时间设定为0~2 h,结果如图4.
由图4可知,糖化酶在最适作用pH值下,60℃作用糊精溶液0~120 min,其相对酶活从100%±3.19%降至42%±2.8%,表明在最适作用温度及pH值下,其酶活力逐渐下降.作用时间在60 min以内,其酶活保存89%±2.56%;继续增加作用时间,其酶活保存率较低,从89%±2.56%降至42%±2.8%.因此,在糖化酶应用中,在酶的最适温度和pH值下,应掌握好酶的作用时间.
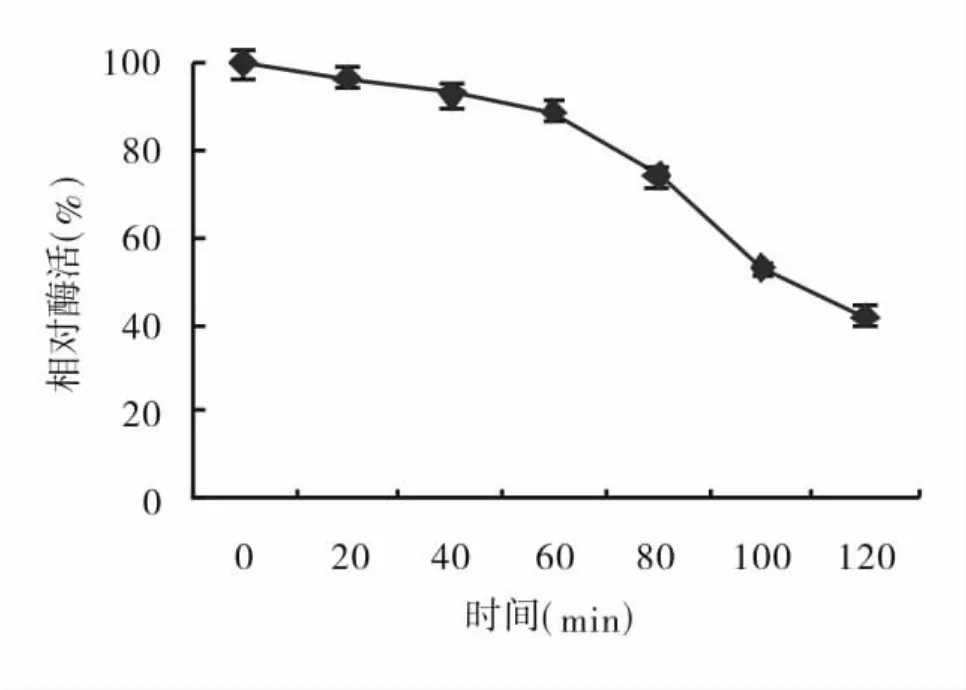
图4 A.niger FJL 0801糖化酶的pH值稳定性
3 结论
黑曲霉糖化酶粗酶液经硫酸铵盐析、DEAE-52阴离子交换柱和SephadexG-50凝胶层析后,酶的比活力达到了58.40 U/mg,较粗酶液纯化了38.42倍,酶活回收率达到17.45%.
经分离纯化的糖化酶其最适作用温度为60℃;糖化酶在30℃下,保温2 h后,相对酶活为92±3.2%;在最适作用温度60℃下,保温2 h后,相对酶活只有42%±2.8%.
酶的的最适反应pH值为4.5,在pH4.5下,60℃作用糊精溶液作用时间在60 min以内,其酶活保存89%±2.56%;继续增加作用时间,其酶活保存率较低,从89%±2.56%降至42%±2.8%.
通过糖化酶的最适作用温度、pH及其稳定性研究,其酶学性质基本符合淀粉糖化工业化过程中对酶的要求,该酶比较适合应用于淀粉糖化工业.
[1]Giordano R L,Trovati J,Schmidell W.Continuous production of ethanol from starch using glucoamylase and yeast co-immobilized in pectin gel[J].Applied Biochemistryand Biotechnology,2008,147(1-3):47-61.
[2]李旺军,方华,谢广发,等.RSM法优化Aspergillus oryzae AO-01产糖化酶条件的研究[J].食品科学,2007,28(11):322-327.
[3]孙俊良,李新华,梁新红.不同碳源对黑曲霉产糖化酶活力的影响[J].食品科学,2008,29(8):433-436.
[4]WangQH,WangXQ,WangXM.Glucoamylase production fromfood waste byAspergillus niger under submerged fermentation[J].Process Biochemistry,2008,43(3):280-286.
[5]Kumar P,Satyanarayana T.Optimization of culture variables for improving glucoamylase production by alginate-entrappedThermomucor indicae-seudaticaeusingstatistical methods[J].Bioresource Technology,2007,98(6):1252-1259.
[6]田栖静,吴炳炎,侯炳炎,等.工业酶制剂通用试验方法[M].北京:中国轻工业出版社,1994:122-127.
[7]韦平和.生物化学实验与指导[M].北京:中国医药科技出版社,2003:25-26.

