异环磷酰胺联合依托泊苷在多线难治性乳腺癌中的疗效及安全分析
萧剑军,彭杰文,贺景焕,江小梅,殷兆锋
中山大学附属中山医院肿瘤中心化疗科,广东中山 528403
在绝大数复发转移性乳腺癌中,辅助化疗或姑息化疗中已使用了含有蒽环及紫杉类的方案,因此对于蒽环及紫杉类耐药的多线难治性乳腺癌的治疗成为了临床的难题,目前尚无最佳的治疗策略,治疗目的是控制症状及延缓肿瘤进展[1]。三阴乳腺癌(TNBC)在乳腺癌中占15%,它们没有表达雌激素、孕激素和Her-2受体,具有特殊的生物学特点,缺乏有效的治疗靶点,临床上常常表现为复发转移率高、生存时间短等[2]。一项回顾性研究显示铂类在TNBC的有效性明显高于非TNBC[3],可能是由于TNBC存在DNA错配修复缺陷,因此TNBC可能对其他烷化剂也敏感[4]。来自Ⅱ期临床试验显示在复发难治性乳腺癌中,异环磷酰胺(IFO)单药的有效率约为23%[5],而联合长春瑞滨的有效率约52%,主要毒副反应为血液学毒性,并且可以耐受及可管理的[6]。Aziz等[7]学者证实在转移性乳腺癌中依托泊苷(VP-16)单药有效率约为30%,而对于初治的患者,其有效率高达57%。
IFO是一种细胞周期非特异性烷化剂,而VP-16是细胞周期特异性药物,两种药物的抗肿瘤机制不同以及不存在交叉耐药,尽管两者在血液学毒性方面有叠加。本文回顾性分析异环磷酰胺和依托泊苷联合方案(IE)在多线难治性乳腺癌中的有效性及安全性。
1 资料与方法
1.1 入选标准
复发转移性乳腺癌,年龄不超过65岁,ECOGPS评分≤2,既往接受过蒽环和紫杉类化疗,不同时合并有中枢系统转移,至少有一个可评价病灶,中性粒细胞>1.5×109/L,血小板>100×109/L,转氨酶<2.5倍正常上限,肌酐<1.5倍正常上限。
1.2 一般资料
收集中山大学附属中山医院2003年1月~2009年12月诊治的复发转移性乳腺癌,符合试验入选标准者共有42例。中位年龄为 55.3 岁(33~65 岁),37例(88.1%)为绝经后女性,常见的转移部位依次是淋巴结30例(71.4%)、骨28例(66.7%)、肺 22例(52.4%)和肝 16例(38.1%);35例(83.3%)出现2个或2个以上器官转移,TNBC的病例有10例,所有患者既往均接受过蒽环和紫杉类药物化疗,并接受过二线以上方案化疗。
1.3 治疗方案
IFO 1.5 g/m2,1~5 d 静脉滴注 3 h;美司钠(Mesna)400 mg,静脉推注, 于 IFO 静滴时 1~5 d 为 0、4、8 h;1~3 d 静脉滴注VP-16 100 mg/m2;每4周为1个疗程,如果出现剂量限制性毒性可进行剂量调整,整个化疗周期不超过6个疗程。对于预计出现Ⅳ度中性粒细胞减少的风险超过20%的患者,化疗后行预防性升白治疗。
1.4 疗效判定
有效性分析,疗效评价参考RECIST1.0标准,所有病灶均消失为完全缓解(CR),靶病灶最长径之和缩小不低于30%为部分缓解(PR),增加超过20%或出现新病灶为进展(PD),介于部分缓解与进展之间为稳定(SD)。缓解持续时间是指获得CR或PR的患者从接受治疗之时算起直到出现肿瘤进展。客观缓解率(ORR)是指获得CR与PR患者的比例。临床获益率是指获得CR、PR与SD患者的比例。无进展时间(TTP)表示患者接受治疗之时直到出现肿瘤进展或死亡。
1.5 毒性分级评价
参照常规毒性判定标准(NCI-CTC)[8]:包括心脏毒性、肺毒性、肾毒性等,将其分为0级、正常、正常/标准范围内(WNL)、无。一级为轻度毒性,二级为中度毒性,三级为重度毒性,四级为不能活动,威胁生命的毒性,五级为死于毒性。
2 结果
2.1 临床疗效
42例患者接受的化疗周期总数为213个疗程,平均为5.1个疗程;IFO的剂量强度为75%,VP-16的剂量强度为80%。42例均符合化疗有效性及安全性分析,其中CR、PR、SD和PD分别是 3例 (7.1%)、8例 (19.1%)、13例 (30.9%)和 18例(42.9%);ORR 为 26.2%(11/42), 临床获益率为 57.1%(24/42),平均缓解持续时间为5.3个月,TTP为4.3个月。10例TNBC 患者,其 CR、PR、SD 和 PD 分别是 1例(10.0%)、3例(30.0%)、3 例(30.0%)和 3 例(30.0%),ORR 为 40.0%(4/10),临床获益率为70.0%(7/10),平均缓解持续时间为5.8个月,TTP为5.0个月。
2.2 毒副反应
IE联合方案常见的毒副反应为血液学毒性,其中以3~4级中性粒细胞减少最常见(52.4%),其次是3~4级血小板减少(28.6%),血液学毒性是导致化疗剂量强度下降及化疗推迟的主要原因;而非血液毒性相对少见,大部分治疗相关性毒副反应是轻中度,基本上可以耐受,见表1。未出现治疗相关死亡。
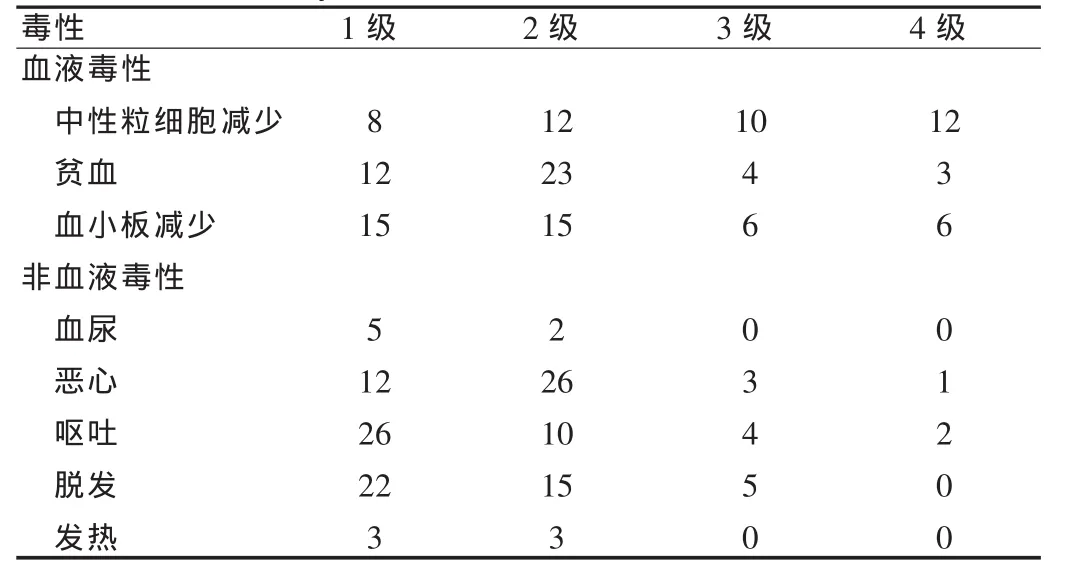
表1 治疗相关毒副反应总结(例)Tab.1 Summary of treatment-related adverse events(case)
3 讨论
尽管乳腺癌早期筛查和术后辅助治疗手段的不断改进,复发转移性乳腺癌仍然常见。蒽环及紫杉类药物是乳腺癌最有效的药物,单药有效率为20%~40%,而联合方案的有效率高达70%~80%[9],常用于转移性乳腺癌的一、二线化疗。对于蒽环及紫杉耐药的转移性乳腺癌中,有效的化疗方案很少,CECOG推荐对于蒽环及紫杉耐药的转移性乳腺癌,可选择卡培他滨、吉西他滨、长春瑞滨及Ixabepilone单药或联合方案[10]。一项Ⅱ期临床研究利用卡培他滨单药治疗对紫杉耐药的转移性乳腺癌,其有效率约为15%,无进展时间为3.5个月,其毒副反应为轻中度[11]。在本研究中,42例乳腺癌均对蒽环及紫杉类耐药,且为多线治疗后进展,IE联合方案的有效率约为26.2%,无进展时间约为4.3个月,伴有明显的血液学毒性。西班牙一项研究(吉西他滨与长春瑞滨联合方案与长春瑞滨单药比较)发现联合方案的客观缓解率 (36%vs 26%)、无进展时间(6.0个月vs 4.0个月)明显高于单药,而总生存没有明显优势及更高的毒副反应[12]。另一项Ⅲ期临床试验证实Ixabepilone与卡培他滨联合方案的客观缓解率(35%vs 14%)、无进展时间(5.8个月vs 4.2个月)明显高于卡培他滨单药,同样联合方案的毒副反应更加明显[13]。笔者发现以上两个联合方案的有效性高于本研究的IE方案。目前证据显示联合方案的缓解率及无进展时间明显优于单药,但两者的总生存情况没有差异,但联合方案的毒副反应更加显著[14]。因此,在晚期乳腺癌治疗中,单药序贯或联合方案之间的选择仍有较大争议,在方案的选择上,需要权衡所选方案的利与弊。对合并多个内脏器官转移、全身症状明显以及一般状况好的患者,联合方案是一个合理的选择,因为能较快降低肿瘤负荷,减轻肿瘤相关症状及延缓进展。
目前,在乳腺癌中IFO的给药方式仍有争议。本研究IFO的用法是静脉滴注3 h,其有效率约为26.2%,临床获益率为57.1%。Christian等[15]学者将IE方案中的IFO改为静滴1 h,其客观缓解率约为22%,临床获益率约为44%。而来自土耳其的研究将IE方案中的IFO改为持续静滴24 h,其客观缓解率约为23%,临床获益率约为51.3%[16]。来自肉瘤的研究显示IFO静脉滴注2~3 h比持续滴注更长时间的有效性更高[17]。尽管3个研究之间存在着差异,不能简单地直接比较,但异环磷酰胺作为一种浓度依赖性细胞周期非特异性药物,并且根据来自软组织肉瘤的相关研究结果,笔者认为IFO静滴3 h可能是一个更加合理的给药方式,因为疗效不降低,且患者负担明显减轻。
TNBC具有特殊的生物学特点,缺乏有效的治疗靶点,目前缺乏有效的标准化疗方案[2-3]。本实验显示在TNBC中,IE联合方案的有效性似乎更高,其分子机制尚未明确。三阴乳腺癌是一种BRCA-1相关肿瘤,其存在DNA错配修复缺陷,导致基因不稳定性,暗示其可能对某种化疗药物有效[5]。体外研究显示烷化剂铂类及丝裂霉素通过引起DNA双链间交叉相连、VP-16通过引起DNA双链断裂在三阴乳腺癌中发挥有效的抗肿瘤作用[18-20]。笔者的研究进一步增加了IFO及VP-16在TNBC体外研究的证据,但需要更大规模的研究加以证实。
多线难治性乳腺癌常合并多个内脏器官转移,一般状态稍差,对联合方案化疗的耐受性可能降低。本研究显示IE联合方案的副反应主要是血液学毒性,表现在3~4级中性粒细胞减少,是IE方案剂量调整最主要的原因,IFO的剂量强度为75%,VP-16的剂量强度为80%。本试验通过降低剂量强度、推迟化疗时间及预防性升白细胞治疗等提高联合方案化疗的耐受性。总体而言,IE联合方案的毒副反应是可以管理的,但是增加了治疗费用。
综上所述,在多线难治性乳腺癌中,尤其是三阴乳腺癌,异环磷酰胺与依托泊苷联合方案可能是一个有效的化疗方案,并且其主要毒副反应是可管理的。
[1]Cardoso F,Di Leo A,Lohrisch C,et al.Second and subsequent lines of chemotherapy for metastatic breast cancer:what did we learn in the last two decades[J].Ann Oncol,2002,13(2):197-207.
[2]Susan Cleator,Wolfgang Heller,R Charles Coombes.Triple-negative breast cancer:therapeutic options[J].Lancet Oncol,2007,8:235-244.
[3]罗湘,史艳侠,李志铭,等.三阴乳腺癌的临床病理特征和预后分析[J].中国癌症杂志,2009,19(7):517-22.
[4]Sirohi B,Arnedos M,Popat S,et al.Platinum-Based Chemotherapy in Triple-Negative Breast Cancer[J].Ann Oncol,2008,19(11):1847-1852.
[5]Kennedy RD,Quinn JE,Mullan PB,et al.The role of BRCA1 in the cellular response to chemotherapy[J].JNatl Cancer Inst,2004,96:1659-1668.
[6]Bisagni G,Boni C,Manenti AL,et al.Ifosfamide bolus followed by five days continuous infusion in extensively pretreated patients with advanced breast cancer:a phase II study[J].Tumori,1998,84(6):659-61.
[7]Aziz Z,Rehman A,Qazi S.Ifosfamide and vinorelbine in metastatic breast cancer in patients with prior anthracycline therap y[J].Cancer Chemother Pharmacol,1999,44(Suppl):9-12.
[8]渋谷昌彦.新的药物毒副反应判定标准:NCI-CTC2.0版本[J].日本医学介绍,2001,22(11):483-486.
[9]Devita VT Jr,Hellman S,Rosenberg SA.Cancer:Principles and Practices of Oncology[M].5th ed.Philadelphia:Lippincott-Raven,1997:1541-57.
[10]Beslija S,Bonneterre J,Burstein HJ,et al.Third consensus on medical treatment of metastatic breast cancer[J].Ann Oncol,2009,20(11):1771-85.
[11]Reichardt P,Von Minckwitz G,Thuss-Patience PC,etal.Multicenter phase IIstudy of oral capecitabine(XelodaR)in patients with metastatic breast cancer relapsing after treatment with a taxane-containing therapy[J].Ann Oncol,2003,14(8):1227-1233.
[12]Martín M,Ruiz A,Muoz M,et al.Gemcitabine plus vinorelbine versus vinorelbine monotherapy in patients with metastatic breast cancer previously treated with anthracyclines and taxanes:final results of the phase IIISpanish Breast Cancer Research Group(GEICAM)trial[J].Lancet Oncol,2007,8(3):219-225.
[13]Thomas ES,Gomez HL,Li RK,et al.Ixabepilone plus capecitabine for metastatic breast cancer progressing after anthracycline and taxane treatment[J].JClin Oncol,2007,25(33):5210-5217.
[14]Fossati R,Confalonieri C,Torri V,et al.Cytotoxic and hormonal treatment for metastatic breast cancer:a systematic review of published randomized trials involving 31 510 women[J].J Clin Oncol,1998,16:3439-3460.
[15]Christian M,Peter W,Jutta B,et al.Ifosfamide/etoposide and mesnauroprotection in advanced breast cancer[J].Cancer Chemother Pharmacol,1990,26(Suppl):S87-S90.
[16]Kiraz S,Baltali E,Güler N,et al.Ifosfamide and etoposide in previously treated patients with advanced breast cancer[J].Tumori,1997,83(2):604-607.
[17]Patel S,Vadhan-Raj S,Papadopoulos N,et al.High-dose ifosfamide in bone and soft-tissue sarcomas:Results of phase II and pilot studies–Dose response and schedule dependence[J].J Clin Oncol,1997,15:2378-2384.
[18]Moynahan ME,Cui TY,Jasin M.Homology-directed dna repair,mitomycin-c resistance,and chromosome stability is restored with correction of a Brcal mutation[J].Cancer Res,2001,61:4842-4850.
[19]Bhattacharyya A,Ear US,Koller BH,et al.The breast cancer susceptibility gene BRCA1 is required for subnuclear assembly of Rad51 and survival following treatment with the DNA cross-linking agent cisplatin[J].JBiol Chem,2000,275:899-903.
[20]Quinn JE,Kennedy RD,Mullan PB,et al.BRCA1 functionsasa dierential modulator of chemotherapy-induced apoptosis[J].Cancer Res,2003,63:6221-6228.

