内淋巴积水豚鼠模型制作
董昶 综述 华清泉 刘阳 审校
内淋巴积水豚鼠模型制作
董昶1综述 华清泉1刘阳2审校
自1861年法国学者Prosper Meniere首次报道了梅尼埃病以来,后人从病因、病理、生理、诊断、治疗等各方面对其进行了大量的研究。1938年Hallpike首先通过梅尼埃病患者颞骨尸检揭示了梅尼埃病的组织病理学特征为膜迷路积水。由于涉及伦理道德等问题,继续研究梅尼埃病需要寻找一种与人耳结构相似且制作膜迷路积水简便的动物。豚鼠听觉灵敏且其颞骨与人类颞骨相似,已成为耳科学研究常用的实验动物。本文就目前建立豚鼠膜迷路积水模型的原理、方法、成功率及特点等进行综述。
1 减少内淋巴吸收诱导内淋巴积水
内淋巴液的产生和吸收是动态平衡的过程,此类模型制作原理是基于内淋巴囊是内淋巴液吸收的主要部位,通过直接阻断内淋巴管和囊、破坏内淋巴囊周围血管,间接影响内淋巴液吸收,从而导致内淋巴积水。
1.1 阻塞内淋巴管和囊致内淋巴积水
1.1.1 顶枕进路阻塞内淋巴管和囊 Kimura等[1]通过手术阻塞豚鼠内淋巴管和囊,首次在豚鼠体内复制出膜迷路积水模型,从而为研究内淋巴积水的内耳组织学、病理生理学等创造了一条全新的途径。方法:豚鼠麻醉后作头皮正中切口,切除枕骨大孔背侧缘至人字缝的枕骨。然后在小脑处切开硬脑膜,岩骨近横窦处小龛即内淋巴囊中部标记,用钻头钻穿前庭导水管,破坏内淋巴囊后沿导管方向再继续追进,最后在钻孔内置入骨蜡,枕骨缺损处填塞明胶海绵,缝合皮肤。
1.1.2 后颅窝硬膜外进路阻塞内淋巴管和囊 为了解决上述制作方法创伤过大的不足,Konishi[2]创立了后颅窝硬膜外进路内淋巴囊导管阻塞术。方法:豚鼠麻醉后行颅顶正中切口,磨去术侧枕骨暴露硬脑膜及乙状窦,剥离硬脑膜至乙状窦前缘,在前庭导水管颅内开口处切断内淋巴囊。再用微电钻沿前庭导水管方向钻入,破坏骨内部分淋巴囊和部分内淋巴导管,然后填以骨蜡、明胶海绵,缝合切口。
王宜南[3]按照Kimura的方法制作豚鼠内淋巴积水模型,通过火棉胶切片比较不同术后存活时间豚鼠内淋巴积水的发生率,结果2~9天为58.3%,10~29天为78.3%,30~55天为100%,总计积水发生率为80.3%。之后陆续有学者报道手术方法制作内淋巴积水模型成功率可达100%。
通过手术方法制作豚鼠内淋巴积水模型的缺点是破坏性过大,造模所需时间较长。另外,临床上发现只有37%的梅尼埃病患者存在解剖异常[4],此法只能解释这些存在颅内解剖异常影响内淋巴回流的现象,并非梅尼埃病的生理模型。其优点是造模成功率很高,是制作内淋巴积水的可靠方法。
1.2 破坏内淋巴囊周围的血管致内淋巴积水 内淋巴囊的血液供应主要来自内耳的前庭后动脉和颈外动脉的分支—脑膜后动脉,静脉回流则是通过横窦。Lee[5]等通过切断脑膜后动脉和前庭导水管外口上、下的乙状窦制作出了内淋巴积水模型。方法:豚鼠麻醉后暴露横窦的弯曲部分全长,然后纵行切开后颅窝的脑膜,腮盖的凹陷骨龛即是前庭导水管外口的位置。将乙状窦轻轻从骨沟中提起,结扎后切断,用眼科烧灼器烧灼前庭导水管外口上下的乙状窦。因脑膜后动脉与乙状窦彼此靠近,故在切除乙状窦的同时也切断了脑膜后动脉。使用明胶海棉填补骨质缺损,缝合肌肉和皮肤。采用火棉胶切片观察膜迷路积水程度,1~2个月后所有豚鼠都出现了耳蜗轻到中度内淋巴积水,球囊出现了中重度的积水,而椭圆囊呈现轻度积水。该方法制作内淋巴积水成功率高,缺点是过程稍繁琐。
1.3 内淋巴囊远端烧灼或全切法致内淋巴积水 Dunnebier[6]为了对内淋巴囊的破坏程度进行标准化,即仅仅导致内淋巴囊骨外部分远侧端轻度纤维化而创立了这两种方法。①烧灼法:麻醉后豚鼠经颅后凹硬膜外径路暴露术耳内淋巴囊,用硝酸银烧灼内淋巴囊的远侧端,最后缝合切口。②全切法:切除乙状窦和内淋巴囊远端间的联系并塞入小片乳胶片将其隔开,后塞入可吸收海绵,缝合切口。手术后23天,采用耳蜗组织切片观察内淋巴积水程度,结果,烧灼法可致40%豚鼠出现轻度积水,且主要出现在顶回;全切法可致75%豚鼠出现中重度内淋巴积水,积水程度较一致。
作者认为这两种方法的原理均是影响到了内淋巴囊的静脉回流从而影响其对内淋巴液的吸收,其优点是组织破坏较少,内淋巴积水程度较为一致,缺点是成功率稍低。
2 增加内淋巴液的产生诱导内淋巴积水
传统理论认为内淋巴液的产生受血管纹边缘细胞和椭圆囊及半规管壶腹部的暗细胞膜上的Na/K泵控制。此类模型制作方法同样是基于打破内淋巴液产生和吸收之间的动态平衡,通过各种激活剂激活Na/K泵,从而诱导内淋巴积水。
2.1 血管加压素(或醛固酮)致内淋巴积水 Takeda[7]曾报道内淋巴积水导致的内耳功能紊乱患者的血浆中血管加压素(VP)浓度增加,并与临床症状相关。1998年Kumaga-
1 武汉大学人民医院耳鼻咽喉-头颈外科(武汉 430060);
2 海军总医院全军耳鼻咽喉-头颈外科中心
通过血管加压素(或醛固酮)诱导豚鼠内淋巴积水,过程简单,时间短,成功率高,遗憾的是此法诱导的内淋巴积水转归尚未见相关文献报道。
2.2 霍乱毒素致内淋巴积水 Lohuis等[10]通过外淋巴灌注霍乱毒素,使中阶上皮细胞中的腺苷酸环化酶活化,从而产生大量c AMP,后者能诱导内淋巴液大量分泌致内淋巴积水。方法:暴露耳蜗后在耳蜗上钻两小孔,一个通向鼓阶,另外一个通向底回的前庭阶,先通过鼓阶的孔向外淋巴液中灌注人工外淋巴液15分钟,然后灌注含有牛血清蛋白和霍乱毒素的人工外淋巴液。灌注后4小时通过耳蜗组织切片观察积水程度,结果实验组前庭膜长度增加比(lR/d)较对照组有增加但尚无统计学差异。Feldman等[11]通过纯化的霍乱毒素注射至耳蜗中阶75分钟后观察到所有豚鼠内淋巴液体积明显增加。此方法制作内淋巴积水所需时间短,成功率较高,但作者未对积水的持续时间及转归进行探讨。
3 两期法诱导内淋巴积水
Dunnebier[12]自创了两期法(two-phase)制作豚鼠膜迷路积水模型,即同时增加内淋巴液的产生和减少回流制作。方法:豚鼠麻醉后经颅后窝硬膜外径路暴露内淋巴囊,分离乙状窦与内淋巴囊远端间的联系,使用小块乳胶片将二者隔开,并用明胶海棉固定,缝合切口。术后第3周起醛固酮腹腔内注射,连续5天,3周后通过耳蜗切片观察到33%豚鼠出现中度积水,50%出现重度积水,总成功率为83%。
两期法制作出的内淋巴积水模型是一种动态模型,既有内淋巴囊远端破坏后内淋巴液吸收减少的过程,也有醛固酮诱发内淋巴液分泌量轻度增加的过程,可解释许多梅尼埃病的症状,如梅尼埃病患者听力的波动性变化。手术导致内淋巴功能障碍主要影响耳蜗顶回致低频听力下降,醛固酮主要影响底回致高频听力下降。该新模型是研究梅尼埃病发病机理及治疗方法较为理想的模型[12]。
4 免疫法诱导内淋巴积水
严格说来,免疫法诱导的内淋巴积水也是基于破坏内淋巴产生和吸收的动态平衡过程,但因许多学者提出内耳免疫的异常是梅尼埃病的病因之一,故将其单列。
4.1 钥孔嘁血蓝素免疫诱导致内淋巴积水 钥孔嘁血蓝素(KLH)是一种稳定的T细胞依赖性抗原,具有极强的免疫原性。Tomiyama[13]通过使用KLH中耳免疫诱导豚鼠内淋巴积水,探讨了内淋巴囊的免疫中心作用。方法:豚鼠先通过全身KLH致敏,2周后再行全身加强免疫,之后通过微量移液器将KLH注入内淋巴囊行局部免疫。通过组织切片观察球囊、椭圆囊和耳蜗的内淋巴积水程度,耳蜗内淋巴积水发生率在内淋巴囊免疫后第二天即达到100%,并持续至第七天,随后积水的发生率又逐渐下降,在2个月后内淋巴积水发生率又逐渐升高。
通过KLH致豚鼠内淋巴积水的过程相对简单且成功率非常高,内淋巴积水随时间变化既可逆的部分,也有不可逆的部分,能够模拟梅尼埃病的反复波动性发作,且有前庭紊乱的症状,如自发性眼震和冷热试验反应减弱。缺点是外淋巴液中产生了大量的炎性细胞,而梅尼埃病患者外淋巴液中没有。
4.2 辣根过氧化物诱导内淋巴积水 1987年Sawada[14]通过使用辣根过氧化物酶(HRP)成功诱导出了内淋巴积水模型。方法:首先通过HRP与完全弗氏佐剂混合皮内注射免疫豚鼠,1周后通过微量加液器在内淋巴囊周围注射少量的HRP,4~7天后采用同样的方法行第二次局部加强免疫。通过耳蜗组织切片观察积水程度,结果不同时间段处死的豚鼠中95%观察到了内淋巴积水。此方法制作内淋巴积水,步骤简单,成功率较高;缺点是第一次全身免疫后,未行局部免疫耳亦有可能出现内淋巴积水,故实验耳与对照耳不能选用同只豚鼠。
4.3 其他免疫诱导法 谭长强[15]报道豚鼠同种内耳免疫抗原诱导豚鼠内淋巴积水成功率是100%,但翟所强[16]采用类似方法未观察到耳蜗内淋巴积水,故此法稳定性差。王红生[17]报道酵母多糖活化血清中的补体后诱导出了豚鼠内淋巴积水模型,但其成功率仅10%。Matsuoka(2003)通过直接向鼓阶注射Ⅱ型胶原CB11肽段单克隆抗体制作出了内淋巴积水模型,其成功率是100%。
5 其他
Van Benthem[18]报道豚鼠腹腔内注射尼莫地平,内淋巴积水成功率约为40%。Valk[19]通过直接向中阶注射人工内淋巴液的方法制作内淋巴积水模型。Flock[20]、Salt[21]报道利用噪声或增加外淋巴静态压诱导出耳蜗内淋巴积水。Fukuda等[22]通过豚鼠巨细胞病毒(GPCMV)注射至内淋巴囊诱导出豚鼠内淋巴积水,其成功率高达100%。
将目前制作内淋巴积水豚鼠模型方法归纳为表1,可见,虽然内淋巴积水的动物模型制作方法多种多样,但尚存在着如下问题:首先,无一种动物模型能够真正吻合梅尼埃病的症状、体征、病理生理改变等指标,如梅尼埃病患者颞骨解剖中并未发现阻塞内淋巴管和囊的病理改变;无一种模型出现梅尼埃病患者的波动性听力下降,前庭症状并未在所有模型动物中出现等,故实验者应该根据不同的实验目的、结合造模所需时间及成功率等因素来选择不同的造模方法;其次,上述方法确认模型制作成功均是处死豚鼠后通过组织切片来判定,至今尚无一种确定活体内淋巴积水的特异方法,这样不利于造模成功后下一步实验的进行;最后,上述方法对内淋巴积水程度的划分标准不一,有的采用Sperling标准[23](前庭膜与骨壁有无接触及前庭膜与螺旋板之间的角度),有的自立标准,这些问题都值得进一步深入研究。
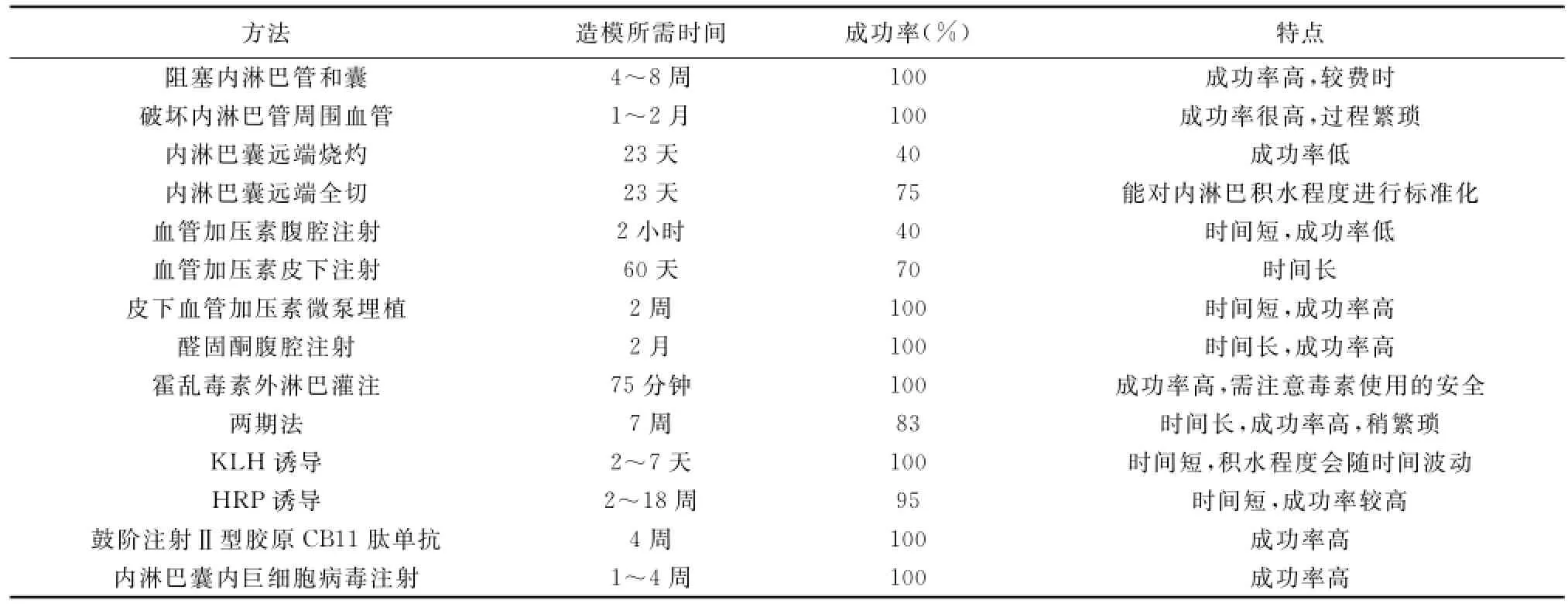
表1 内淋巴积水豚鼠模型制作方法
1 Kimura RS,Schuknecht HF.Membranous hydrops in the inner ear of the guinea pig after obliteration of the endolymphatic sac[J].Pract Otorhinolaryngol,1965,27:343.
2 Konishi S,Shea JJ.Experimental endolymphatic hydrops and its relief by interrupting the lateral semicircular duct in guinea pigs[J].J Laryngol Otol,1975,89:577.
3 王宜南,刘兆华.用计算机图像分析技术研究膜迷路积水[J].中华耳鼻咽喉科杂志,1996,31:139.
4 Schuknecht HF,Ruther A.Blockage of longitudinal flow in of the endolymphatic hydrops[J].Euro Arch Otorhinolaryngol,1991,248:209.
5 Dunnebier EA,Segenhout JM,Wit HP,et al.Endolymphatic hydrops after total dissection or cauterization of the distal portion of the endolymphatic sac[J].ORL,1996,58:217.
6 Lee KS,Kimura RS.Ischemia of the endolymphatic sac[J].Acta Otolaryngol,1992,112(Stockh):658.
7 Taizo T.Endolymphatic hydrops induced by chronic administration of vasopressin[J].Hearing research,2000,140:1.
8 Kumagami H,Loewenheim H,Beitz E,et al.The effect of anti-diuretic hormone on the endolymphatic sac of the inner ear[J].Pflugers Arch-Eur J Physiol,1998,436:970.
9 蒋子栋,张连山.醛固酮诱发豚鼠双耳膜迷路积水[J].中国医学科学院学报,2002,24:501.
10 Lohuid Peter JFM,Klis Sjaak FL,Klop Martin C,et al.Signs of endolymphatic hydrops after perilymphatic perfusion of the guinea pig cochlea with cholera toxin:A pharmacological model of acute endolymphatic hydrops[J].Hear Res,1999,137:103.
11 Feldman AM,Brusilow SW.Effects of cholera toxin on cochlear endolymph production:Model for endolymphatic hydrops[J].Proc Natl Acad Sci USA,1976,73:1 761.
12 Dunnebier EA,Segenhout JM,Wit HP,et al.Two-phase endolymphatic hydrops:A new dynamic guinea pig model[J].Acta Otolaryngol(Stockh),1997,117:13.
13 Tomiyama S.Development of endolymphatic hydrops following immune response in the endolymphatic sac of the guinea pig[J].Acta otolaryngol,1992,112:470.
14 Sawada I,KiTahara M,Kitajima K,et al.Induction of experimental endolymphatic hydrops by immunologic techniques[J].Am J Otol,1987,8:330.
15 谭长强,钟启明,曹银成.内淋巴囊同种抗原免疫致自身免疫性Meniere病的实验研究[J].耳鼻咽喉—头颈外科,1997,4:47.
16 翟所强,邹静,姜泗长,等.同种内耳抗原免疫豚鼠致感音神经性聋的实验研究[J].军事进修学院学报,1994,15:251.
17 王红生,赵沛英,李志光,等.补体活化与膜迷路积水[J].中华耳鼻咽喉科杂志,1994,29:371.
18 Van Benthem PPG,Klis SFL,Alberts FWJ,et al.Nimodipine and experimental endolymphatic hydrops.In:Filipo R,Barbara M(eds).Meniere's disease:Perspective in the 90's[M].Amsterdam,New York:Kugler Publ,1994.183~189.
19 Valk WL,Wit HP,Albers FWJ.Changes in distortion of two-tone cochlear microphonic and otoacoustic emission signals during an acute endolymphatic hydrops in the guinea pig[J].Eur Arch Otorhinolaryngol,2006,263:430.
20 Flock A,Flock B.Hydrops in the cochlea can be induced by sound as well as by static pressure[J].Hear Res,2000,150:175.
21 Salt AN.Acute endolymphatic hydrops generated by exposure of the ear to nontraumatic low-frequency tones[J].JARO,2004,5:203.
22 Fukuda S,Keithley EM,Harris JP.The development of endolymphatic hydrops following CMV inoculation of the endolymphatic sac[J].Laryngoscope,1988,98:439.
23 Sperling NM,Paparella MM,Yoon Th,et al.Symptomatic versus asymptomatic endoulymphatic hydrops:A histopathologic comparison[J].Laryngoscope,1993,103:277.
(2010-05-20收稿)
(本文编辑 李翠娥)
10.3969/j.issn.1006-7299.2011.01.025
R764.34
A
1006-7299(2011)01-0078-03
刘阳(Email:liuyangdoc@sina.com)mi[8]报道采用血管加压素豚鼠腹腔注射后2小时即能诱导出急性内淋巴积水成功率为40%,积水程度为轻中度;皮下隔日注射共60天能制作出慢性内淋巴积水模型,成功率为70%。Taizo[7]采用血管加压素皮下微泵埋植1周也诱导出了豚鼠内淋巴积水模型,成功率为100%。蒋子栋[9]通过连续5天腹腔注射醛固酮诱导出豚鼠内淋巴积水,成功率为100%,并报道1个月后诱导出的内淋巴积水为轻度,2个月后则为中重度。

