脑源性神经营养因子基因转染骨髓间充质干细胞在受损耳蜗内的生存和分化△
刘谦虚 贺湘波 陈观贵,3 谢鼎华 谭志强
脑源性神经营养因子基因转染骨髓间充质干细胞在受损耳蜗内的生存和分化△
刘谦虚1,2贺湘波1陈观贵1,3谢鼎华1谭志强1
目的 探讨脑源性神经营养因子(brain-derived neurotrophic factor gene,BDNF)基因转染的骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSC)在受损耳蜗内的生存和分化情况。方法 将转染了BDNF基因并在体外诱导分化的BMSC(BDNF-BMSC)标记后,通过鼓阶注射植入阿米卡星致聋的豚鼠耳蜗内(BDNF-BMSC组,18只),并设注射未诱导分化的BMSC的豚鼠为对照组(BMSC组,18只)。在注射后1、2、4 w取耳蜗组织石蜡切片,HE染色和荧光染色观察注射细胞的分布;神经元特异性烯醇化酶(neuron-specificenolase,NSE)、胶质纤维酸性蛋白(glial fibrillary acid protien,GFAP)抗体免疫组化染色观察注射细胞在耳蜗内的分化。结果 BDNF-BMSC和BMSC在耳蜗内均能成活并分布到一定的区域,鼓阶和前庭阶较多,中阶和蜗轴较少。NSE和GFAP免疫化学可见BDNF-BMSC部分细胞阳性染色,而BMSC阳性细胞较少。BDNF-BMSC在1、2 w时平均光密度(AOD)值较高,在4 w时显著下降(P<0.05);在各时间点,BDNF-BMSC组AOD值均显著高于BMSC组(P<0.01)。结论 诱导分化前后的BMSC耳蜗移植后均能成活并分布到一定的区域,在耳蜗内BDNF-BMSC分化能力明显强于BMSC,但随时间延长分化能力下降。
脑源性神经营养因子基因; 骨髓间充质干细胞; 耳蜗
Okano等[1]首次报道应用NIH3T3细胞作为载体的内耳基因治疗以来,目前国内外还没有基因修饰骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSC)移植损伤内耳的报道。本实验将在体外转染了脑源性神经营养因子(brainderived neurotrophic factor,BDNF)基因后诱导分化成神经样细胞的BMSC(BDNF-BMSC)[2]移植入阿米卡星致聋的豚鼠耳蜗内,并与移植未分化的BMSC对比,研究其在耳蜗内的成活、分布和分化情况,为进一步探讨它对内耳的保护功能奠定基础。
1 材料与方法
1.1 实验动物和分组 体重250~350 g的纯白红目短毛豚鼠(中南大学湘雅二医院动物实验室提供),雌雄不限,对声反应灵敏。阿米卡星450 mg· kg-1·d-1皮下注射14天后行ABR测试。选择ABR反应阈大于75 d B SPL的36只豚鼠随机分为2组,每组18只:一组鼓阶内泵入BMSC(BMSC组),另一组泵入BDNF-BMSC(BDNF-BMSC组)。各组豚鼠在耳蜗注射后1、2、4 w处死,每个时间点6只。耳蜗注射前、后3 d肌肉注射氯霉素30 mg·kg-1·d-1,以防感染。
1.2 主要试剂和仪器 BDNF-BMSC(中南大学湘雅二医院中心实验室培养),兔抗鼠神经元特异性烯醇化酶(neuron-specificenolase,NSE)、胶质纤维酸性蛋白(glial fibrillary acid protien,GFAP)多克隆抗体、SABC试剂盒、DAB试剂盒(均为武汉博士德公司产品),手术显微镜、荧光显微镜(德国Zeiss公司),微量注射器(日本Narishige公司),Image Pro Plus6.0图像分析系统(美国MediaCybernetics公司)。
1.3 BDNF-BMSC和BMSC的标记 选取生长良好的BDNF-BMSC和BMSC,吸干培养基,加入4,6-联脒-2-苯基吲哚溶液,避光孵育60 min,Hank’s液冲洗,消化,离心,DMEM培养基悬浮,调整至2 ×104个/μl,37℃培养箱中备用(不超过1小时)。
1.4 内耳细胞移植 豚鼠麻醉后取耳后切口,分离肌肉,暴露听泡。微细金刚钻在听泡骨壁削磨直径约2 mm小孔,距圆窗龛约1 mm耳蜗底回鼓阶外侧壁下方,磨直径约1 mm小孔。安置好微量注射器,鼓阶内分组泵入下列液体各10μl:BMSC组泵入未分化的BMSC;BDNF-BMSC组泵入在体外诱导分化为神经样细胞的BDNF-BMSC。严格控制导入速度,保持在5 min以上缓慢注入。注射完毕后取肌浆封堵造孔,玻璃离子粘固粉封闭听泡骨质开口,缝合切口。
1.5 内耳标本处理 耳内细胞移植后1、2、4 w,选择无明显眩晕、行动灵活的豚鼠,麻醉后暴露胸腔,游离心脏,4%多聚甲醛心内灌注。快速断头,取出并开放听泡,固定液中过夜。次日将标本脱钙,连续10 d。梯度酒精、二甲苯脱水,平行蜗轴方向石腊包埋,Rosenthal小管完整处平行中轴切片,厚约5 μm,每隔4张取1张,尽可能取靠近蜗轴中央的切片。烤箱中放置2~3小时。
1.6 病理组织学观察 耳蜗标本行苏木素-伊红(HE)染色,观察耳蜗组织结构,重点观察移植细胞数量、分布等。
1.7 耳蜗组织荧光检测 耳蜗组织玻片上滴加DAKO荧光防淬液,盖上盖玻片。荧光显微镜下420μm左右的蓝色波长进行激发,蓝色圆点为BDNF-BMSC或BMSC胞核。
1.8 免疫组织化学和AOD分析 用SABC法:脱蜡、水化;3%H2O2封闭,灭活内源性酶;抗原微波热修复;山羊血清封闭液封闭;滴加一抗(NSE、GFAP抗体),4℃过夜;次日复温,加二抗;滴加试剂SABC;DAB显色;苏木素复染;脱水、透明、封片。显微镜观察染色情况,重点观察移植细胞。高倍镜(200倍)下Image Pro Plus6.0系统计算移植细胞的平均光密度(average optical density,AOD)。
1.9 统计学方法 应用SPSS 13.0软件包进行统计学分析,采用非配对资料t检验。
2 结果
2.1 标本选择 耳蜗移植后至处死前,两组2 w、BDNT-BMSC组4 w各有一只豚鼠有眩晕症状,疑有迷路炎,不作为下一步实验动物。切片观察时蜗内结构欠清晰、有较多炎性细胞和渗出物的标本(疑有迷路炎)不作为统计对象。每组各时间点选取切片清晰的4只豚鼠作为观察对象。
2.2 耳蜗切片病理组织学观察 移植后可见移植成活细胞相互交织呈网片状,有的聚集成团,有的分散成个,大部分细胞有贴壁或贴膜生长,周围有血细胞(图1)。所有图片均取自蜗内注射2 w后标本。
2.3 耳蜗标本荧光观察 两组标本均可见蓝色荧光信号,多呈椭圆形、圆形或近圆形,少数不规则,鼓阶为多(图2a,),前庭阶其次,中阶少(图2b),蜗轴中仅有很少的荧光散在分布(图2a),螺旋韧带未见荧光。细胞多贴近骨壁或膜性结构,呈片状、簇状聚集,也有散在分布的,周围可见无荧光的血细胞。1和2 w时荧光信号较多,4 w时荧光下降。
2.4 蜗内移植细胞免疫化学结果 NSE染色后着色细胞胞浆呈棕黄色,形态不一,为多边形、纺锤形或卵圆形等。BMSC组仅有少部分移植细胞染色阳性(图3、4),BDNF-BMSC组GFAP染色阳性细胞数较BMSC组多(图5、6)。
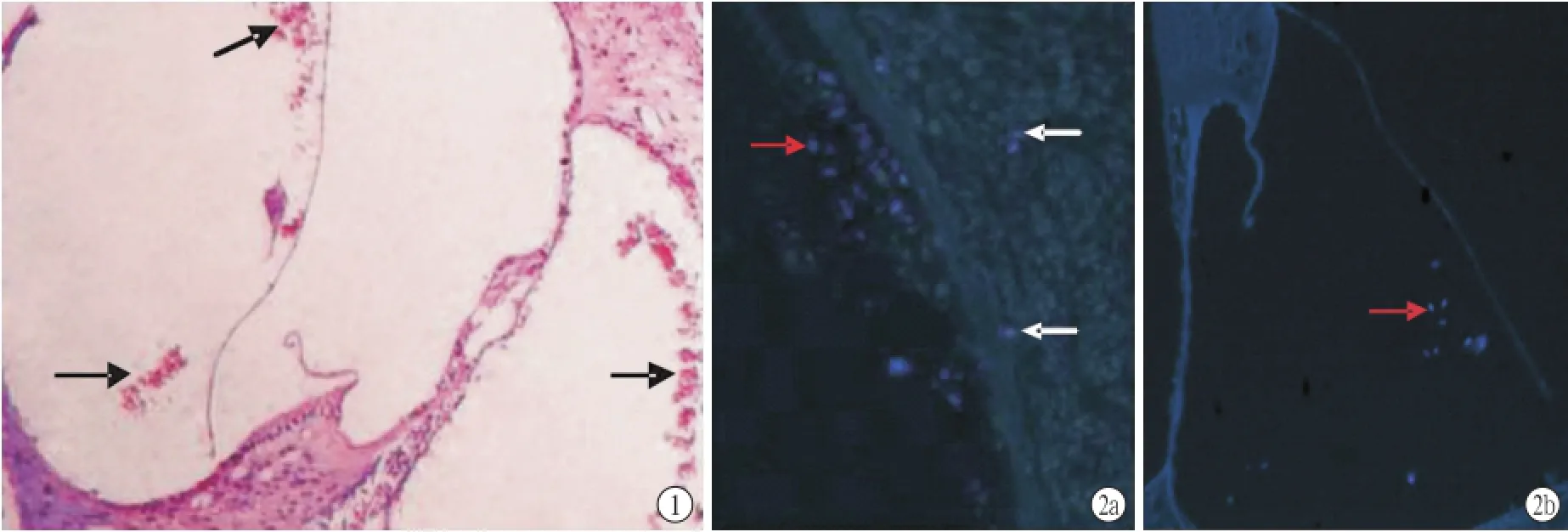
图1 BMSC组耳蜗内注射2 w后耳蜗内移植细胞 移植细胞呈网片状,聚集成团或分散成个,有贴壁或贴膜生长趋势(箭头所示),周围有血细胞(HE×100)图2 BMSC组蜗内注射2 w后耳蜗细胞移植荧光观察 蓝色荧光信号鼓阶内较多(2a,红箭头所示),中阶少(2b,红箭头所示),蜗轴内很少(2a,白箭头所示)(DAPI×200)
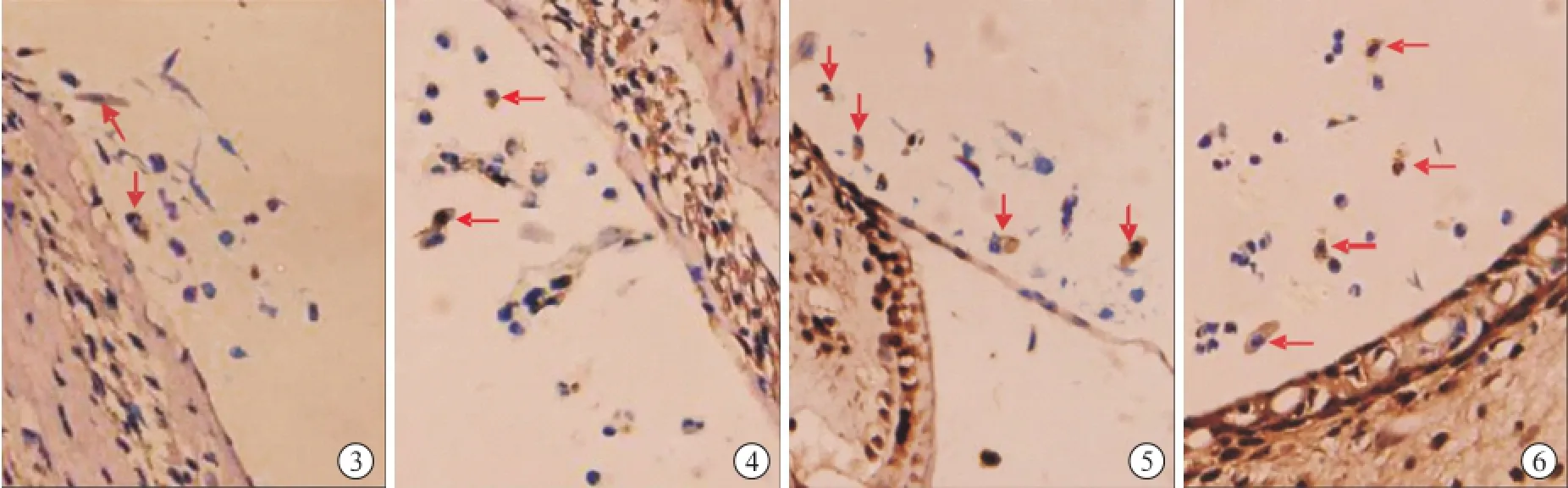
图3 BMSC组NSE染色 少部分细胞染色阳性(箭头所示)(SABC法×200)图4 BMSC组GFAP染色 少部分细胞染色阳性(箭头所示)(SABC法×200)图5 BDNF-BMSC组NSE染色 阳性细胞数较BMSC组多(箭头所示)(SABC法×200)图6 BDNF-BMSC组GFAP染色 阳性细胞数较BMSC组多(箭头所示)(SABC法×200)
免疫组织化学结果经Image Pro Plus6.0分析系统分析,AOD值比较如表1。可见,两种抗体染色的各时间点,BDNF-BMSC组AOD均高于BMSC组,差异有显著统计学意义(P<0.01);两组4 w时AOD值均低于同组1、2 w时(P<0.05),组内1 w与2 w时比较AOD值差异无统计学意义(P>0.05)。
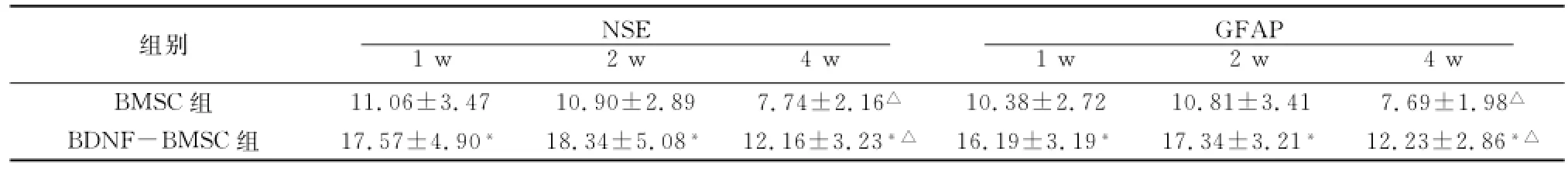
表1 两组耳蜗细胞移植后不同时间NSE、GFAP染色平均光密度(%,¯x±s)
3 讨论
氨基糖苷类抗生素(aminoglycoside antibiotics,Am An)导致感音神经性聋的机理主要是内耳毛细胞损伤后分泌的神经营养因子(neurotrophic factors,NTF)减少,继发螺旋神经节神经元(spiral ganglion neurons,SGN)凋亡。外源性NTF可延缓Am An引发的SGN退化[3],但它们作为蛋白质类物质不易通过血内耳屏障,且半衰期短,在蜗内的作用时间短。为更有效地把NTF导入内耳并长期稳定表达,人们探讨利用载体将NTF基因植入耳蜗。BMSC具有干细胞特性[4],可广泛迁移,能分泌BDNF等细胞因子,可作为理想的基因载体。将转染了BDNF基因的BMSC植入内耳,BDNF可营养细胞而促进组织恢复,还能诱导BMSC分化;BMSC能分化为神经样细胞,又能分泌BDNF等NTF,两者为内耳提供了更好的保护作用。有一些学者用BDNF和BMSC联合治疗脑[5]、脊髓[6]等组织损伤,取得了比单独应用BDNF或BMSC更好的效果。但目前国内外还没有BDNF基因修饰BMSC移植损伤内耳的报道。
Ito等[7]最初使用干细胞进行内耳移植,证明神经干细胞能在新生大鼠耳蜗内存活超过4 w,Hildebrand等[8]发现胚胎干细胞在庆大霉素致聋的豚鼠耳蜗内能存活至少3 w,Wang等[9]则观察到BMSC可在活体内成活3 m。本实验观察到BDNF-BMSC和BMSC在蜗内至少能存活4 w,细胞数在移植后1 w和2 w时较多,4 w时下降。分析其原因可能为:受Am An损伤的耳蜗自身分泌NTF增多,并可增强移植细胞分泌NTF的能力,从而有利于细胞的生存,使移植细胞能不在短期内死亡,因此1 w和2 w时观察到的细胞数相当。随着时间的推移,耳蜗和移植细胞分泌能力下降,蜗内NTF减少,移植细胞逐渐死亡,因此4 w时观察到的细胞数较1、2 w时减少。
Sharif等[10]通过鼓阶注射BMSC,发现移植细胞主要分布在鼓阶,还能迁移到螺旋韧带、Corti器、听神经等部位。Hu等[11]用神经干细胞通过鼓阶移植到耳聋豚鼠耳蜗内,观察到移植细胞沿着听神经分布并接近感觉上皮区。Matsuoka等[12]将BMSC通过鼓阶和蜗轴注入正常或毒毛旋花子甙-g损伤的豚鼠耳蜗内,结果蜗轴注射组的轴内BMSC密度高于三个阶,鼓阶注射组的蜗轴中则未见BMSC。本实验通过鼓阶注射后在三个阶中均见细胞存活,鼓阶、前庭阶较多,中阶少,蜗轴中仅见少量移植细胞。分析外淋巴腔和蜗轴的解剖屏障可能对BMSC的迁延起一定的阻隔作用。不过为了移植细胞能更多的到达SGN附近,蜗轴注射可能是较理想的方式。
Naito等[13]证实BMSC能在内耳转化为神经元样细胞和神经胶质细胞,但比率很低,表达神经微丝蛋白和GFAP分别为0.4%和1.2%。为了提高移植细胞向神经样细胞分化的效率,可在体外先将其诱导分化为神经前体细胞[14]。NSE、GFAP分别是神经元、星形胶质细胞的特异性标志物,本实验通过NSE、GFAP染色显示,在蜗内,BDNF-BMSC向神经样细胞分化的能力明显强于BMSC,这与体外研究的结果相似[2]。
本实验对BMSC和BDNF-BMSC内耳移植后的生存和分化进行了初步研究,为进一步探讨移植细胞对损伤内耳的保护提供了基础。需要进一步解决的问题主要有:①怎样使移植细胞更有效地到达并整合到靶位置;②如何延长移植细胞的存活时间。随着这些问题的解决,细胞移植、基因治疗有望成为人们治疗感音神经性聋的新途径。
1 Okano T,Nakagawa T,Kita T,et al.Cell-gene delivery of brain-derived neurotrophic factor to the mouse inner ear[J].Mol Ther,2006,14:866.
2 刘谦虚,谢鼎华,陈观贵.脑源性神经营养因子基因转染骨髓间充质干细胞体外诱导分化为神经样细胞初步观察[J].听力学及言语疾病杂志,2009,17:252.
3 Shepherd RK,Coco A,Epp SB.Neurotrophins and electrical stimulation for protection and repair of spiral ganglion neurons following sensorineural hearing loss[J].Hear Res,2008,242:100.
4 Kronenwett R,Haas R.Differentiation potential of stem cells from bone marrow[J].Med Klin(Munich),2006,101(Suppl 1):182.
5 Mahmood A,Lu D,Wang L,et al.Intracerebral transplantation of marrow stromal cells cultured with neurotrophic factors promotes functional recovery in adult rats subjected to yraumatic brain injury[J].Journal of Neurotrauma,2002,19:1 609.
6 康德智,王灯亮,林建华,等.骨髓间质干细胞和脑源性神经营养因子联合应用促进兔脊髓外伤性截瘫的修复[J].中国临床解剖学杂志,2007,25:60.
7 Ito J,Kojima K,Kawaguchi S.Survival of neural stem cells in the cochlea[J].Acta Otolaryngol,2001,121:140.
8 Hildebrand MS,Dahl HH,Hardman J,et al.Survival of partially differentiated mouse embryonic stem cells in the scala media of the guinea pig cochlea[J].Assoc Res Otolaryngol,2005,6:341.
9 Wang JS,Shum TD,Galipeau J,et al.Marrow mesenchymal stem cells for cellular cardiomyoplasty:feasibility and potential clinical advantages[J].Thorac Cardiovasc Surg,2000,120:999.
10 Sharif S,Nakagawa T,Ohno T,et al.The potential use of bone marrow stromal cells for cochlear cell therapy[J].Neuroreport,2007,18:351.
11 Hu Z,Wei D,Johansson CB,et al.Survival and neural differentiation of adult neural stem cells transplanted into the mature inner ear[J].Exp Cell Res,2005,302:40.
12 Matsuoka AJ,Kondo T,Miyamoto RT,et al.Enhanced survival of bone marrow-derived pluripotent stem cells in an animal model of auditory neuropathy[J].Laryngoscope,2007,117:1 629.
13 Naito Y,Nakamura T,Nakagawa T,et al.Transplantation of bone marrow stromal cells into the cochlea of chinchillas[J].Neuroreport,2004,15:1.
14 Hildebrand MS,Dahl HH,Hardman J,et al.Survival of partially differentiated mouse embryonic stem cells in the scala media of the guinea pig cochlea[J].Assoc Res Otolaryngol,2005,6:341.
(2010-03-15收稿)
(本文编辑 李翠娥)
A PreIiminary Study of Brain-Derived Neurotrophic Factor Gene Transfected Bone-Marrow MesenchymaI Stem CeIIs TranspIartafion Damaged CochIea
Liu Qianxu*,He Xiangbo,Cheng Guangui,Xie Dinghua,Tan Zhiqiang
(*Hearing Research Institute,Department of OtoIaryngoIogy and Head&Neck Surgery of the Second Xiangya HospitaI,CentraI South University,Changsha,410011,China)
Objective To investigate the survivorship and differentiation of bone-marrow mesenchymal stem cells(BMSC)cochlea transfected by human brain-derived neurotrophic factor(BDNF)gene in damaged.Methods BMSC were inducted and marked after transfected by h BDNF gene in vitro.These BMSC(BDNF-BMSC)were transplanted into tympanic scala of the guinea pigs which were deafened by amikacin(AK).While in the control group uninducted BMSC were injected into the cochlea.The cochlea were obtained on 1,2 and 4 after injection and paraffin-embedded sections were new weeks.The distribution of BDNF-BMSC and BMSC was observed by HE and fluor staining,the differentiation of these cells was detected with immunohistochemistry of neuron-specificenolase(NSE)and glial fibrillary acid protien(GFAP)antibody.ResuIts BDNF-BMSC and BMSC survived and scattered over some areas in the cochlea.There were some transplanted cells in scala tympani and scala vestibuli,only few in scala media and modiolus.Some BDNF-BMSC were positive for NSE and GFAP,while only a few BMSC were positive for NSE and GFDP.Immunochemistry staming analyzed with average optical density(AOD)showed:the AOD of the BDNF-BMSC group was high at 1 w and 2 w but significantly reduced on 4 w(P<0.05),and was significantly higher than those in the BMSC group at any time points(P<0.01).ConcIusion Differentiated or un-differectiated BMSC survived and scattered over some areas when they were transplanted into cochlea.The differectiation ability of BDNF-BMSC was more obvions that of BMSC in cochlea,but reduced with time.
Brain-derived neurotrophic factor gene; Bone-marrow mesenchymal stem cells; Cochlea
10.3969/j.issn.1006-7299.2011.01.016
R764.35
A
1006-7299(2011)01-0052-04
△ “湖南省十一五期间贫困残疾儿童人工耳蜗植入援助计划”专项资助课题
1 中南大学耳科研究所、湘雅二医院耳鼻咽喉头颈外科(长沙 410011); 2 暨南大学医学院第三附属医院(珠海市人民医院)耳鼻咽喉头颈外科; 3 广州医学院第二附属医院耳鼻咽喉科
刘谦虚,男,江西人,博士,主治医师,主要从事听力与耳聋的基础和临床研究。
谢鼎华(Email:huaxie@2118.cn)

