磷酸肌酸的脑保护作用研究
金 越,韩国柱,李 颖,马郁芳,周 琴,孙慧君
(1. 大连医科大学 药学院 药理教研室,辽宁 大连,116044; 2. 大连医科大学 药学院 临床药理教研室,辽宁 大连 116044; 3.大连医科大学 生物化学与分子生物学教研室, 辽宁 大连 116044)
脑组织代谢旺盛,血流量丰富,因此极易受到缺血缺氧的影响,引起神经细胞功能的损害[1]。缺血性脑血管病(ischemic cerebrovascular disease,ICVD)是由于脑部血液循环障碍,导致以局部神经功能损伤、缺失为特征的一组疾病[2]。该病死亡率高,并发症和后遗症多,严重危害人类健康,目前仍然缺乏有效的防治措施与理想药物。
磷酸肌酸(phosphocreatine,PCr)是人体内自有的活性物质,作为体内能量储存和转运的重要载体,为ATP补充能量,维持机体进行正常的活动和代谢[3]。PCr于1927年由Eggleton 于哺乳动物肌肉中分离得到,目前外源性PCr在临床上主要作为心脏病的防治用药之一广泛用于心肌保护,但是其对脑损伤的保护作用以及机制研究鲜见报道。本文主要通过建立小鼠脑缺血与脑缺血再灌注模型以及建立大鼠嗜铬细胞瘤PC12细胞缺氧缺糖损伤模型来研究PCr对脑组织以及神经细胞的保护作用并进行相关机制的探讨。
1 材料和方法
1.1 药品和试剂
PCr注射用无菌粉针剂,内含磷酸肌酸钠1g/支,哈尔滨博莱制药有限公司惠赠(批号070823,纯度>97%);肌酸由美国MERCK公司生产,纯度≥99%。
Hyclone胎牛血清、高糖DMEM培养基、二甲基四氮唑蓝(MTT)购自Gibco公司;Hyclone马血清购自Thremo公司;连二亚硫酸钠(Na2S2O4)购自天津市化学试剂公司;LDH检测试剂盒购自南京建成生物工程研究所;青霉素、链霉素购自大连制药厂;其他试剂均为国产分析纯。
1.2 实验对象与仪器
动物与细胞株:昆明种小鼠共120只,由大连医科大学动物实验中心提供;大鼠嗜铬细胞瘤PC12细胞购自中国科学院上海细胞生物学研究所。仪器:3366型CO2培养箱,Thermo-354酶标仪,XD-101倒置显微镜,80-1型低速离心机。
1.3 实验方法
1.3.1 脑缺血小鼠生存时间以及脑组织MDA含量的测定:小鼠60只,体重20~30 g,雌雄各半,随机分为假手术组、模型组及药物组。每组各20只。药物组于造模前5 min缓慢尾静脉推注PCr(10 mL/kg),假手术组与模型组以同样方法注射同等体积的生理盐水。
小鼠腹腔注射25%乌拉坦(1 g/kg)。麻醉后,颈部正中切口,分离两侧颈总动脉。药物组及模型组双重置线结扎两侧血管,假手术组只在血管下置线并不结扎。缝合皮肤切口,将小鼠置于37 ℃恒温环境加以护理。观察动物4 h内反应及死亡情况。
待小鼠濒死时(小鼠呼吸<5 次/min视为濒死)及手术后4 h记录存活时间并在冰浴中活体断头取脑(去除嗅球及小脑组织),在-70 ℃冰箱冻存待测。全部实验结束后,在冰浴中用预冷的生理盐水将脑组织配制成20%脑匀浆,4 ℃ 3000 r/min离心5 min,取上清液进行MDA含量测定(硫代巴比妥酸比色法)。
1.3.2 脑缺血再灌注小鼠脑组织MDA含量的测定:小鼠60只,体重20~30 g,雌雄各半,随机分为假手术组、模型组以及药物组。每组20只。小鼠腹腔注射25%乌拉坦(1 g/kg),麻醉后,颈部正中切口,分离两侧颈总动脉。药物组缓慢尾静脉推注PCr(10 mL/kg),假手术组与模型组以同样方法注射同等体积的生理盐水。
给药后8 min,药物组及模型组分别夹闭两侧颈总动脉,假手术组不夹闭动脉。30 min后取下微型动脉夹,再灌注30 min后立即冰浴中活体断头取脑(去除嗅球及小脑组织),在-70 ℃冰箱冻存待测。MDA测定方法同上。
1.3.3 PC12细胞缺氧缺糖损伤模型MTT和LDH含量测定:PC12细胞用高糖DMEM完全培养基(内含10%灭活胎牛血清、5%马血清、青霉素/链霉素100 U/mL)置于37 ℃,5%CO2饱和湿度培养箱中培养。根据细胞生长情况, 2~3 d换培养液1次,待细胞80%汇合或接近汇合成片后,用0.05%胰蛋白酶消化并用吸管轻轻吹打收集细胞,每周传代2次。
取对数生长期PC12细胞,消化离心后用完全培养基重悬,密度为2×105个/mL,接种于96 孔板上。在37 ℃, 5%CO2饱和湿度条件下培养24 h,使细胞完全贴壁后,弃去原培养液,用D-Hanks液轻轻荡洗2次。
实验分为正常组,缺氧缺糖模型组,药物组(PCr组以及肌酸组)。正常组细胞用含糖Earle’s液 (g/L) (NaCl 6.68,KCl 0.04,CaCl20.2,MgSO4·7H2O 0.2,NaHCO32.2,NaH2PO4·2H2O 0.4,HEPES 2.4,葡萄糖0.2,pH 7.4) 培养。模型组细胞用含4 mmol/L Na2S2O4的无糖Earle’s液(配置方法同上,但不加葡萄糖)进行培养(各损伤小组的Na2S2O4的浓度分别为0.5、1、2、4、8 mmol/L)。药物组细胞用含4 mmol/L Na2S2O4以及不同浓度药物的无糖Earle’s液进行培养,药物终浓度分别为20、15、10、8、5、1 mmol/L。将培养板置于5% CO2、37 ℃培养箱中培养3 h后回收上清液,并加无血清高糖DMEM液100 μL/孔,MTT(终浓度0.5 mg/mL) 10 μL/孔,置于37 ℃、5%CO2培养箱内继续培养4 h后,加入三联液(10%SDS,5%异丙醇,0.012 mol/L HCl)100 μL/孔,待紫色结晶完全溶解后,于全自动酶标仪570 nm波长处测定A值。药物抑制率=(A药物组-A模型组) /(A正常组-A模型组) ×100%。用LDH试剂盒测定上清液中LDH的释放量,测定方法依照LDH试剂盒说明书上操作,于440 nm处测定A值。LDH含量按公式计算:LDH (U/L)=(A测定-A测定空白) /(A标准-A标准空白) ×2000。
1.4 统计学方法
2 结 果
2.1 PCr对脑缺血小鼠生存时间以及脑组织MDA含量的影响
药物组小鼠与模型组小鼠相比存活时间明显延长,脑组织MDA含量下降,其小鼠脑组织MDA水平与模型组相比差异具有显著性意义,P<0.05。见表1。
2.2 PCr对脑缺血再灌注小鼠脑组织MDA含量的影响
如表1所示,在缺血再灌注模型中,药物组小鼠脑组织MDA含量下降,与模型组小鼠脑组织MDA的水平相比差异具有显著性意义,P<0.05。
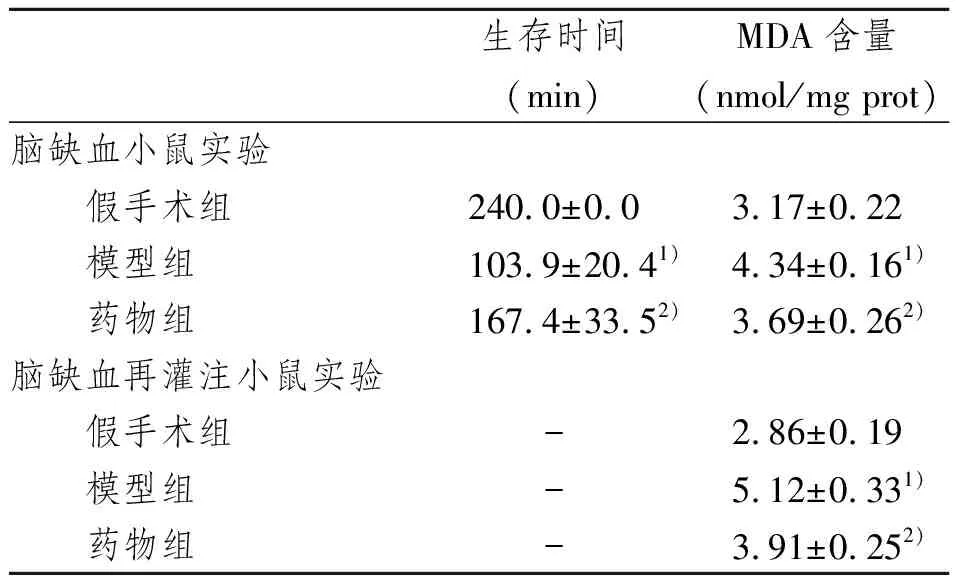
表1 PCr对脑缺血小鼠生存时间及对脑缺血/脑缺血再灌注小鼠脑组织MDA含量的影响
2.3 PCr对PC12细胞缺氧缺糖损伤模型的影响
2.3.1 Na2S2O4致PC12细胞缺氧缺糖损伤作用
Na2S2O4浓度为 1、2、4及8 mmol/L时的损伤程度与正常组相比,差异有显著性意义。见表2。细胞培养液中的Na2S2O4浓度达到4 mmol/L及以上时,MTT法测得的细胞存活率显著降低,同时细胞培养上清液中的LDH 释放量显著上升,故确定4 mmol/L Na2S2O4为实验所用的损伤浓度。
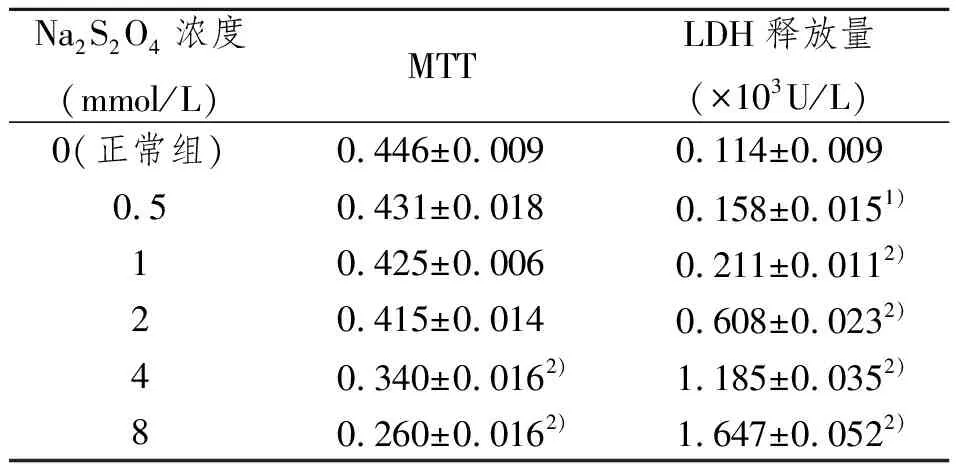
表2 不同浓度Na2S2O4对PC12细胞损伤作用的比较
2.3.2 PCr和肌酸对PC12细胞缺氧缺糖损伤的保护作用
由表3可见,与模型组比较,PCr和肌酸组随药物浓度的增加,Na2S2O4诱导的PC12细胞缺氧缺糖损伤有所减轻,细胞存活率明显提高,受损细胞LDH的释放受到抑制。从药物终浓度为5 mmol/L开始,药物组与模型组相比差异有显著性意义。药物终浓度至10 mmol/L时,对Na2S2O4诱导产生的缺氧缺糖损伤的保护作用达到高峰,继续增加药物浓度其保护作用没有显著增加。各浓度的PCr与相同浓度的阳性对照药肌酸相比,差异无显著性意义。

表3 PCr以及肌酸对缺氧缺糖细胞损伤模型的保护作用
3 讨 论
能量代谢障碍是脑缺氧缺血后最早产生的病理生理改变,随后产生大量自由基并引发一系列级联反应,促使神经细胞趋向死亡[4]。脑组织缺氧缺血时能够产生大量的氧自由基;此外,脑细胞神经元富含对氧自由基敏感的多不饱和脂肪酸而抗氧化的物质相对缺乏,因此极易受到自由基的侵袭伤害[5-6],以上正是ICVD 的发病基础。
兴奋性毒素—谷氨酸的过度释放是导致缺血缺氧性脑损伤的重要机制之一。由于谷氨酸是一种兴奋性神经递质,所以过量的情况下作用于NMDA受体和非NMDA受体,可引起细胞内钙超载并激活钙依赖的各种酶,损伤细胞结构;钙超载又会生成大量的ROS,促进细胞膜的脂质过氧化,最终造成神经元退变坏死或迟发性死亡[7]。
PCr是人体中一种高能储存物质,通过“肌酸穿梭”的机制来完成线粒体氧化磷酸化生成ATP,目前在国内外已被广泛用做心脏病的防治用药之一[8-11]。脑缺血后,能量衰竭主要表现在高能磷酸化合物ATP、PCr的耗竭上。在缺血缺氧初期,氧化磷酸化不能正常进行,ATP减少,糖无氧酵解的关键酶——磷酸果糖激酶会被激活,糖无氧酵解增加,能够补充生成ATP,但是通过这种方式产生的ATP要远远少于氧化磷酸化所生成的ATP,因此最终还是会造成能量代谢紊乱,给组织细胞带来损害。本研究证明在缺血缺氧时,内源性PCr不能满足机体对ATP的需求。
在机体内,PCr主要由肌酸经肌酸激酶催化而来。 Balestrino M等[12]发现,肌酸能够有效抑制去极化引起的大鼠脑组织的缺氧缺血损伤,由此可以推测,PCr可能对缺血缺氧的脑组织也具有保护作用。目前,已有一些医护工作者将PCr试用于临床的脑损伤患者,并取得了一些疗效[13-14]。为了切实检测PCr的脑保护作用,本研究复制了全脑缺血以及脑缺血再灌注小鼠实验模型并进行了脑组织MDA含量的测定。MDA是自由基脂质过氧化作用的终产物,其含量高低可以反映脂质过氧化的水平,间接反映机体细胞受氧自由基损害的程度[15]。实验结果表明,PCr能够显著延长全脑缺血小鼠的生存时间,并降低全脑缺血与脑缺血再灌注小鼠脑内的MDA含量,证明PCr能够通过提高脑内ATP水平,增进缺血缺氧脑内的能量代谢进而阻止自由基的产生,保护脑细胞。
本研究利用Na2S2O4构建了缺氧缺糖PC12细胞损伤模型。PC12细胞是大鼠肾上腺髓质嗜铬细胞瘤克隆的细胞株,细胞膜上有NMDA受体、胆碱能M、N受体等,具有神经内分泌细胞的一般特征,该细胞纯化程度高、生长繁殖快、培养周期短、使用方便、条件易控制并有可传代性,所以可以代替神经细胞广泛应用于神经生理和神经药理学研究[16-19]。
LDH是无氧代谢的标志性酶,广泛存在于各组织的细胞浆内,正常情况下不能通过细胞膜,而当细胞受损或者死亡时,就能够释放到细胞外,细胞的受损程度与细胞培养上清液中的LDH活性成正比[20]。故测定培养液中LDH活性是反映细胞损伤的一种敏感且较为简便快捷的指标。
本实验采用MTT法检测细胞的增殖和存活状态,LDH活性来反映细胞的损伤程度。结果表明:Na2S2O4引起的PC12细胞缺氧缺糖损伤后细胞活力降低,细胞培养液中LDH含量增加,证明细胞破损严重。本研究发现PCr和肌酸均可显著抑制PC12细胞缺氧缺糖的损伤情况,不同程度地提高受损PC12细胞的存活率并抑制LDH的释放,并在一定范围之内具有剂量依赖性。当药物的浓度达到10 mmol/L时,其抑制率达高峰,在此之后即使继续增大药物浓度,细胞的MTT值不再增加,培养液上清中的LDH含量也不再明显下降,说明此时药物的保护作用已发挥到最大。因此,本实验中药物的最佳浓度为10 mmol/L,与以往国外的文献报道一致[21-22]。本实验结果显示,肌酸的作用效果和PCr相近。由于肌酸是PCr的代谢产物,所以推测PCr的抗氧自由基作用可能与其可以代谢成肌酸有关。
参考文献:
[1] 盛瑞,刘国卿.9-(4-乙氧羰基苯氧基)-6,7-二甲氧基-1,2,3,4-四氢吖啶盐酸盐对PC12细胞缺氧缺血损伤的保护作用[J].中国临床药理学与治疗学,2001,6 (4): 330-333.
[2] 先雄斌,袁琼兰.缺血性脑血管病的研究进展[J].海南医学,2008,19 (1): 131-133.
[3] 王景辉,李梦青,刘桂敏,等.磷酸肌酸的应用研究[J].天津药学,2004, 16 (1): 60-62.
[4] 苏杭.新生儿缺氧缺血性脑病的治疗现状与进展[J].中国医药导报,2009,6(23): 167-168.
[5] Reiter RJ.Oxidative processes and antioxidative defense mechanisms in the aging brain[J].FASEB J, 1995, 9(7): 526-533.
[6] Takizawa S.Free radical production in ischemic cerebrovascular disease[J]. Nihon Ronen Igakkai Zasshi, 2003, 40(4): 319-321.
[7] Ichas F, Mazat JP.From calcium signaling to cell death: two conformations for the mitochondrial permeability transition pore. Switching from low to high conductance state[J].Biochim Biophys Acta, 1998, 1366(1-2): 33-50.
[8] 李军,李鸿珠,李萍,等.磷酸肌酸对儿童柯萨奇病毒性心肌炎的保护作用[J].实用儿科临床杂志,2010,25(6): 424-426.
[9] 林文辉,林雪华,谢彬.注射用磷酸肌酸钠对阿霉素心脏毒性的保护作用[J].肿瘤基础与临床,2010,23(1): 58-59.
[10] Du XH, Liang FY, Zhao XW.Effects of phosphocreatine on plasma brain natriuretic peptide level in elderly patients with chronic congestive heart failure[J].J South Med Univ, 2009, 29(1): 154-155, 159.
[11] Fragasso G, Perseghin G, De Cobelli F, et al.Effects of metabolic modulation by trimetazidine on left ventricular function and phosphocreatine/adenosine triphosphate ratio in patients with heart failure[J].Eur Heart J, 2006, 27(8): 942-948.
[12] Balestrino M, Lensman M, Parodi M, et al.Role of creatine and phosphocreatine in neuronal protection from anoxic and ischemic damage[J].Amino Acids, 2002, 23(1-3): 221-229.
[13] 赵爱萍,李丹,李素香.磷酸肌酸钠预防窒息新生儿心脑损伤疗效分析[J].中国实用医药,2010,5(22): 114-115.
[14] 张煜崇,张喜春.早期应用磷酸肌酸依达拉奉治疗急性缺血性卒中的脑保护作用[J].中西医结合心脑血管病杂志,2010,8(7): 882-883.
[15] 任俊伟,杨琴.白藜芦醇对大鼠脑缺血再灌注氧化应激损伤的影响[J].中国生物制品学杂志,2011,24 (3): 292-296.
[16] 孙蓉,衣银萍,吕丽莉,等.麝香酮对连二亚硫酸钠造成PC12细胞缺氧损伤的保护作用[J].中药药理与临床,2008, 24(1): 15-17.
[17] Seki S, Aoki M, Hosokawa T, et al.Bisphenol-A suppresses neurite extension due to inhibition of phosphorylation of mitogen-activated protein kinase in PC12 cells[J].Chem Biol Interact, 2011, 194(1): 23-30.
[18] Nakajima K, Niisato N, Marunaka Y.Quercetin stimulates NGF-induced neurite outgrowth in PC12 cells via activation of Na/K(+)/2Cl(-) cotransporter[J].Cell Physiol Biochem, 2011, 28(1): 147-156.
[19] Peruche B, Krieglstein J.Neuroblastoma cells for testing neuroprotective effects[J]. J Pharmacol Methods, 1991, 26(2): 139-148.
[20] 吕勇,金越,韩国柱,等.茶多酚和维生素C对人胚肾293细胞缺糖缺氧损伤保护作用的比较[J].中草药,2007,37(9): 1370-1372.
[21] Robinson LA, Braimbridge MV, Hearse DJ.Creatine phosphate: An additive myocardial protective and antiarrhythmic agent in cardioplegia[J].J Thorac Cardiovasc Surg, 1984, 87(2): 190-200.
[22] Mastroroberto P, Tpmmaso L, Chello M, et al. Creatine phosphate protection of the ischemic myocardium during cardiac surgery[J].Curr Ther Res, 1992, 51: 37-45.

