血清胆红素与2型糖尿病周围神经病变的关系
李亚 白小岗 徐杰 庞静 王晶 呼双琴 李伟
糖尿病周围神经病变(DPN)是糖尿病最常见的慢性并发症和主要致残因素之一。随糖尿病病程的延长,其发病率可高达60%~91%[1]。神经病变可累及感觉神经、运动神经及植物神经,产生疼痛、麻木、运动障碍及自主神经功能障碍甚至致残,但以感觉神经最为常见[2]。其中以感觉障碍为主的糖尿病多发性周围神经病是糖尿病神经系统损害中最常见的一种形式[3]。胆红素是血红素分解代谢产物,以往一直认为它仅是一种毒性废物,但近年来研究发现胆红素是一种天然的具有抗氧化活性的生物还原剂,在人体内具有抗氧化作用[4]。本研究旨在探讨血清胆红素与DPN的关系。
1 对象与方法
1.1 对象 选取2009年10月~2011年3月就诊于内分泌科门诊及住院2型糖尿病患者147例,根据有无合并周围神经病变分为DPN组和糖尿病组。糖尿病诊断符合1999年WHO糖尿病诊断标准,且血清谷氨酸脱羧酶抗体(GAD-Ab)、胰岛细胞抗体(ICA)和胰岛素自身抗体(IAA)均为阴性。糖尿病周围神经病变诊断符合2009年中国医师协会内分泌代谢科医师提出诊断DPN标准如下:①明确的糖尿病病史。②在诊断糖尿病时或之后出现的神经病变。③临床症状和体征与DPN的表现相符。④以下5项检查中如果有2项或2项以上异常则诊断为DPN:温度觉异常;龙丝检查,足部感觉减退或消失;振动觉异常;踝反射消失;神经传导速度有2项或2项以上减慢。 选择同期进行健康体检者78例为正常对照组,排除糖尿病、空腹血糖受损和糖耐量异常及血管疾病、肿瘤及其他躯体疾病。
1.2 方法 按照入选标准将入选病人分成三组。DM组75例,DPN组72例,正常对照组78例。由专人测定身高、体重、腰围、臀围、并计算出体重指数、腰臀比。禁食12小时后,于次晨行75g口服葡萄糖耐量试验(OGTT),测定空腹血糖(FPG)、餐后2小时血糖(2hPG)、空腹胰岛素(FINS)、血清胆固醇(TC)、TG、HDL-C、低密度脂蛋白胆固醇(LDL-C)、HbAlc、总胆红素、间接胆红素及直接胆红素。血糖用葡萄糖氧化酶法测定,FINS用放免法测定,胆红素、TC、TG用酶化学法测定,HbAlc用高压液相色谱法测定。采用HOMA模型公式计算胰岛素抵抗(IR)指数及胰岛β细胞功能,即:HOMA-IR=(FINS×FPG)/22.5,HOMA-β=20×FINS/(FBG-3.5)。
1.3 统计学处理 采用SPSS13.0统计软件包进行统计分析,数据以±s表示,所有资料进行正态性、方差齐性检验,非正态及方差不齐者,进行自然对数转换,多组计量资料间差异性研究用方差分析,两组计量资料用t检验。相关性采用多元逐步logistic回归分析方法。
2 结果
2.1 三组的测定参数比较 与正常对照组比较,DM组和DPN组的病程、TG、LDL-C、HbAlc、FPG、2hPG、FINS、HOMA-IR、HOMA-IR均增高,HDL-C、HOMA-β、TBIL、IBIL、DBIL则降低,差异均有统计学意义(P<0.05)。DPN组和DM组的TBIL、IBIL、DBIL比较均降低,差异均有统计学意义(P<0.05)。三组间年龄、BMI、SBP、DBP和TC差异均无统计学意义。见表1。
2.2 DPN与各指标相关性分析 以是否为DPN作因变量,以糖尿病病程、TBIL、IBIL、TG、TC、LDL-C、HDL-C、空腹血糖、空腹胰岛素为自变量,做多元线性回归分析,与是否为DPN相关性较强的指标依次为糖尿病病程、LDL-C、HOMA-IR总胆红素、间接胆红素。见表2。

表2 各测定参数与是否为DPN的多元线性回归分析
3 讨论
DPN的发病机制至今尚未完全阐明,公认血糖过高是一个重要因素。起病初主要是与高血糖有关的代谢性神经病,其次是血管性病变。但血糖的控制与神经病情并不一致,说明存在其它因素。由于其临床表现的多样化,用单因素学说难以圆满解释。目前以多因素相互作用学说占优势。在DPN中,比较明确的危险因素有年龄和糖尿病病程[5]。本研究显示,与是否为DPN相关性较强的指标依次为糖尿病病程、LDL-C、HOMA-IR、总胆红素、间接胆红素,与上述研究结果一致。Vincent等人的研究显示,急性高血糖可产生神经细胞的氧化应激性损伤和细胞凋亡。Ziegler等人的研究资料表明,氧化应激和抗氧化防御机制与糖尿病多神经病变和心脏自主神经病变的严重性相关,在出现糖尿病神经病变之前,患者的氧化应激反应已经增高,合并糖尿病神经病变时氧化应激反应进一步增高,而在合并糖尿病神经病变和自主神经病变的患者中,氧化应激反应最强。这些研究进一步证实氧化应激反应是促使DPN形成和发展的重要因素。
新近研究显示胆红素其强抗氧化性被逐渐揭示,Stocker等[6]发现胆红素含有一个延伸共轭双键体系和活性氢原子,能够阻止氧化作用并证实它的抗氧化活性比VitC、VitE、β胡萝卜素等强,因此胆红素具有防止脂质和脂蛋白被氧化的作用,能有效地阻止DPN的形成。一些动物实验、体外及人体试验均已证实胆红素是一强有力的生理性抗氧化剂,它能够抑制脂质氧化及氧自由基的形成,清除氧自由基,抑制免疫反应及炎症反应[7-9]。本研究显示DPN组和DM组的TBIL、IBIL、DBIL与对照组比较均降低,DPN组和DM组的TBIL、IBIL、DBIL比较均降低,说明DPN组具有更低的胆红素水平,对周围神经的抗氧化作用减弱,从而导致DPN的发生。
表1 三组的测定参数比较(±s)
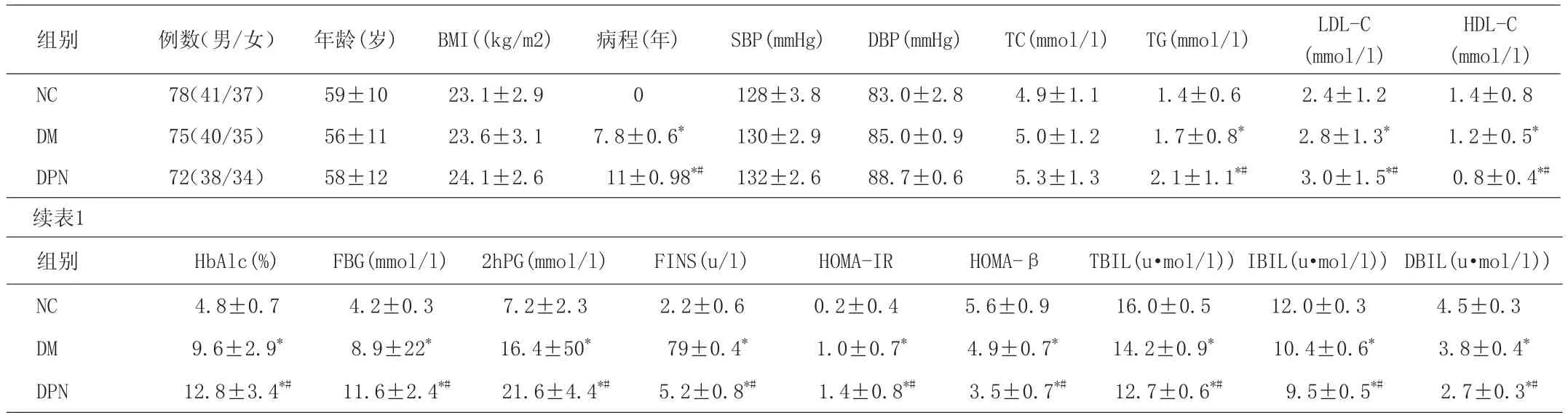
表1 三组的测定参数比较(±s)
注:与NC比较 vs NC,*P<0.05;与DM比较vs DM,#P<0.05
HDL-C(mmol/l)NC 78(41/37) 59±10 23.1±2.9 0 128±3.8 83.0±2.8 4.9±1.1 1.4±0.6 2.4±1.2 1.4±0.8 DM 75(40/35) 56±11 23.6±3.1 7.8±0.6* 130±2.9 85.0±0.9 5.0±1.2 1.7±0.8* 2.8±1.3* 1.2±0.5*DPN 72(38/34) 58±12 24.1±2.6 11±0.98*# 132±2.6 88.7±0.6 5.3±1.3 2.1±1.1*# 3.0±1.5*# 0.8±0.4*#续表1组别 例数(男/女) 年龄(岁) BMI((kg/m2) 病程(年) SBP(mmHg) DBP(mmHg) TC(mmol/l) TG(mmol/l) LDL-C(mmol/l)组别 HbAlc(%) FBG(mmol/l) 2hPG(mmol/l) FINS(u/l) HOMA-IR HOMA-β TBIL(u·mol/l))IBIL(u·mol/l))DBIL(u·mol/l))NC 4.8±0.7 4.2±0.3 7.2±2.3 2.2±0.6 0.2±0.4 5.6±0.9 16.0±0.5 12.0±0.3 4.5±0.3 DM 9.6±2.9* 8.9±22* 16.4±50* 79±0.4* 1.0±0.7* 4.9±0.7* 14.2±0.9* 10.4±0.6* 3.8±0.4*DPN 12.8±3.4*# 11.6±2.4*# 21.6±4.4*# 5.2±0.8*# 1.4±0.8*# 3.5±0.7*# 12.7±0.6*# 9.5±0.5*# 2.7±0.3*#
总之,本研究显示血清胆红素与DPN密切相关,低血清胆红素水平可能促使了DPN的发生与发展。但因本研究样本量较小,尚不能完全肯定低血清胆红素水平与DPN发病具有因果关系,要明确其间的关系,还需做大规模的前瞻性研究来证实。
[1]Aszmann O, Tassler PL, Dellon AL. Changing the natural history of diabetic neuropathy: incidence of ulcer/amputation in the contralateral limb of patients with a unilateral nerve decompression procedure[J]. Ann Plast Surg,2004, 53(6): 517-522.
[2]Pham HT, Rich J, Veves A. Wound healing in diabetic foot ulceration: a review and commentary[J]. Wounds, 2000,12: 79-81.
[3]Miejer JW, Bosma E, Lefrandt JD, et al. Clinical diagnosis of diabetic polyneuropathy with the diabetic neuropathy symptom and diabetic neuropathy examination scores[J]. Diabetes Care,2003,26(3): 697-701.
[4]Benaron DA, Bowen FW. Variation of initial serum bilirubin rise in newborn infants with type of illness[J]. Lancet,1991,338 : 78-81.
[5]Valensi P, Giroux C, Seeboth-Ghalayini B, et al. Diabetic peripheral neuropathy: Effects of age, duration of diabetes, glycemic control,and vascular factors[J]. J Diabetes Complications,1997,11: 27-34.
[6]Cao G,Alessio HU,Cutler R G.Oxygen radical absorbane capacity assay for antioxidants[J].Free-Kadic Biol Med,1993,14:303-301.
[7]Stocker R, Yamamoto Y, McDonagh AF, et al. (1987) Bilirubin is an antioxidant of possible physiological importance[J]. Science 235:1043-1046.
[8]Stocker R, Glazer AN, Ames BN. Antioxidant activity of albumin-bound bilirubin[J]. Proc Natl Acad Sci USA ,1987,84:5918-5922.
[9]Neuzil J, Stocker R. Free and albumin-bound bilirubin are efficient co-antioxidants for alpha-tocopherol, inhibiting plasma and low density lipoprotein lipid peroxidation[J]. J Biol Chem,1994,269:16712-16719.

