鸡新城疫病毒新疆分离株F基因遗传进化分析*
沙依兰古丽,汪 萍,巴特力,陆桂丽,成 进
(1.新疆畜牧科学院兽医研究所,新疆乌鲁木齐 830000;2.新疆维吾尔自治区动物卫生监督所,新疆乌鲁木齐 830063)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的以禽类消化道、呼吸道损伤为主要特征的急性高度接触性传染病。该病呈世界范围分布,给养禽业带来重大经济损失。我国采取以免疫为主的综合防控措施,在一定程度上控制了新城疫大规模流行,但该病仍然是目前危害我国禽类的重大传染病之一,并且呈现许多新的流行病学特点,如非典型性新城疫、新城疫病毒新基因(亚)型出现,宿主范围扩大和毒力增强等对新城疫防控带来了一定的困难。
NDV属于副黏病毒科、副黏病毒亚科、禽腮腺炎病毒属[1]。基因组大小约为15kb,由L、NP、P、HN、F、M等6种特异性结构蛋白组成[2],其中F蛋白具有使病毒脂蛋白囊膜与宿主细胞膜融合的功能,参与病毒的穿入过程。根据NDV F糖蛋白基因的序列变异情况,有人将NDV划分成不同的基因型,并认为F蛋白结构功能变化与NDV致病性密切相关[3]。目前NDV只有一种血清型,但研究表明NDV不同毒株之间的抗原性差异正在逐渐加大,再加上生产中新城疫疫苗的使用频繁且混乱,导致近些年ND出现不同的流行特点和新的毒株的出现。我们于2008年从新疆乌鲁木齐市郊区个体专业养禽场的发病鸡群中分离到两株鸡源NDV强毒,并对其F基因进行了克隆、基因序列测定及遗传进化分析。
1 材料与方法
1.1 材料
1.1.1 毒株来源与背景 2株NDV强毒株均从新疆乌鲁木齐市郊区个体专业养鸡场发病鸡群中分离获得,毒株编号与背景见表1。

表1 NDV新疆分离毒株背景Table 1 The number and background of NDV isolated from Xinjiang
1.1.2 菌种和载体 E.coli感受态细胞DH5α由本研究室自备,克隆载体PGEM-T为Promega公司产品。
1.1.3 主要试剂与工具酶 RT-PCR试剂盒(One Step RNA Extaction Kit)、IPTG、X-gal、EX Taq DNA聚合酶、限制性内切酶EcoRⅠ和DNA Marker DL 2 000均为宝生物工程(大连)有限公司产品;DNA胶回收试剂盒、质粒快速提取试剂盒为Promega公司产品;其他试剂均为国产分析纯试剂。
1.2 方法
1.2.1 病毒增殖与血凝(HA)效价测定 将分离毒株适当稀释后,经尿囊腔接种10日龄SPF鸡胚(0.1mL/胚),37℃孵育,收集24h后死亡胚尿囊液,按常规微量检测法检测血凝效价,置-20℃冻存备用。
1.2.2 PCR引物的设计与合成 根据国内外已发表的NDV强毒F基因序列,用Oligo 6.0软件设计两对特异性引物,由上海生工生物工程技术服务有限公司合成。
引物 1:F1:5′-ATG GGC TCC AAA CCT TCT AC -3′;F2:5′-TTG TAG TGG CTC TCA TC-3′。
引物 2:F1:5′-ATG GGC TCC AAA CCT TCT AC -3′;F2:5′CGG CTG ACT CTG TGT TCA GAT T-3′。
1.2.3 RNA的提取 吸取250μL的含毒鸡胚尿囊液,按照Trizol LS Reagent试剂盒的使用说明书进行操作,最后用20μL 1mL/L DEPC处理的灭菌去离子水洗脱溶解RNA。
1.2.4 RT-PCR扩增 取5μL提取的核酸做模板,直接用于 RT-PCR扩增。RT-PCR程序:50℃反转录30min;94℃5min;94℃40s,55℃ 30s,72℃2min,循环35次;最后在72℃延伸10min。取RT-PCR产物4μL用10g/L的琼脂糖凝胶电泳进行分析。
1.2.5 F基因的克隆与鉴定 切下PCR产物中含有目的片段的琼脂糖凝胶,按Promeg公司的凝胶纯化试剂盒说明书进行回收。把所得的RT-PCR纯化产物连接于pGEM-T Easy载体,连接产物转化DH5α感受态细胞,转化产物涂布于含有24mg/mL IPTG、50mg/mL X-gal和10mg/mL Ampinicillin的LB琼脂板上,37℃培养过夜。次日平板置于4℃2h充分显色,挑取白色菌落分别接种于LB液体培养基中,37℃、180r/min摇床培养10h。按质粒抽提试剂盒说明书提取质粒。提取质粒进行PCR快速鉴定,将阳性质粒送上海生工生物工程技术服务有限公司测序。
1.2.6 F基因核苷酸及氨基酸序列的分析 利用DNA Star 6.1软件对新疆分离的2株NDV F基因的核苷酸和氨基酸序列与GenBank具有代表性的参考毒株进行同源性比较分析,绘制基因系统发育树。
2 结果
2.1 RT-PCR 扩增
用设计的特异性引物成功扩增出大小约1.6 kb的目的片段,与预期大小相符(图1)。
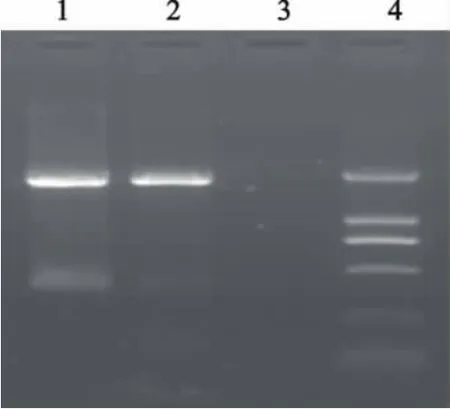
图1 F基因的RT-PCR扩增产物电泳图Fig.1 Electrophoresis of RT-PCR products of F gene
2.2 F基因的克隆与PCR鉴定
挑取白色菌落培养,提取重组质粒,以重组质粒为模板,用上述一对特异性引物分别进行PCR快速鉴定,结果均扩增出与预期大小一致的约1 600bp基因,表明F基因已成功克隆到PGEM-T Easy载体上。
2.3 F基因序列测定与分析结果
将获得的阳性质粒送上海生工生物工程技术服务有限公司进行序列测定,获得的2株NDV新疆分离株的F基因核苷酸序列和编码的氨基酸序列符合NDV病毒F基因序列长度,氨基酸裂解位点与 NDV 强毒株的特征相符,均为112R-R-Q-K-RF117;在氨基酸序列101位和121位的氨基酸为赖氨酸(K)和缬氨酸(V),为基因Ⅶ NDV强毒株的特征性氨基酸(表2和表3)。
2.4同源性分析
应用DNA Star分析软件对2株NDV毒株与国内外不同基因型毒株以及疫苗毒株之间的核苷酸序列进行了同源性比对。结果显示,新疆NDV/XJ/10/08毒株与 NDV/XJ/17/08之间的同源性为98.5%;这2个毒株与国内外流行的基因Ⅶ型强毒株之间的同源性在87.4%~98.2%,其中与NDV基因Ⅶd亚型毒株的同源性较高在94.4%~98.2%;与现用基因Ⅱ和基因Ⅲ型疫苗毒株(clone 30、B1、LaSota、Mukteswar 等 )之 间 的 同 源 性81.8%~84.2%,与其他Ⅰ、Ⅳ、Ⅴ、Ⅵ、Ⅷ、Ⅸ等基因型毒株同源性在84.6%~86.5%(表4和表5)。

表2 NDV新疆分离株的F基因核苷酸长度、编码的多肽长度和氨基酸裂解位点序列Table 2 The nucleoide length,polypeptides length and the sequence of amino acid of F gene of NDV Xinjiang isolates

表3 NDV新疆分离株的F基因氨基酸序列及裂解位点序列Table 3 The amino acid sequence and cleavage site sequence of F gene
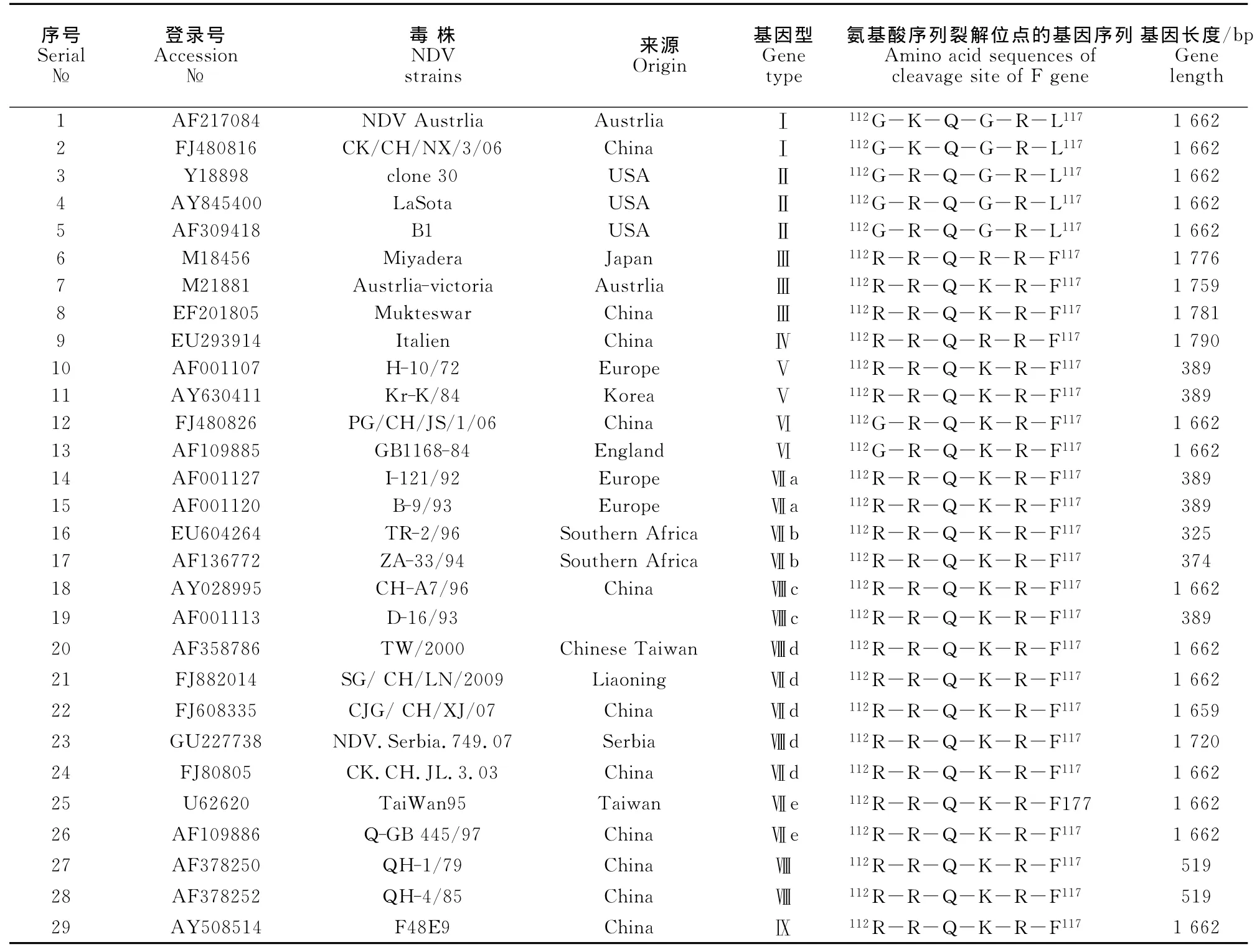
表4 本文中参考的NDV毒株Table 4 NDV strains used in polygenetic analyses
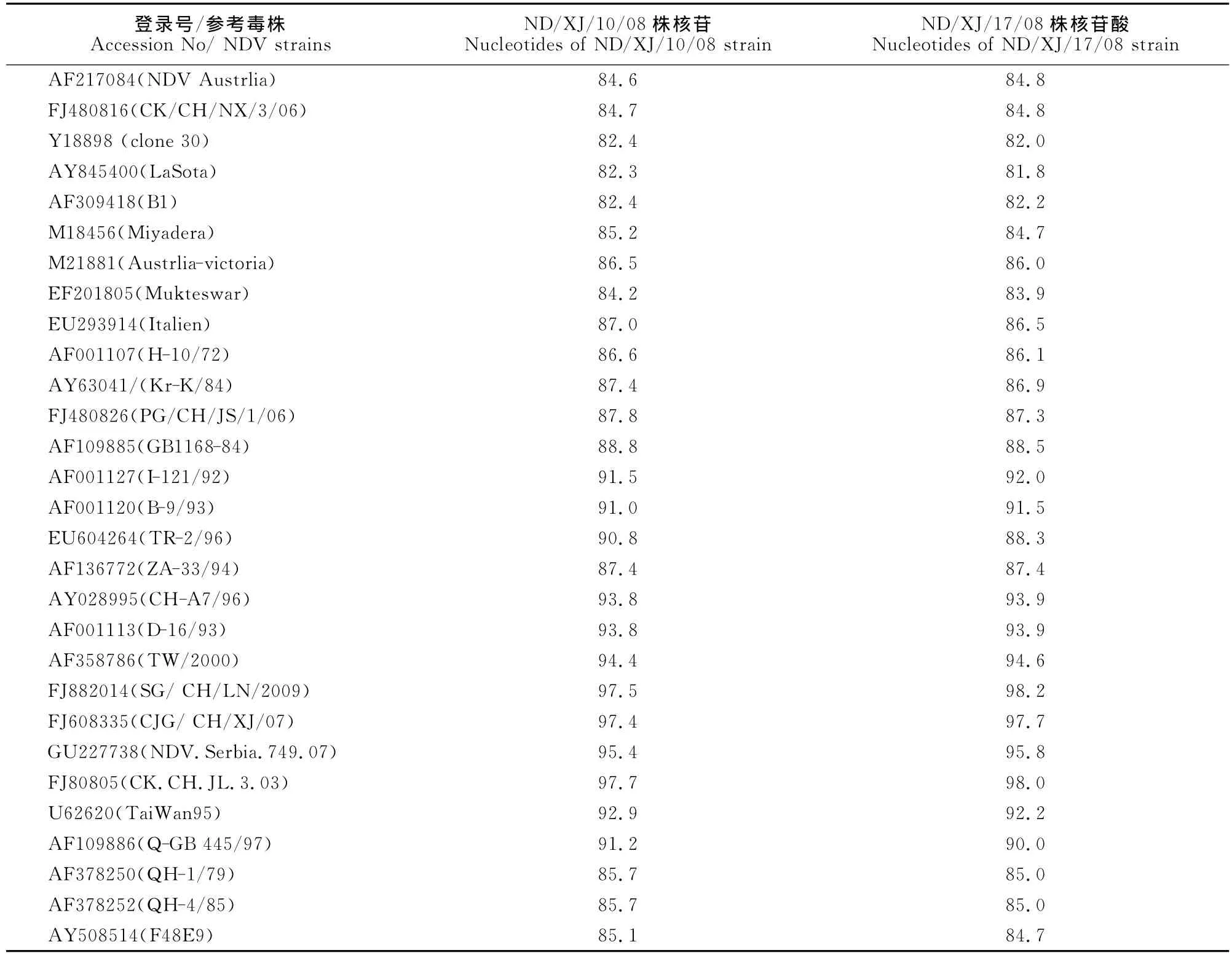
表5 NDV新疆分离株与国内外参考株F基因核苷酸序列同源性比较Table 5 The nucleotide homology analysis of F gene between Xinjiang strains and reference strains
2.5 系统进化分析
应用DNA Star软件将新疆分离的2株NDV毒株F基因核苷酸序列与国内外参考毒株F基因核苷酸序列进行遗传进化分析,并绘制了其系统进化树(图2)。从图中可以看出,新疆分离的NDV/XJ/10/08和 NDV/XJ/17/08 毒 株 的 亲 缘 关 系 很近,与这几年国内流行的Ⅶd同源性较高,都在同一分支上;而与 Clone 30、La Sota、B1、Mukteswar等疫苗毒株的亲缘关系较远。
3 讨论
本研究对2株鸡源NDV新疆分离株的F基因进行了扩增、克隆和序列分析,发现2个NDV分离株同源性为98.5%,与国内外流行的基因Ⅶ型强毒株之间的同源性为87.4%~98.0%,其中与国内流行的基因Ⅶd亚型毒株(GenBank登陆号:FJ882014、FJ608335、FJ80805)的同源性较高,在97.4%以上;与现用疫苗毒株(clone 30、B1、LaSo-ta、Mukteswar等)同源性较低,在81.8%~84.2%之间;与NDV其他 (Ⅰ、Ⅳ、Ⅵ、Ⅸ)基因型毒株同源性也低,在84.6%~91.2%之间。
NDV毒株分成9个基因型,其中I~Ⅵ是早已存在的老基因型,Ⅶ、Ⅷ和Ⅸ为新发现的基因型,其中NDV基因Ⅶ型为强毒株,分为Ⅶa、Ⅶb、Ⅶc、Ⅶd、Ⅶe型等 5 个 基 因 亚型[7-9]。我国目前流行的NDV主要基因为Ⅶ型,但也存在Ⅲ 、Ⅸ 、Ⅵ等其他基因型散发,基因Ⅶ型NDV所占的比重呈逐年上升的趋势,其中基因Ⅶd亚型毒株占的比例超过60%[10-12]。本研究分析表明,2个 NDV 新疆分离株均属于基因Ⅶ型强毒株,其中与近年来国内流行的基因Ⅶd亚型毒株的遗传距离很近,均属于NDV基因Ⅶd亚型毒株;与传统的疫苗株clone 30、Bl、La Sota和Mukteswar的遗传距离较远,这可能是现有ND疫苗免疫后不能形成有效保护的一个重要原因。

图2 NDV新疆分离株与国内外参考株F基因核苷酸之间的系统进化树Fig.2 The phylogenetic tree analysis of F gene between Xinjiang strains and reference strains
F基因是NDV感染细胞所必需的主要结构蛋白[4-5],它可以促进病毒囊膜与细胞膜的融合,从而使病毒穿入细胞浆脱去核衣壳进行复制,毒力不同的NDV毒株F基因序列不同,其差异主要集中在F基因的裂解区,强毒株裂解区的氨基酸序列为112R-R-Q-K/R-R-F117,而弱毒株为112G-K/R-QG/S-R-L117[6]。本研究对2个NDV 新疆毒株F基因裂解位点区的氨基酸序列分析表明,NDV/XJ/10/08和 NDV/XJ/17/08株与强毒株 F基因裂解区的氨基酸序列相符,属于强毒株。
研究发现,常规疫苗免疫鸡群并不能阻止NDV强毒的感染和排毒,但是HI抗体水平很高时,可以减轻鸡群临床症状、降低死亡率和发病率,也就是临床上的非典型性新城疫。因此,传统的弱毒疫苗免疫并不能完全消除新城疫的发生,反而会引起新城疫原性的变异,导致新城疫免疫失败和非典型性ND的发生。同时,弱毒株在疾病的传播中所起的作用也不能忽略,随着新城疫的继续演化可能会出现新的基因亚型和变异株[13-17]。因此,应密切关注生产中NDV抗原性的变化,筛选与当前NDV流行株密切相关的毒株作为候选疫苗株配合常规疫苗免疫,才能更好地控制新城疫的流行。
[1]成大荣,徐建生.新城疫病毒的F蛋白与遗传学分群[J].预防兽医学进展,2001,3(11):37-40.
[2]王运湘,王珣章,余为一.新城疫病毒分子生物学研究进展[J].安徽大学学报,1997,24(3):320-322.
[3]Chambers P,Millar N S,Emmerson P T.Nucleotide sequence of the gene encoding the fusion glycopmtein of Newcastle disease virus[J].J Gen Virol,1986,67:2685-2694.
[4]Toyoda T,Sakaguchi T,Hirota H,et al.Newcastle disease virus evolution II.Lack of gene recombination in generating virulent and avirulent strains[J].Virology,1989,69:273-282.
[5]Collins M S,Strong I,Alexander D J.Evalution of the molecular basis of pathogenicity of the variant Newcastle disease virus termed pigeon PPMV-Ⅰviruses[J].Arch Virol,1994,134:403-411.
[6]Aldous E W,Alexmlder D J.Detection and diferentiation of Newcastle disease virus(avian paramyxo-virus typeⅠ)[J].A-vian Pathol,2000,30:117-128.
[7]Ballagi-Pordany A,Wehmann E,Herczeg J,et a1.Identification an d grouping of Newcastle disease virus strains by restriction site analysis of aegion from the F gene[J].Arch Virol,1996,141:243-261.
[8]Lomniczi B,Wehmnnn E,Herczeg J,et al.Newcastle discase outbfeaks in recent years in western Europe were caused by an old(V I)and a novel genotype(VI)[J].Arch Virol,1998,143:49-64.
[9]Kwon H J,Cho S H,Ahn Y J,et al.Molecular epidemiology of Newcastle disease in the Republic of Korea[J].Vet Microbiol,2003,5:39-48.
[10]Wang Z L,Liu H L,Xu J T,et al.Genotyping of Newcastle disease viruses isolated from 2002to 2004in China[J].Annals New York Academy of Sciences,2006,1081:228-239.
[11]Liu H L,Wang Z L,Wu Y G,et al.Molecular epidemiological analysis of Newcastle disease virus isolated from China in 2005[J].J Virol Meth,2007,140:206-211.
[12]孙敏华,胡奇林.新城疫病毒分子流行病学研究进展[J].动物医学进展,2010,31(12):95-99.
[13]Werner O,Oberdorfer A,Koliner B.Characterization of avian paramyxovirus type I strains isolated in Germany during 1992 to 1996[J].Avian Pathol,1999,28:79-88.
[14]King D J,Seal B S.Biological and molecular characterization of Newcastle disease virus isolates from surveillance of live bird markets in the Northeastern United States[J]Avian Dis,1997,41(3):683-689.
[15]Kim L M,King D J,Curry P E,et a1.Phylogenetic diversity among low-virulence Newcastle disease viruses from waterfowl and shorebirds and comparison of genotype distributions to those of poultry-origin isolates[J].J Virol,2007,81(22):12641-12653.
[16]Zhang R,Pu J,Su J L,et a1.Phylogenetic characterization of Newcastle disease virus isolated in the mainland of China during 200l-2009[J].Vet Microbiol,2010,141(3-4):246-257.
[17]Miller P J,Estevez C,Yu Q Z,et a1.Comparison of viral shedding following vaccination with inactivated and live Newcastle disease vaccines formulated with wild-type and recombinant viruses[J].Avian Dis,2009,53:39-49.