三株鸡源H4亚型禽流感病毒分离株HA基因的序列分析
张 鹏,黄 娟,陈 杰,蒋文明*,陈继明,单 虎
(1.青岛农业大学动物科技学院,山东青岛 266109;2.中国动物卫生与流行病学中心,山东青岛 266032)
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科A型流感病毒属,亚型众多,根据致病力的差异可分为高致病性AIV和低致病性AIV[1]。高致病性AI在国内外频频暴发,不仅给养禽业造成严重的损失,同时也威胁人类的健康,从而引起了人们的高度重视。低致病性AIV 虽对动物多呈低致病性,但具有分布广泛的特点,能够使产蛋量下降,造成宿主的免疫抑制以及可以与其他病原微生物发生协同作用,引起继发感染,其危害也不容忽视[2]。
H4亚型AIV是一种低致病性毒株,多从水禽和野鸟体内分离到,在鸭、鹅和鸟等体内持续存在,并且可能传播给鸡[2-3],鸡感染后不引起明显的临床疾病或死亡,只能观察到轻微病变或弱血清阳转,但是会持续排毒,这给鸡群禽流感的控制带来了困难[3]。H4亚型AIV感染后,可再次感染H5、H9或其他亚型AIV,在宿主体内可能发生复杂的基因重组,产生新型的重组病毒。1999年,加拿大报道了从患有肺炎的猪体内分离到H4N6亚型AIV[4],我国猪群也受到H4亚型AIV的威胁[5],表明该亚型病毒也可以在种间传播。因此,有必要对H4亚型AIV加强监测。
国内自20世纪80年代起虽不断有分离到H4亚型AIV的报道,但是大多通过血清学进行亚型鉴定的[6-8]。NCBI流感病毒数据库收录了来自中国内地的H4亚型AIV 18株,其中,提交了血凝素(hemagglutinin,HA)全基因序列的仅有8株,即 A/mallard/PoyangLake/15/2007(H4N6)(FJ428583),A/mallard/Yanchen/2005(H4N6)(EU880342),A/duck/Nanchang/4165/2000(H4N6)(CY006017),A/duck/PoyangLake/FB13/2007 ( H4N6 )(FJ439566 ), A/mallard/PoyangLake/P17/2007(H4N6)(FJ439565),A/mallard/Zhalong/88/2004(H4N6)(FJ349247),A/duck/Hunan/819/2009(H4N2)(HQ285886),A/duck/Guangxi/912/2008(H4N2)(CY076892),这些毒株全部来源于鸭和野鸭,尚无鸡源H4亚型AIV分离株的HA全基因序列。
本研究对新分离的3株鸡源H4亚型AIV进行了HA基因的全序列测定及分析,为进一步了解H4亚型AIV的来源和进化特征,探讨其分子演化规律提供线索。
1 材料与方法
1.1 材料
1.1.1 样品 2010年10月份全国禽病流行病学调查中,自安徽省某鸡场采集的鸡口腔和泄殖腔拭子(由中国流行病学与动物卫生中心提供),拭子装在含有抗生素的PBS甘油采样液中。
1.1.2 SPF鸡胚 SPF鸡胚购自北京梅里亚公司。
1.1.3 主要试剂 RNAiso Plus和RNA病毒一步法PCR试剂盒为宝生物工程(大连)有限公司产品。DNA胶回收试剂盒为上海生工生物工程技术服务公司产品。
1.1.4 引物 根据A型流感病毒血凝素(HA)基因片段两端的核苷酸保守序列,采用Primer 5.0设计引物,由上海生工生物工程技术服务有限公司合成。上 游 引 物 P1: 5 '-TATTCGTCTCAGGGAGCGAAAGCAGGGG-3',下 游 引 物 P2:5'-ATATCGTCTCGTATTAGTAGAAACAAGGGT GTTTT-3',预期PCR产物大小为1 750bp。
1.2 方法
1.2.1 病毒分离 将采集的拭子以10 000r/min离心5min,每个拭子取上清液经尿囊腔接种两枚9日龄SPF鸡胚,37℃培养,每24h观察一次,收集24 h~72h自然死亡和未死亡鸡胚尿囊液,置-70℃冰箱保存备用。
1.2.2 RNA提取 取300μL尿囊液到800μL RNAiso Plus中混匀,静置5min;加入250μL氯仿,振荡混匀,静置5min;4℃、12 000r/min离心15 min;小心吸取上清540μL,加入等体积的异丙醇,混匀,-20℃静置2h~3h,以沉淀 RNA;4℃、12 000 r/min离心10min,弃上清;加入1mL浓度为750 mL/L的乙醇洗涤1次;4℃、8 000r/min离心5 min;弃上清,干燥,用20μL DEPC水溶解RNA,置-70℃保存备用。
1.2.3 HA基因的扩增、克隆与测序 按照RNA病毒一步法PCR试剂盒的说明书进行操作,PCR条件为:50℃30min,94℃2min,94℃30s,57℃30s,72℃2min,30个循环;72℃10min。DNA片段回收后与pMD18-T载体连接后转化,经氨苄平板筛选出阳性质粒,鉴定后送上海生工生物工程技术服务有限公司进行测序。
1.2.4 序列分析和比较 用DNA Star软件对测定的病毒HA基因全长序列进行分析,并与GenBank中的中国分离株进行比较。所用到的毒株有A/mallard/PoyangLake/15/2007(H4N6)(FJ428583),A/mallard/Yanchen/2005(H4N6)(EU880342),A/duck/Nanchang/4165/2000(H4N6)(CY006017),A/duck/PoyangLake/FB13/2007 ( H4N6 )(FJ439566 ), A/mallard/PoyangLake/P17/2007(H4N6)(FJ439565),A/mallard/Zhalong/88/2004(H4N6)(FJ349247),A/duck/Hunan/819/2009(H4N2)(HQ285886),A/duck/Guangxi/912/2008(H4N2)(CY076892)。
1.2.5 国内外H4亚型AIV分离株HA基因序列比较 根据已测得的HA基因序列,在NCBI的Influenza Virus Resource数据库里,搜索所有其收录H4亚型的基因序列,对于同一国家或地区,同一年份或相似年份,同一H亚型随机选取一株,共选取42株序列,应用MEGA5软件对所测得的序列和在NCBI数据里选定的序列进行比较,构建进化树。
2 结果
2.1 HA基因的RT-PCR扩增与克隆测序
从尿囊液提取的RNA模板中扩增得到HA基因片段,10g/L的琼脂糖凝胶电泳证明获得了与预期1 750bp左右的片段大小相符的清晰的、单一条带。将纯化的PCR产物克隆到pMD18-T载体并测序,通过序列比对可鉴定为H4亚型禽流感病毒,毒株命 名 为 A/chicken/Anhui/AB22/2010、A/chicken/Anhui/AB29/2010, A/chicken/Anhui/AB30/2010。
2.2 序列分析结果
用DNA Star分析序列可得,A/chicken/Anhui/AB22/2010,A/chicken/Anhui/AB30/2010 和 A/chicken/Anhui/AB29/2010的 HA 基因编码区均由1 738个核苷酸组成,有一个开放阅读框(ORF),大小为1 605bp,编码535个氨基酸。
推导的氨基酸序列分析表明,A/chicken/Anhui/AB22/2010和 A/chicken/Anhui/AB29/2010两株毒株含有5个潜在的糖基化位点,其中4个位于HA1部分(15aa~17aa、31aa~33aa、175aa~177aa、307aa~309aa),1个位于 HA2部分(494aa~496aa)。A/chicken/Anhui/AB30/2010含有6个潜在的糖基化位点,其中5个位于HA1部分(11aa~13aa、15aa~17aa、31aa~33aa、175aa~177aa、307aa~309aa),1个位于HA2部分(494aa~496aa)。3株毒株的裂解位点处氨基酸均为PEKASRG,均符合典型的低致病性AIV特征(表1)。
2.3 3个分离株与国内毒株HA基因序列比较
通过MEGA软件运算可得A/chicken/Anhui/AB22/2010,A/chicken/Anhui/AB29/2010 和 A/chicken/Anhui/AB30/2010 3株分离株之间的同源性在99%以上,与国内报道毒株的同源性在80%到90%之间,但与来自湖南的毒株 A/duck/Hunan/819/2009(H4N2)遗传距离在0.02以下,即同源性在98%以上(表2)。

表1 HA基因几个关键位点的分析Table 1 Amino acids in the key sites of the HA gene of 3isolates
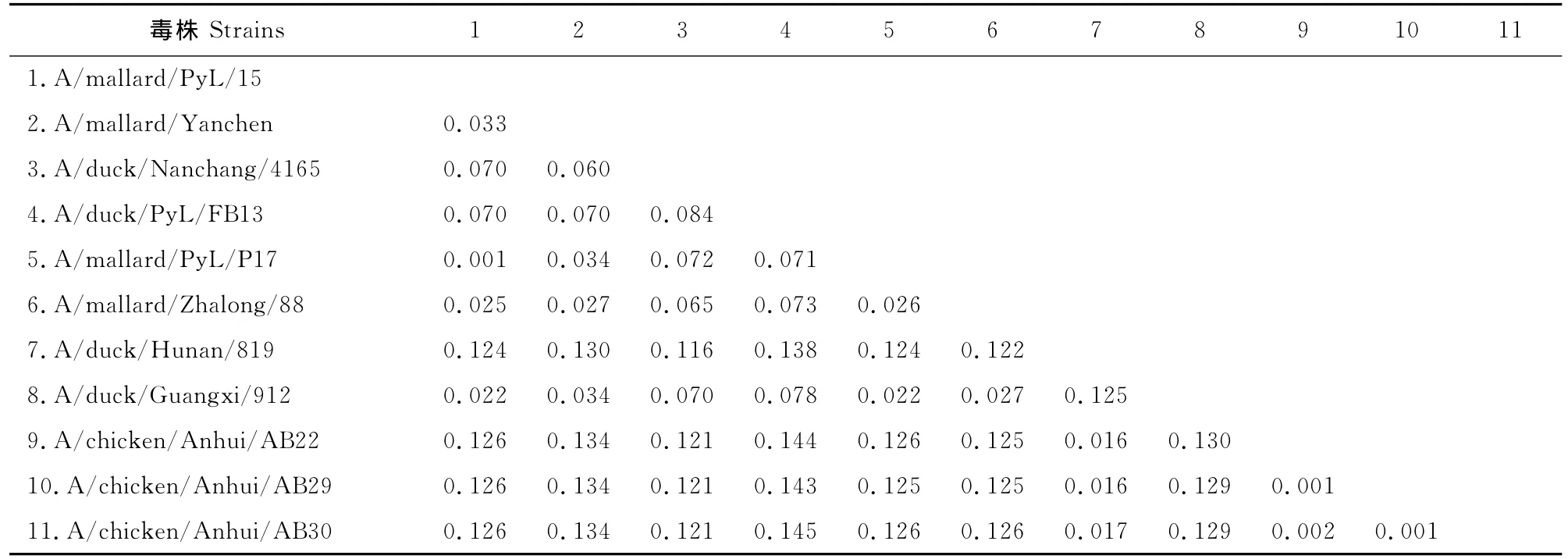
表2 分离株与国内报道毒株的遗传距离Table 2 Genetic distance of isolates and domestic reported strains
2.4 国内外H4亚型AIV分离株HA基因序列比较
用MEGA5软件绘制出的进化树(图1),从进化树上看,全球H4亚型存在着差异较大的两个谱系,即西半球谱系(h4.1谱系)和东半球谱系(h4.2谱系),并且这两个较大的分支演变出了很多个亚分支。中国内地分离株分别处于h4.2.3(亚洲)分支和h4.2.6分支(欧亚)上,3个分离株与湖南的毒株A/duck/Hunan/819/2009(H4N2)同处于东半球谱系的欧亚分支上。
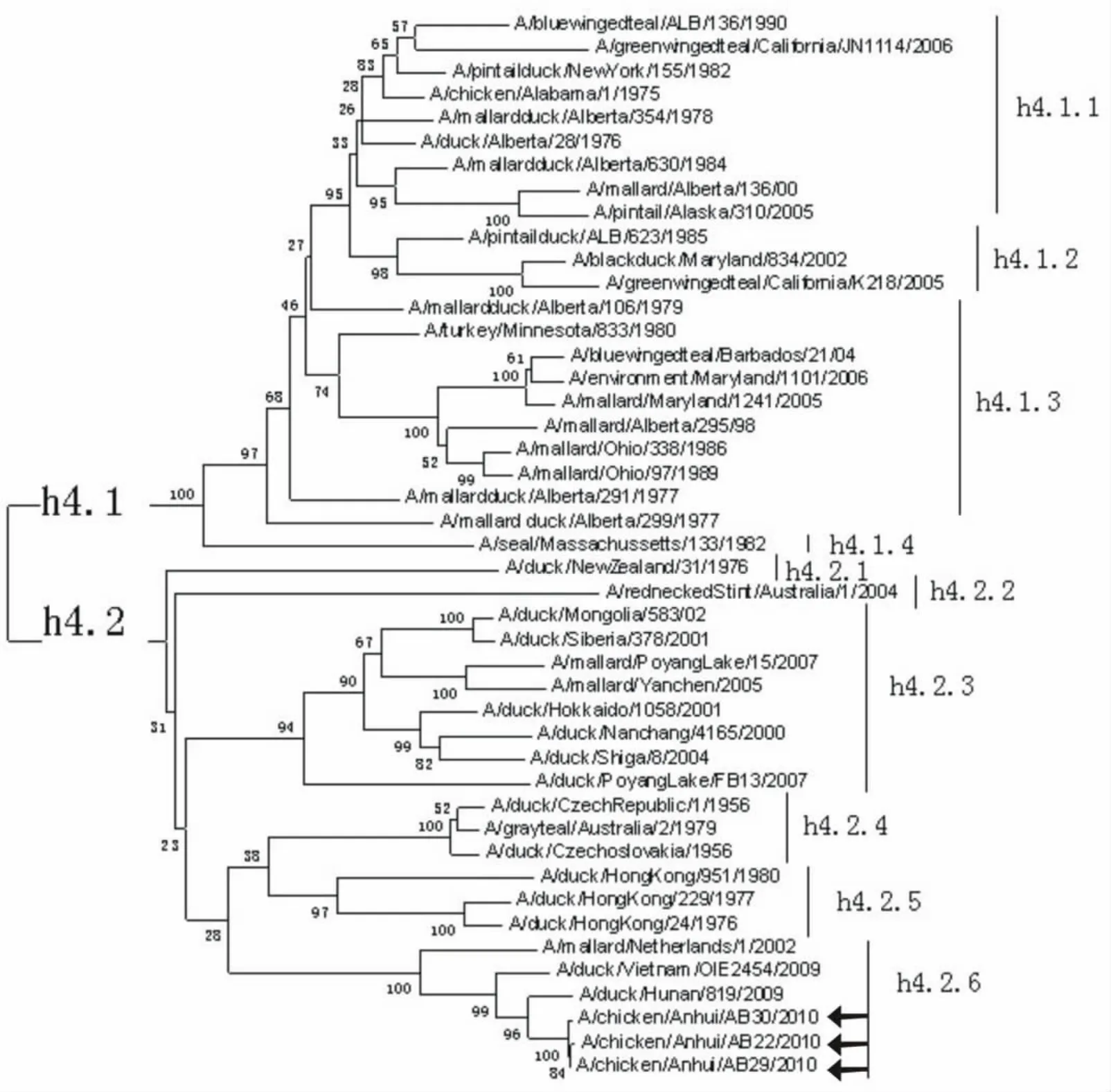
图1 全球H4亚型禽流感病毒进化分析(箭头所指为分离株)Fig.1 Phylogenetic analysis of global H4AIV(the arrows indicate isolates)
3 讨论
HA是AIV表面的一种糖蛋白,是AIV亚型或新变种的主要标志,其裂解位点的序列直接影响毒株致病力的高低[9]。因此,研究HA基因有助于了解AIV的特征和来源,从而进行风险分析、评估和疾病预报预警。HA上裂解位点及糖基化位点的突变则有可能导致病毒毒力发生根本性的变化。所有高致病力病毒在这一区域都含有多个碱性氨基酸序列[10],而低致病力毒株这一区域常含有一个精氨酸,在本研究中,3个H4亚型分离株裂解位点处氨基酸序列为PEKASR,仅含有1个精氨酸,为低致病性AIV的特征序列。3个分离株与A/duck/Hunan/819/2009(H4N2)亲缘关系很近,同源率可达98.4%以上,说明这些病毒可能由同一祖先演化而来。发生在HA受体结合位点上的突变有时可能改变病毒的宿主特异性,Allen C等[11]报道,H4亚型AIV 226位氨基酸由Gln(Q)突变为Leu(L),可提高对2,6-linkage唾液酸受体的结合活性,从而增加感染猪或人的风险,对所分离的3株H4亚型AIV此位点的分析表明,均为Asn(N),这种突变是否会影响病毒的毒力和宿主特性,当该病毒感染鸡是否会造成流行,仍需进一步的研究。
在遗传演化上,AIV的多数基因一般都可分为两个谱系,即东半球谱系和西半球谱系[12-13]。我们的分析结果显示,全球H4亚型的HIV确实存在着两个差别较大的谱系,西半球谱系和东半球谱系。我国国内分离株分别处于东半球谱系h4.2.3(亚洲)分支和h4.2.6分支(欧亚)上,其中,3株分离株处于东半球谱系的欧亚分支上,且与A/duck/Hunan/819/2009处于同一分支。东半球谱系相对于西半球谱系来说分支较为复杂,组间的同源性也比较低。H4亚型AIV多分离自水禽和野鸟,野生水禽(特别是野鸭)可将病毒传给家养水禽,家养水禽再将病毒传给陆生家禽,使病毒在陆生家禽之间传播,而且病毒还可回传给家养水禽,丰富了家养水禽的基因库,增加了病毒发生基因重组的机会[14],因此应加强对家养水禽(尤其是家鸭)的监测。
[1]塞 弗.禽病学[M].北京:中国农业出版社,2005.
[2]杨思远,柴洪亮,曾祥伟,等.1株野鸭源禽流感病毒全基因的分子克隆和测序[J].中国兽医学报,2006,26(1):103-105.
[3]Morales A C,Hilt D A,Williams S M,et al.Biologic characterization of H4,H6,and H9type low pathogenicity avian influenza viruses from wild birds in chickens and turkeys[J].A-vian Dis,2009,53(4):552-562.
[4]Karasin A I,Brown I H,Carman S,et al.Isolation and characterization of H4N6avian influenza viruses from pigs with pneumonia in Canada[J].J Virol,2000,74(19):9322-9327.
[5]Ninomiya A,Takada A,Okazaki K,et al.Seroepidemiological evidence of avian H4,H5,and H9influenza A virus transmission to pigs in southeastern China [J].Vet Microbiol,2002,88(2):107-114.
[6]唐秀英,田国斌,赵传珊,等.中国禽流感流行株的分离鉴定[J].中国畜禽传染病,1998,20(1):1-5.
[7]薛 峰,顾 敏,彭 宜,等.H4亚型家养水禽流感病毒分离株的表面膜蛋白基因的序列测定和遗传进化分析[J].畜牧兽医学报,2006,37(12):1334-1339.
[8]高明燕,胡茂志,孙 林,等.H4亚型禽流感病毒血凝素单克隆抗体的制备[J].中国动物检疫,2007,24(12):21-23.
[9]刘丽玲,李雁冰,张 翼,等.一株H4亚型禽流感病毒全基因组序列测定及遗传演化分析[J].中国预防兽医学报,2011,33(3):185-188.
[10]Steinhauer D A.Role of hemagglutinin cleavage for the pathogenicity of influenza virus[J].Virology,1999,258(1):1-20.
[11]Bateman A C,Busch M G,Alexander I K,et al.Amino acid 226in the hemagglutinin of h4N6influenza virus determines binding affinity forα2,6-linked sialic acid and infectivity levels in primary swine and human respiratory epithelial cells[J].J Virol,2008,82(16):8204-8209.
[12]Liu S,Ji K,Chen J M,et al.Panorama phylogenetic diversity and distribution of type A influenza virus[J].PLoS ONE,2009,4(3):e5022.
[13]McHardy A C,Adams B.The role of genomics in tracking the evolution of influenza A virus[J].PLoS Pathog,2009,5(10):e1000566.
[14]刘秀梵.家养水禽在我国高致病性禽流感流行中的作用[J].中国家禽,2004,26(12):125.