猪血管内皮细胞中分子伴侣Jiv90基因的克隆与原核表达*
杨幼聪,郭抗抗,张彦明,李宇立,张 倩,程媛媛,张三东,彭维刚
(西北农林科技大学动医学院,陕西杨陵 712100)
猪血管内皮细胞中分子伴侣Jiv90基因的克隆与原核表达*
杨幼聪,郭抗抗,张彦明*,李宇立,张 倩,程媛媛,张三东,彭维刚
(西北农林科技大学动医学院,陕西杨陵 712100)
克隆到猪Jiv90基因,构建原核表达载体并在大肠埃希菌中表达。从猪血管内皮细胞中克隆到Jiv90基因,将其克隆到pET-32a载体上,构建出重组表达载体,经IPTG诱导表达。结果表明,本试验成功克隆了大小为693 bp的基因,重组质载体pET-32a-Jiv90所表达的蛋白在大肠埃希菌中以包涵体的形式存在,表达产物经SDS-PAGE和Western blot鉴定大小为46 ku,与预期结果一致。为进一步研究该蛋白的功能及制备抗体奠定了基础。
Jiv90;pET-32a;原核表达
分子伴侣(molecular chaperone)是一类在进化上非常保守的蛋白质家族,是协助细胞在正常和胁迫条件下保持细胞内稳态的重要蛋白组分,参与许多正常的细胞生理反应过程。它们在反应过程中不与底物结合,不会成为终产物的组成部分[1],而是通过与各类蛋白质非特异性结合,催化蛋白质形成特定的构象,在生物体内起着稳定新生蛋白质、辅助其他蛋白质正确折叠、组装、转运甚至降解的作用,对蛋白质功能的发挥具有重要意义[2]。
在复杂的细胞内环境下,蛋白质的折叠是一个复杂、容易出错的过程,而病毒由于是细胞内寄生物,在其增殖过程中,需要大量病毒蛋白的翻译、折叠和运输等修饰过程。随着研究的不断深入,人们发现分子伴侣在病毒的不同生活周期中都扮演着重要的角色,如病毒的感染、病毒基因组的复制、基因的表达、病毒糖蛋白的折叠与成熟、病毒粒子的装配等过程中起着非常重要的作用[3-4]。病毒利用分子伴侣,其原因可能是有些病毒在进化过程中为保持其基因组足够小,因此需要利用伴侣分子帮助其完成复杂的功能。
许多真核、原核宿主的病毒可直接利用宿主细胞中的伴侣分子,或借助宿主细胞编码病毒的伴侣分子以及一些功能蛋白,以完成病毒增殖的许多相关过程,如流感病毒和水疱性口炎病毒依赖于宿主的分子伴侣进行血凝素以及病毒糖蛋白的折叠、组装和运输[5]。分子伴侣参与肿瘤细胞增殖、分化、基质侵染、血管生成、癌细胞转移以及细胞凋亡等过程。
Lackner T等[6-7]进一步研究发现,在宿主分子伴侣Jiv90的作用下,能将BVDV的NS2-3蛋白切割成NS2、NS3蛋白,NS3蛋白与瘟病毒属的复制的效率密切相关。细胞中过量表达Jiv90能导致非致细胞病变 BVDV的 RNA量的增加,且能引起CPE;将细胞中的Jiv90表达量下调或是将编码该蛋白的基因敲除,病毒 RNA及病毒粒子的量都表现出明显的下调,且无CPE出现。
2006年Lackner等发现,CSFV NS2蛋白与宿主细胞中的分子伴侣Jiv90有两个结合区域——JBPⅠ和JBPⅡ,两者相互作用后NS2蛋白发挥蛋白酶活性将NS2-3切割为NS2和NS3[8]。2008年Gallei等人将分子伴侣 Jiv90与非致细胞病变型(nCP)强毒株CSFV Alfort-p447构建嵌合病毒Alfort-Jiv90,将后者感染细胞,发现NS3蛋白和病毒RNA大量增加,同时出现了细胞病变(CPE)。这表明分子伴侣Jiv90能反式调节NS2-3的自我切割作用[9]。
目前对Jiv90基因的研究只是局限在与病毒的相互作用和对病毒复制的影响,对Jiv90蛋白本身的研究报道较少。本试验构建Jiv90基因的原核表达载体,并对其表达情况进行了研究,以期为下一步制备Jiv90单克隆抗体提供基础材料,同时为进一步深入研究Jiv90蛋白的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和细胞E.coliDH5α、BL21菌株、原核表达载体pET-32a和猪血管内皮细胞,均由本西北农林科技大学动物医学院畜禽疫病防治与畜产品安全实验室保存。
1.1.2 主要工具酶及试剂 限制性内切酶EcoRI、BamHⅠ、T4DNA连接酶以及PCR反应试剂、胶回收试剂盒反转录试剂盒等购自宝生物工程(大连)有限公司;总RNA提取试剂盒购自北京天根生化科技有限公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 引物合成 基于已发表的牛Jiv基因序列,利用Primer软件设计1对特异性引物,上、下游引物5′端分别引入了EcoRⅠ和HindⅢ限制性酶切位点(下划线部分)。上下游引物 P1:5′-CGGAATTCCAGCTGGCAGTGATGGT TCAT-3′;P2:5′-ATCAAGCT TT TTACTTCCGCCGCT TCGGTTTA-3′引物由南京金斯瑞生物科技公司合成。
1.2.2 RT-PCR反应 胰酶消化猪血管内皮细胞后收集细胞培养物,用总 RNA提取试验盒提取总RNA。以RNA为模板使用反转录试剂盒得到cDNA,以反转录得到的cDNA为模板,以模板,用特异性引物P1和P2进行扩增。反应条件为:95℃5 min;95℃30 s,63℃40 s,72℃30 s,共35个循环;72℃延伸10 min。扩增产物用10 g/L琼脂糖凝胶电泳分析。
1.2.3 原核重组表达质粒pET-32a的构建及鉴定将目的基因进行PCR扩增、回收后,与pET-32a表达载体分别用EcoRⅠ和HindⅢ双酶切,然后用T4 DNA连接酶连接,转化到DH5α感受态细胞中,挑取白色单克隆于含氨苄霉素抗性的LB培养液中37℃振荡过夜,提取质粒进行酶切及测序鉴定。
1.2.4 Jiv90基因在大肠埃希菌中的表达 将pET-32a-Jiv90转化到感受态大肠埃希菌BL21,涂布于含Amp+(100 μ g/mL)的 LB平板上,37 ℃培养过夜,次日挑取单菌落,于5 mL LB液体培养基中,37℃摇床振荡(200 r/min)培养过夜。
1.2.5 Jiv90蛋白的诱导表达与可溶性分析
1.2.5.1 不同浓度的IPTG对JIV90蛋白的诱导表达分析 将菌液按 1∶100接种于6 mL含有Amp+100 μ g/mL)抗生素的 LB液体培养基中,37℃振荡培养至OD600为0.4~0.6时,加入IPTG至终浓度分别为 0.25 mmol/L、0.5 mmol/L、0.75 mmol/L、1.0 mmol/L,37 ℃诱导表达 4 h~5 h,收获细菌,然后进行SDS-PA GE分析。
1.2.5.2 不同时间对Jiv90蛋白的诱导表达分析将冻存菌液按1∶100扩大接种于6 mL含有Amp+(100μ g/mL)抗生素的LB液体培养基中,37℃振荡培养至OD600为0.4~0.6时,加入IPTG至终浓度 0.25 mmol/L,37 ℃诱导表达 2 、3、4、5、6、7 h,收获细菌,然后进行SDS-PA GE分析。
1.2.5.3 Jiv90蛋白表达产物的可溶性分析将冻存菌液按1∶100扩大接种于6 mL含有Amp+(100 μ g/mL)抗生素的LB液体培养基中,37℃振荡培养至OD600为0.4~0.6时,加入IPTG至终浓度0.5 mmol/L,37℃诱导表达7 h,收获细菌,以 PBS重悬菌体,超声破菌。分别收集上清和沉淀,取上述各样品做SDS-PA GE电泳检测表达情况。
1.2.6 融合蛋白pET-32a-Jiv90蛋白Western blot检测 表达蛋白的电泳同1.5节。电泳结束后用Bio-rad电转移装置将其转印于PVDF膜上(半干转膜法100 V,1.5 h),转印结束后,按常规方法进行Western blot,一抗为鼠源抗HIS标签的抗体(1∶3 000倍稀释),二抗为辣根过氧化物酶标记的羊抗鼠IgG(体积比1∶4 000倍稀释),最后用DAB显色。
2 结果
2.1 Jiv90基因的PCR扩增
扩增出长度约为693 bp的1条带(图1),与预期的基因片段长度相符。
2.2 重组原核表达载体
pET-32a-Jiv90的鉴定重组原核表达载体pET-32a-Jv90经限制性内切酶EcoRⅠ、HindⅢ双酶切鉴定结果如下,切出了5 900 bp和693 bp的片段,与预期大小相符。将酶切鉴定正确的阳性菌株送至南京金斯瑞生物科技公司测序。结果表明,序列完全正确,无突变,无缺失。
2.3 不同浓度PTG对JIV90蛋白的诱导表达分析
加入 IPTG 至终浓度分别为 1.0、0.75、0.5、0.25 mmol/L,37℃诱导表达4 h收菌,然后进行SDS-PA GE分析。可见基因工程菌诱导0.25 mmol/L后目的蛋白的表达量达高峰(图3)。
2.4 不同时间对Jiv90蛋白的诱导表达分析
加入IPTG至终浓度0.25 mmol/L,37℃诱导表达 2、3、4、5、6、7 h 后收获细菌,然后进行SDSPA GE分析发现基因工程菌诱导7 h后目的蛋白的表达量达高峰。
2.5 Jiv90蛋白的可溶性分析
重组质粒经IPTG诱导后分别收集上清和沉淀,经SDS-PA GE检测,融和蛋白主要以上清形式存在(图4)。
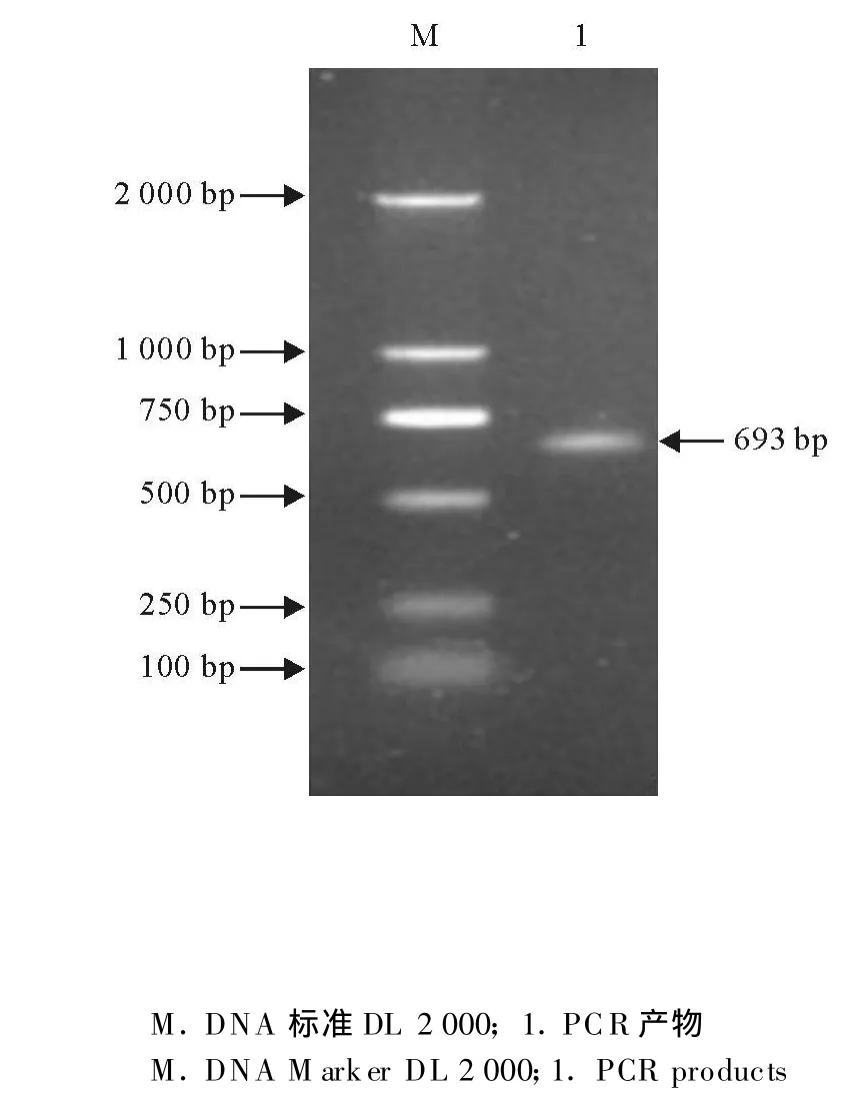
图1 Jiv90基因PCR扩增电泳图Fig.1 Electrophoresis of PCR products for part of Jiv90
2.6 融合蛋白pET-32a-Jiv90蛋白的Western blot检测
Western blot检测结果见图5,印迹分析中在约46 ku处有一条带出现,表明原核系统表达获得Jiv90蛋白。
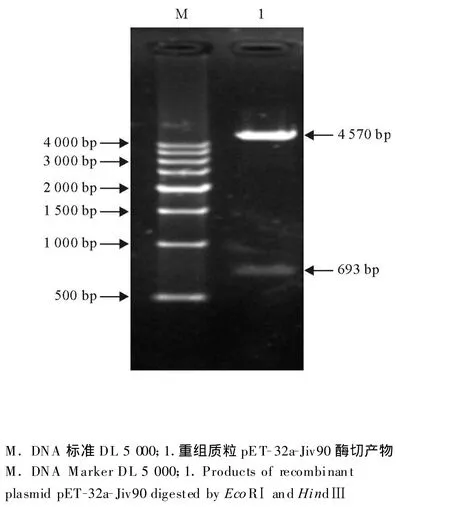
图2 重组质粒EcoR I和 HindIII双酶切鉴定Fig.2 Identification of recombinant plasmid by EcoRⅠ and HindⅢ
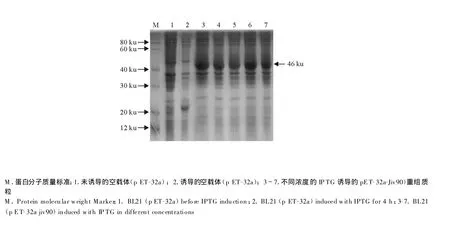
图3 SDS-PAGE检测 pET-32 a-Jiv 90的表达Fig.3 Detection of pET-32a-Jiv 90 ex pression by SDS-PAGE
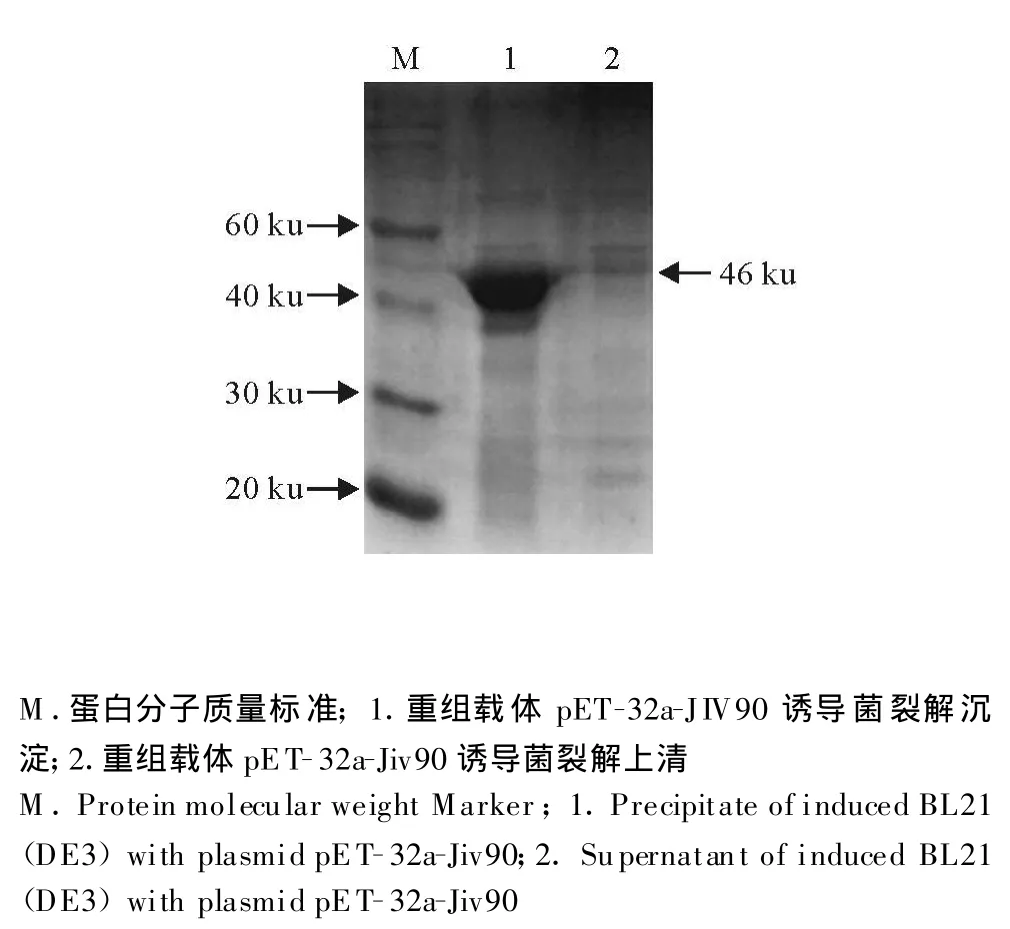
图4 Jiv90蛋白的可溶性分析Fig.4 Solubility analysis of Jiv90 protein
3 讨论
细胞内蛋白质的折叠是一个复杂、易于出错的过程。病毒是细胞内寄生物,在其增殖过程中,伴随着大量病毒蛋白的折叠、装配和定向分配等修饰过程,尽管许多病毒蛋白具有复杂的三级、四级结构,但是它们仍能在宿主细胞中迅速有效地折叠、装配成适合的构象。人们发现分子伴侣在病毒的不同生活周期中如病毒的感染、病毒基因组的复制、基因的表达、病毒糖蛋白的折叠与成熟、病毒粒子的装配等过程中起着非常重要的作用。许多真核、原核宿主的病毒可直接利用宿主细胞中的伴侣分子,或借助宿主细胞编码病毒的伴侣分子以及一些功能蛋白,以完成病毒增殖的许多相关过程。
Jiv90蛋白已经证明与CSFV的复制有关,而现有的研究都集中在Jiv90蛋白与病毒的相互作用上,而对该蛋白的研究较少,为了进一步能够研究Jiv90蛋白的功能,例如,机体是怎样调节Jiv90的量与NS2相互作用来调节病毒的复制与病毒的量,Jiv90蛋白是通过什么途径降解的?Jiv90蛋白的拓扑异构学如何?能否引起内质网应急效应?对Jiv90的量影响病毒的复制,接毒后病毒是否影响Jiv90的表达?Jiv90蛋白是否对细胞周期和凋亡有影响?这些问题的解决均需要Jiv90的单克隆抗体,而市场上没有商品化的抗体,然而原核表达是制备抗体的必须阶段。只有对原核表达情况进行了解后才能为制备抗体奠定基础。在试验过程中发现Jiv90蛋白对一般的BL21感受态菌体有毒性不能够表达Jiv90,最后用BL21(DE3)pLys这种感受态菌体才能诱导Jiv90蛋白表达,通过Western blot证明表达的蛋白为目的蛋白,并且诱导的Jiv90蛋白以包涵体形式存在。
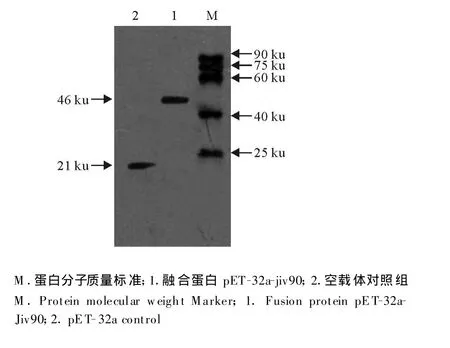
图5 pET-32a-Jiv90重组蛋白 Western blot检测Fig.5 Western blot detection of fusion protein pET-32a-Jiv90
[1]Hartl F U.Molecular chaperones in cellular protein folding[J].Nature,1996,381(6583):571-579.
[2]刘菲,程安春,曾智勇.分子伴侣在病毒感染中的作用[J].中国兽医学报,2005(1):106-110.
[3]M olecular chaperones in pathogen virulence:emerging new targets fo r therapy[J].Cell Host Microbe,2008,4(6):519-527.
[4]Ziga S,Sola I,Cruz J L,et al.Role of RNA chaperones in virus replication[J].Virus Res,2009,139(2):253-266.
[5]Tatu U,Helenius A.Interactions between newly synthesized glycol proteins,calnexin and a network of resident chaperones in the endoplasmic reticulum[J].J Cell Biol,1997,136(3):555-565.
[6]Behrens S E,Grassmann C W,Thiel H J,et al.Characterization of an autonomous subgenomic pestivirus RNA replicon[J].J Virol,1998,72:2364-2372.
[7]Meyers G,Rümenapf T,T hiel H J.Ubiquitin in a togavirus[J].Nature,1989,341:491.
[8]Lackner T,Thiel H J,T autz N.Dissection of a viral autoprotease elucidates a function of a cellular chaperone in proteolysis[J].Proc Natl Acad Sci U S A,2006,103:1510-1515.
[9]Gallei A,Blome S,Gilgenbach S,et al.Cy topathogenicity of classical swine fever virus correlates with attenuation in the natural host[J].J Virol,2008,82:9717-9729.
Cloning and Prokaryotic Expression of Molecular Chaperone Jiv90 Gene from Swine Umbilical Vein Endothelial Cells
YANG You-cong,GUO Kang-kang,ZHANG Yan-ming,LI Yu-li,ZHANG Qian,CHENG Yuan-yuan,ZHANG San-dong,PENG Wei-gang
(Colleage of Veterinary Medicine,Northwest A&F University,Yangling,Shaanxi712100,China)
The research studied the cloning and expression of Jiv90 gene.693 bp of Jiv90 gene from swine vein endothelia cell was amplified by PCR,and cloned into prokaryotic expression vector pET-32a,and expressed inE.coliBL21(DE3).The target protein was expressed inE.coliBL21(DE3)induced with IPTG,and detected by SDS-PAGE and Western blot.The results indicated that the 46 ku expressed protein could be recognized by mouse antiHis-tag antibody.The results laid the foundation for studies on the protein function and the preparation of antibodies.
pET-32a;Jiv90 gene;prokaryotic expression
S852.21;Q786
A
1007-5038(2011)07-0009-05
2011-05-18
国家转基因生物新品种培育重大专项—抗病转基因新品种培育(2009ZX08006-006B);陕西省“13115”科技创新工程重大科技专项—猪瘟病毒致病机理与抗病育种研究(2009ZDKG-23)
杨幼聪(1984-),男,河北邢台人,硕士研究生,主要从事分子病原学与免疫学研究。*通讯作者

