四个绵羊品种MHC-DQA1基因exonⅡ多态性分析*
李 敏,任艳玲,肖 娜,董文艳,沈志强,*
(1.山东绿都生物科技有限公司,山东滨州 256600;2.山东滨州畜牧兽医研究院,山东滨州 256600;3.山东省洼地绵羊繁育技术研究推广中心,山东滨州 256600)
四个绵羊品种MHC-DQA1基因exonⅡ多态性分析*
李 敏1,任艳玲2,3,肖 娜1,董文艳1,沈志强1,2,3*
(1.山东绿都生物科技有限公司,山东滨州 256600;2.山东滨州畜牧兽医研究院,山东滨州 256600;3.山东省洼地绵羊繁育技术研究推广中心,山东滨州 256600)
为了比较和揭示洼地绵羊、杜泊羊、小尾寒羊及特克赛尔绵羊4个绵羊品种MHC-DQA1基因的遗传多态性,采用PCR-RFLP技术对4个绵羊品种224个样本的MHC-DQA1基因exonⅡ的315 bp片段进行多态性分析;并对基因型频率和等位基因频率进行统计,运用Popgen32软件计算相应的遗传参数。结果表明,AluI-RELP检测的4个绵羊品种224只群体中,出现3种基因型MM 、MN、NN,其中N为优势等位基因,且MM基因型只分布于洼地绵羊中。遗传参数分析表明,除小尾寒羊外,洼地绵羊、杜泊羊及特克赛尔羊AluI-RELP位点杂合度均高于纯合度;且洼地绵羊表现中度多态,其他绵羊品种表现低度多态。4个绵羊品种224只群体MHC-DQA1基因exonⅡ在AluI-RELP位点具有较低的遗传多样性。
洼地绵羊;杜泊羊;小尾寒羊;特克赛尔;MHC-DQA1;PCR-RFLP;遗传多态性
绵羊的MHC称为OLA(ovine lymphocyte antigen),位于绵羊第20号染色体上,其Ⅱ区与人类相似,区域内的DR和DQ两个基因家族表现丰富的多态性[4]。绵羊的多态性更集中在DQ家族[6-7],DQ基因家族有两个 DQA基因座,即 DQA1和DQA 2基因[5],具有多态性。绵羊MHC基因数目和分型研究还不完全,并且该基因座位上的新等位基因数也在不断增加。根据已有的资料Snibson[8]和Zhou等[9]揭示了9个DQA1和10个DQA2序列信息;Hickford J G等[10]利用PCR-SSCP方法检测近2 000只绵羊DQA2基因exonⅡ遗传多态性,将DQA2等位基因由10个增加至23个。牛和绵羊DQA和DRB的研究结果进一步证实,其第2外显子存在着高度多态性。因此对世界优良绵羊品种DQA基因进行深入比较分析,将更有助于绵羊抗病育种工作的开展和优良绵羊品种的合理开发与利用。本试验采用PCR-RFLP技术,对4个绵羊品种MHCⅡ类DQ区DQA1基因的多态性进行了初步分析,旨在为绵羊的抗病育种研究提供初步的理论基础。
1 材料与方法
1.1 材料
1.1.1 试验用动物 洼地绵羊(100只),杜泊羊(50只),小尾寒羊(50),特克赛尔绵羊(24只),颈静脉采血,ACD抗凝,-20℃冻存。
1.1.2 主要试剂 限制性内切酶AluI购于宝生物工程(大连)有限公司,全血 DNA提取试剂盒(T akara,Code D9081)。其余试剂均为进口或国产分析纯。
1.2 方法
1.2.1 基因组DNA的提取 全血DNA提取试剂盒从冻存血样中提取基因组DNA,置-20℃冻存。
1.2.2 引物设计和PCR扩增
1.2.2.1 引物设计 引物设计参考文献。参照GenBank中公布的绵羊 OLA-DQA1序列,应用Primer 5.0软件设计引物如下:
P1:CCGT TTCACATCTGTGCTGTT
P2:CCCAGTGT TTCAGAAGTGGC
扩增片段长度315 bp。
改革开放40年,随着美剧、韩流、日本动漫等外来文化流入,中国文化价值观正发生深刻变化。广大青年推崇的西方自由主义和传统的孝廉文化观念在很多方面发生冲突。178年前大英帝国用一场鸦片战争撬开了中国大门。今天,中国传统价值观更是受到西方价值观的猛烈冲击。中国优秀传统文化如何传承发展成为亟待解决的一个时代命题。
1.2.2.2 PCR扩增 PCR反应体系:10×PCR buffer 2.5 μ L,dNTP 1.5 μ L,上下游引物各 1 μ L,TaqDNA 聚合酶 0.5 μ L,模板 DNA 1 μ L,补 H2O至总体积25 μ L;PCR反应条件:95℃5 min,95℃30 s,54℃30 s,72℃30 s,30个循环;72℃10 min,4℃保存。PCR产物用15 g/L琼脂糖凝胶电泳检测。
1.2.3 PCR产物酶切 分别采用AluI限制性内切酶分析PCR扩增产物。酶切体系为:PCR产物8 μ L,AluⅠ 0.5 μ L,10 ×L buffer 1.5 μ L,补水至15 μ L;37℃,4 h。30 g/L琼脂糖凝胶电泳检测。
1.2.4 统计分析 利用POPGEN(Version1.32)计算分析酶切基因型及其等位基因频率、杂合度(He)、平均杂合度观测值(Ho)、多态信息含量(PIC)等相关遗传参数。

图1 4个种绵羊基因组Fig.1 Genomies of four sheep
2 结果
2.1 4个绵羊品种全血基因组DNA的提取
全血基因组试剂盒提取的DNA经8 g/L琼脂糖凝胶电泳检测(图1),结果显示所提取的DNA质量较好,可以作为后续研究的模板。
2.2 4种绵羊MHC-DQA1基因PCR扩增
根据所设计的引物对绵羊基因组进行PCR扩增,均得到一条315 bp的条带(图2)。由图2可见PCR扩增产物的片段大小与预期大小一致,条带清晰,特异性强,适合做 PCR-RELP分析。
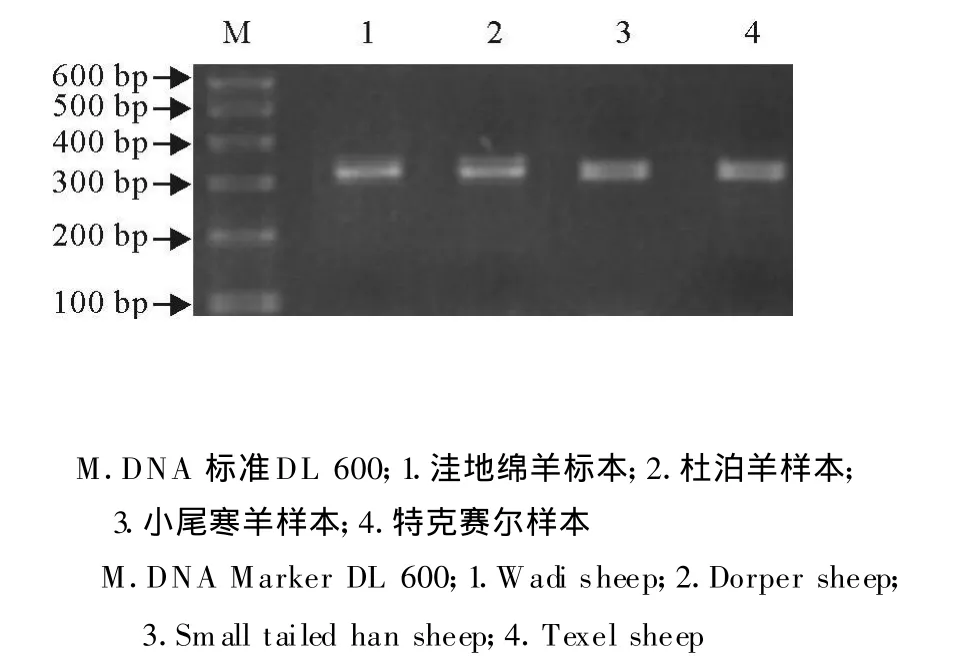
图2 四种绵羊MHC-DQA1基因PCR产物Fig.2 PCR products of MHC-DQA1 gene in four sheep
2.3 MHC-DQA1基因PCR-RELP多态性分析
对洼地绵羊、杜泊羊、小尾寒羊及特克赛尔羊等4个绵羊品种MHC-DQA1基因进行AluI-RELP,结果发现,所检测的224只绵羊群体MHC-DQA1基因具有多态性,有M、N两种等位基因,出现MM(315 bp)、MN(315bp/196 bp/119 bp)、NN(196 bp/119 bp)3种基因型,其中洼地绵羊MHC-DQA1基因进行AluI-RELP(图3);杜泊羊MHC-DQA1基因进行AluI-RELP(图 4);小尾寒羊MHC-DQA1基因进行AluI-RELP(图 5);特克赛尔羊 MHCDQA1基因进行AluI-RELP(图6)。
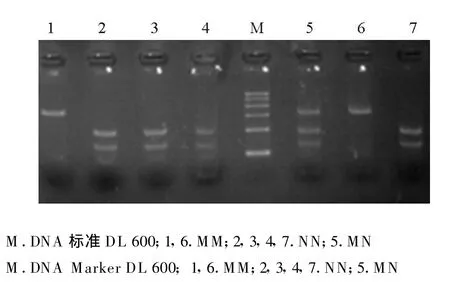
图3 洼地绵羊HMC-DQA1基因AluⅠ酶切电泳图谱Fig.3 Electrophoretic patterns of HMC-DQA1 gene products digested with AluⅠin Wadi sheep
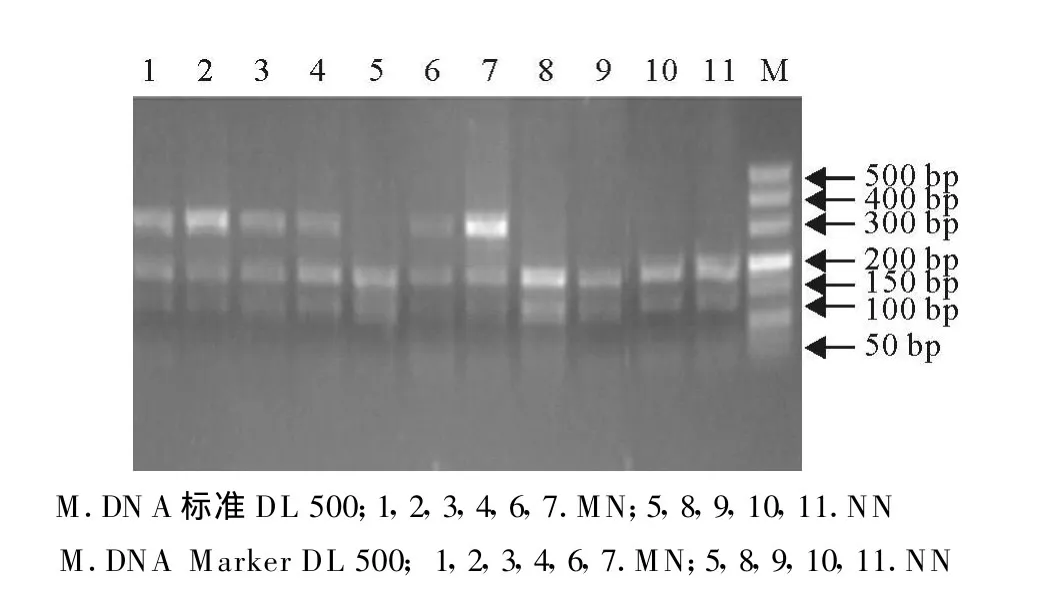
图4 杜泊羊HMC-DQA1基因AluⅠ酶切电泳图谱Fig.4 Electropho retic patterns of MHC-DQA1 gene products digested with AluⅠin Dorper sheep
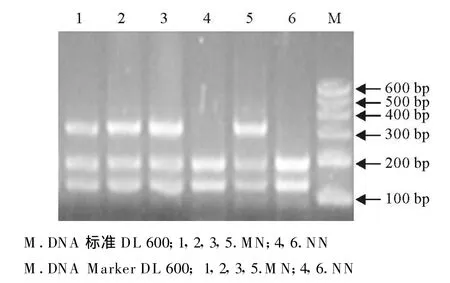
图5 小尾寒羊HMC-DQA1基因AluⅠ酶切电泳图谱Fig.5 Electrophoretic patterns of HMC-DQA1 gene products digested with AluⅠin small tailed han sheep
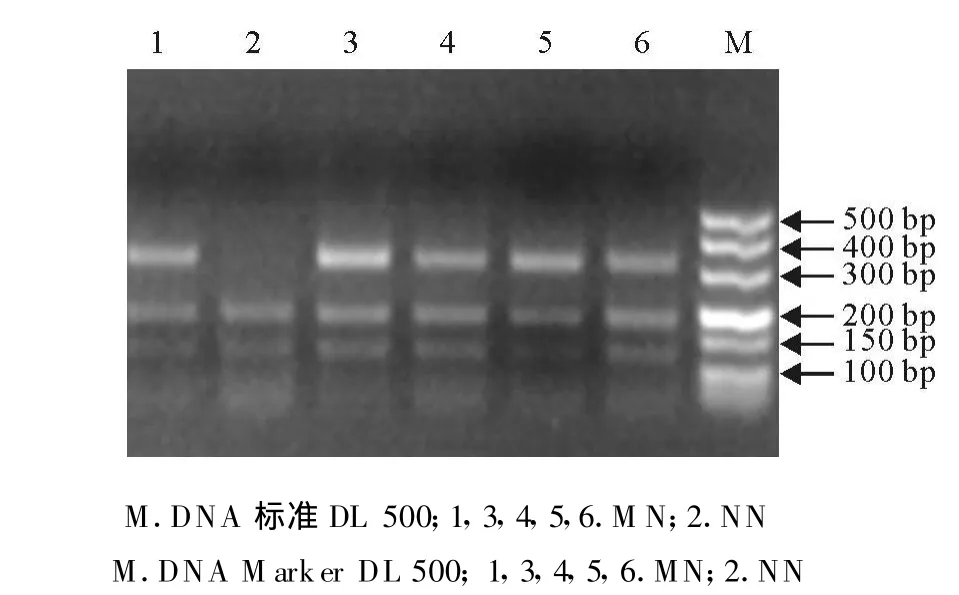
图6 特克赛尔羊HMC-DQA1基因AluⅠ酶切电泳图谱 Fig.6 Electrophoretic patterns of HMC-DQ A1 products digested with AluⅠin texel sheep
2.4 基因型频率统计
通过对4个绵羊品种224只群体MHC-DQA1基因 exonⅡ进行 AluI-RELP检测,发现 MHCDQA1基因酶切等位基因及基因型在4个绵羊品种中的分布频率(表1),可以看出MM基因型只分布于洼地绵羊中,小尾寒羊、杜泊羊及特克赛尔羊没有该基因型存在;除小尾寒羊外,洼地绵羊、杜泊羊及特克赛尔羊AluI-RELP位点杂合度均高于纯合度,MN基因型频率分别为0.53(53)、0.70(35)、0.83(20);NN基因型频率分别是为 0.37(37)、0.30(15)、0.17(4);在4个绵羊品种中,N等位基因具有较高的基因频率(0.58~0.77,平均为0.66),说明N为优势等位基因。
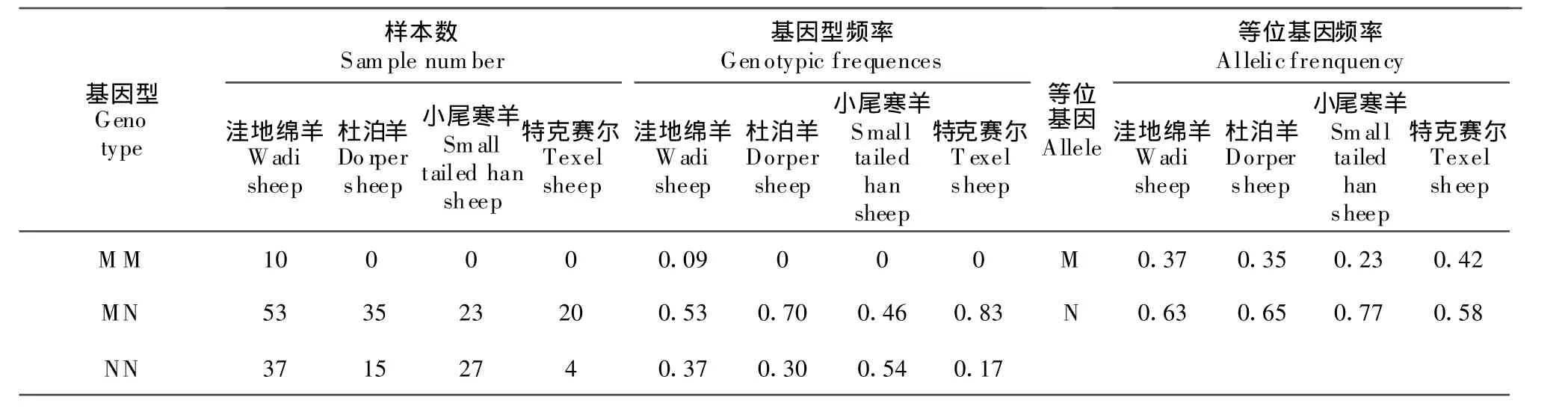
表1 M HC-DQA1基因酶切基因型在不同绵羊品种中的分布频率Table 1 Genotypic frequencies of AluⅠdigested M HC-DQA 1 gene in four sheep populations
2.5 4个绵羊品种MHC-DQA1基因遗传特性分析
由表2可知,所研究的224只绵羊中,AluⅠ-RELP位点杂合度(He)比较高,多态信息含量(PIC)均比较低。X2适合性检验结果表明,洼地绵羊MHC-DQA1基因exonⅡ在AluI酶切位点达到了Hardy-Weinberg平衡(P>0.05),但小尾寒羊、杜泊羊及特克赛尔羊未达到Hardy-Weinberg平衡(P<0.05)。
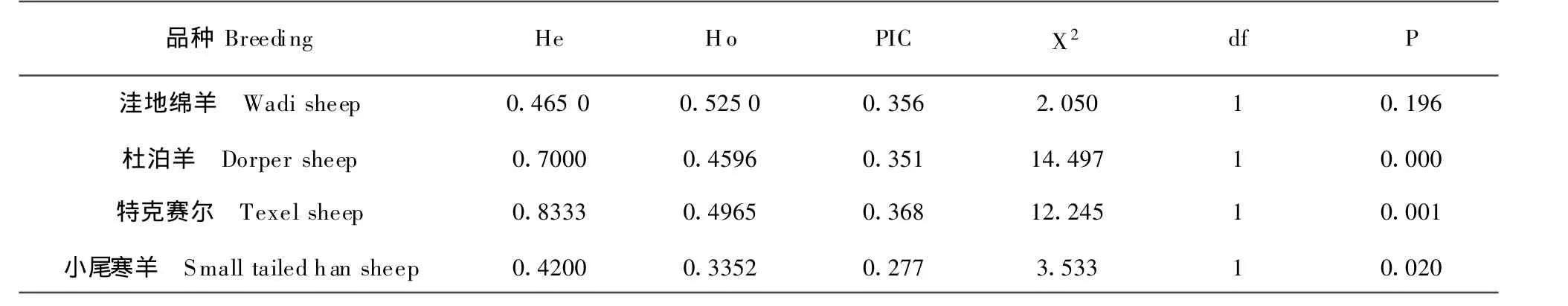
表2 四个绵羊品种MHC-DQA1基因PCR-RELP遗传参数分析Table 2 Genetic parameters of PCR-RELP of M HC-DQA 1 gene in four sheep populations
3 讨论
3.1 MHC-DQA基因作为遗传标记的可行性
绵羊的MHC称为OLA(ovine lymphocyte antigen),具有高度的多态性和连锁不平衡。根据MHC抗原结构和功能的不同,可将 MHC分为classI基因、classⅡ基因和classⅢ基因3个区域,一般认为绵羊MHC classⅡ的多态性和遗传性,是为了保护机体组织对抗疾病的感染。MHC分子分型技术主要有PCR-RFLP、PCR-SSCP、SNP和克隆测序等,目前家畜MHC-DQA的研究主要集中在牛、绵羊和猪等,牛上发现了39个DQA基因,绵羊上发现了8个DQA1基因和 16个DQA2基因,猪DQA基因也具有丰富多态性。对MHC的基因数量和分型研究还不很完全,其基因座上的新等位数目不断增加。人类、小鼠的研究结果表明,哺乳动物MHC具有高多态和多碱基突变的特点,国内外有关绵羊和山羊MHC基因的研究证明了这一特点。DQA1基因序列变异可能影响宿主对病原体的免疫应答,也可能导致物种间抗病性和疾病易感性发生变异,从而有可能作为疾病抗性和易感性研究的候选标记基因[11]。
3.2 4个绵羊品种的遗传多样性
我国及世界其他地区绵羊资源品种丰富,如本试验所用洼地绵羊、小尾寒羊、杜泊羊、特克赛尔等,都是肉毛兼用优良绵羊品种。本研究使用PCRRFLP技术,对4个绵羊品种224只群体DQA1基因第2外显子的分子遗传多态性进行了初步检测分析,AluI-RELP出现了两种等位基因 3种基因型MM 、MN、NN,统计分析表明MM 基因型只分布于洼地绵羊中,小尾寒羊、杜泊羊及特克赛尔羊没有该基因型存在;除小尾寒羊外,洼地绵羊、杜泊羊及特克赛尔羊AluⅠ-RELP位点杂合度均高于纯合度,MN基因型频率分别为0.53(53)、0.70(35)、0.83(20);NN基因型频率分别是为 0.37(37)、0.30(15)、0.17(4);且经x2适合性检验表明4个绵羊品种224只群体中只有洼地绵羊MHC-DQA1基因exonⅡ在AluⅠ酶切位点达到Hardy-Weinberg平衡(P>0.05),由于部分绵羊品种样本数量有限,故此分析有待于进一步扩大样本数量进行印证。4个绵羊品种AluI-RELP位点上呈低度多态,说明该位点在长期的选择过程中所受的选择压力较小。MHC基因是否和绵羊对疾病的易感性和抗病力相关,还需要收集详细的疾病记录并与基因的基因型进行相关分析,开展对洼地绵羊、小尾寒羊、杜泊羊及特克赛尔羊MHC-DQA1的研究,为这些分析提供了初步的理论基础,有助于揭示不同绵羊品种的抗病机理,在绵羊抗病育种等领域具有重要的参考价值。
[1]魏丽君,石国庆,王晓申.4个绵羊品种MHC-DRB3基因外显子2的多态性分析[J].中国畜牧兽医,2007,34(7):63-66.
[2]李俊营,陈 宏,蓝贤勇.5个山羊品种 GoLA-DQA1基因的多态性分析[J].西北农林科技大学学报:自然科学版,2008,36(1):33-37.
[3]刘 秀,胡 江,罗玉柱.藏绵羊基因OLA-DQA2第 2外显子多态性分析[J].中国农业科学,2009,42(8):2930-2936.
[4]Hickford J G,Zhou H,Fang Q.Haplotype analysis of the DQA genes in sheep evidence suppo rting recombination between the loci[J].Am Soc of Anim Sci,2007,85:577-582.
[5]Scotton P C,Gogolin-Ewens K J,Adams T E.Nucleotide sequence,polymorphism,and evolution of ovine MHC class II DQ A genes[J].Immunogentics,1991,34:69-79.
[6]Ly nn M,Lowell S,Donald P.Genomic analy sis ofOvis aries(Ovar)M HC class IIa loci[J].Immunogenetics,2008,60:167-176.
[7]Kenter M,O tting N,Anholts J,et al.Evolutionary relationships among the primate M HC-DQA1 and DQA2 alleles[J].Immunogenetics,1992,36:71-78.
[8]Snibson K J,M addox J F,Fabb S A,et al.Allelic variation of ovine MHC class II DQA1 and DQA2 genes[J].Animal Genetics,1998,29:356-362.
[9]Zhou H,Hickford J G.Allelic polymorphism in the ovine DQ A1 gene[J].Am Soc of Anim Sci,2004,82:8-16.
[10]Hickford J G,Zhou H,Slow S,et al.Diversity of the ovine DQA2 gene[J].American Society of Animal Science,2004,82:1553-1563.
[11]郭秀丽,代红星,李祥龙.不同物种MHC-DQA1基因部分序列的生物信息分析[J].中国畜牧兽医,2007,34(1):65-67.
Polymorphisms of MHC-DQA1 Gene exonⅡin Four Sheep Breeds
LI Min1,REN Yan-ling2,3,XIAO Na1,DONG Wen-yan1,SHEN Zhi-qiang1,2,3
(1.Shandong Lvdu Biotechnology Ltd.Binzhou,Shandong,256600,China;2.Shandong Binzhou Anmimal Science&Veterinary Medicine Institute,Binzhou,Shandong,256600,China;3.Research and Development Center of Wadi Sheep Breeding Technology,Binzhou,Shandong,256600,China)
The polymorphisms of MHC-DQA 1 gene exonⅡin four sheep breeds(Wadi sheep,Dorper sheeps,small tailed han sheeps and exel sheep)were analyzed.PCR-RFLP method was used to study the genetic polymorphisms of 315 bp MHC-DQA 1 gene exonⅡin 224 samples of four sheep breeds,then the genotypic frequences and allelic frenquency were analyzed.Software Popgen32 was employed to calculate the relative genetic parameters.The results ofAluI-RELP showed that there are two allele M and N atAluⅠ-RFLP locus in 224 samples of four sheep breeds,and by comparing with the allelic frequency,the predominant allele is N;The results of genetic parameters showed that except for small tailed han sheep,the heterozygosity are higher than homogeneity atAluⅠ-RFLP locus in other three sheep breeds;and the results of genetic parameters showed that there were low polymorphism in exon 2 of MHC-DQA1 gene in Dorper sheep,small tailed han sheep and Texel sheep,while it was moderate polymorphism in Wadi sheep.There were low genetic diversities in exonⅡ of MHC-DQA1 gene atAluⅠ-RFLP locus in 224 samples of four Sheep breeds.
Wadi sheep;Dorper sheep;small tailed han sheep;Texel sheep;MHC-DQA1;PCR-RFLP;genetic polymorphism
Q789
A
1007-5038(2011)07-0029-04
2010-12-31
国家高技术研究发展计划(863计划)项目(2008AA10Z142);山东省自然科学基金项目(Y2007D12);山东省良种工程项目(2006GG2209028)
李 敏(1982-),女,内蒙古兴安盟人,硕士研究生,主要从事生物化学与分子生物学研究。*通讯作者

