mB7-1修饰的B16细胞体外诱导免疫效应
金洪娟 王 权 所 剑
(吉林大学第一医院,吉林 长春 130021)
机体抗肿瘤免疫应答主要效应细胞为T细胞,其活化需要抗原信号和协同共刺激信号双信号的作用,共刺激信号的缺乏将导致T细胞不能活化或凋亡。B7-1是最主要的共刺激分子之一,而大多数肿瘤细胞均不表达或低表达B7分子,这正是肿瘤免疫逃避的机制之一。因此将共刺激分子B7-1基因导入肿瘤细胞可增强其免疫原性,诱导宿主有效的抗肿瘤免疫效应。本实验主要目的是在体外建立稳定表达mB7-1的细胞系,为其进一步抗瘤研究奠定基础。
1 材料与方法
1.1 实验动物与材料 动物:BALB/c小鼠,购于吉林大学白求恩医学部基础医学院实验动物部。试剂与设备:IMDM培养基,反转录酶,TRIzol试剂,Oligo(dT),DEPC,均购自美国 GIBCO公司;10%小牛血清购自华美生物公司;EcoRⅠ和XhoⅠ内切酶购自Bochring Mannheim;pcDNA3质粒购自Invitrogen公司;淋巴细胞分离液购自上海华精生物技术有限公司;MTT购自美国Sigma公司。
1.2 重组载体的构建
1.2.1 mB7-1引物的设计与合成 参考GenBank报道序列自行设计mB7-1基因引物序列。B7-1基因引物序列:扩增片断为940 bp,上游及下游分别引入EcoRⅠ和XhoⅠ两个多克隆酶切位点和起始信号ATG、终止信号TAG,上游P1:5'-AGCTGAATTCATGGCTTGCA-3';下游 P2:5'-AGCTCTCGAGCTAAAGGAAG-3'。由宝生物生物工程公司合成。
1.2.2 mB7-1目的基因的获得 采用TRIzol试剂法提取BALB/c纯系小鼠mRNA,合成为cDNA。应用引物P1及P2进行 RT-PCR,反应体系如下:小鼠cDNA 1 μl,引物 各1 μl,dNTP 4 μl,rTaq 酶0.5 μl,10 × Buffer 5 μl,甘油2.5 μl,石蜡25 μl,双蒸水10 μl。循环参数:94℃变性1 min,55℃退火 30 s,72℃延伸1 min,以上反应条件进行30个循环。回收PCR产物及pcDNA3质粒双酶切(EcoRⅠ和XhoⅠ)后进行连接反应。连接产物经体外扩增后酶切鉴定并送交生物技术公司进行全长基因序列测定。
1.3 mB7-1转染B16细胞 取冻存B16细胞进行复苏与传代培养,鉴定后质粒应用脂质体法进行转染。48~72 h后更换培养基进行筛选,培养6~8 w,获得稳定转染细胞株。收集筛选阳性细胞株,提取细胞总RNA,以前述引物1、2进行RT-PCR,检测基因水平表达,mB7-1 PCR产物作为阳性对照。
1.4 体外杀伤效应的检测 B16、转染后mB7-1-pcDNA3-B16及pcDNA3-B16肿瘤细胞(1×105ml/L)各1 ml加入丝裂霉素 C 30 ng/ml,37℃、5%CO2孵箱中孵育45 min,洗涤后制备成细胞悬液,培养 36 h。收集淋巴细胞,调细胞浓度至5×106ml/L;以前述3组细胞为靶细胞,效价比为10∶1,混合培养16 h后加入MTT试剂10μl/孔孵育8 h。离板后弃上清,加入DMSO 100μl/孔,酶联免疫检测吸光度(A)。抑制率计算:抑制率=〔1-(实验孔A值-效应细胞对照孔A值)/靶细胞对照孔A值〕×100%。
1.5 统计学分析 采用t检验。
2 结果
2.1 载体构建 连接产物经EcoR I和Xho I双酶切反应后,酶切产物电泳可见两条亮带,小片段约1 000 bp大小,大片段位于5 000 bp左右,总和约6 000 bp,符合预测结果(见图1)。生物公司测序结果经软件与GenBank报告mB7-1基因序列对比分析后显示所得目的基因序列与已报道序列一致。
2.2 mB7-1转染B16细胞基因表达 转染mB7-1-pcDNA3后肿瘤细胞组逆转录PCR产物电泳可见特异性条带,大小与阳性对照mB7-1基因片段大小一致,转染pcDNA3肿瘤细胞组及空白对照组未见特异性条带产生(见图2)。
2.3 杀伤活性检测 各组细胞均诱导产生杀伤效应,而与对照组〔B16组(36.20±1.3)%,B16-pcDNA3组(40.12±1.1)%〕比较,转染mB7-1-pcDNA3后肿瘤细胞组的杀伤活性〔(76.09±1.5)%〕显著高于其他两组(P<0.05)。
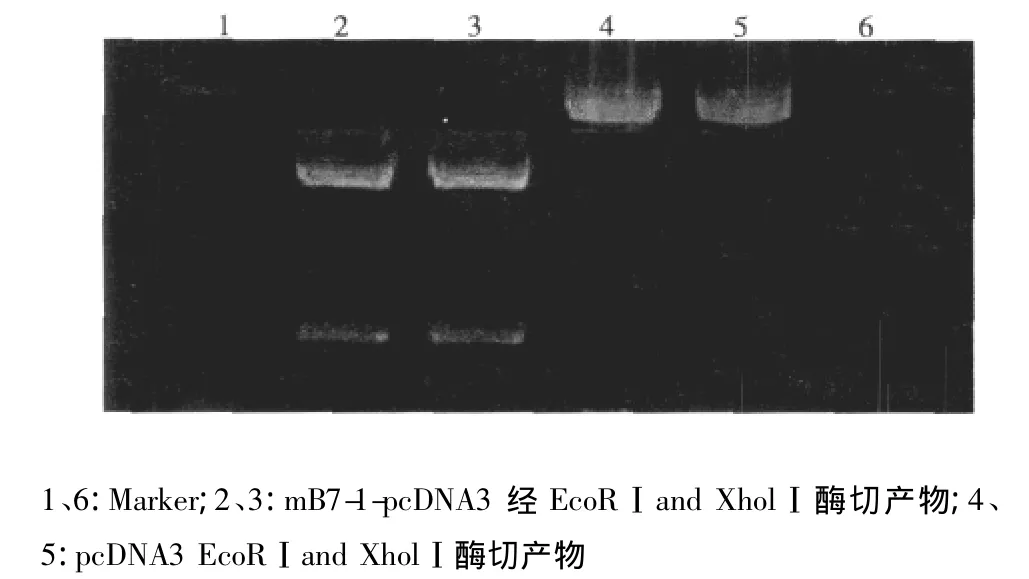
图1 mB7-1-pcDNA3酶切鉴定结果

图2 mB7-1基因瞬时表达
3 讨论
免疫学研究关于免疫效应细胞的双信号学说认为T细胞活化与增殖依赖于双信号,一是抗原递呈细胞(APC)呈递的抗原肽——人类白细胞抗原(HLA)复合物,由特殊T细胞抗原受体(TCR)识别,并将信号传递给T细胞;此信号对T细胞活化是必需的,但不引起T细胞增生和分泌细胞因子。二是共刺激信号(第二信号),共刺激信号为T细胞抗原特异性激活所必需,决定了T细胞是活化增殖、抑或转变为无反应状态甚至凋亡〔1〕。B7-1分子存在于活化的B细胞、T细胞、树突状细胞及IFN-γ活化的单核细胞表面,其受体为CD28/CTLA4,表达于T细胞表面〔2,3〕。CD28与 B7-1结合,启动协同刺激信号,在提高T淋巴细胞的反应性、诱导抗凋亡基因表达、增加细胞因子的分泌(尤其是IL-2)、促进T淋巴细胞与APC的结合和阻止T淋巴细胞的失能(anergy)等方面有着重要的作用,而B7-1与CTLA-4 结合则起到抑制作用〔4,5〕。Martin 等〔5〕将转 B7 基因的K1735肿瘤细胞注入未经免疫的同系小鼠,则发生急性排斥反应。将B7基因导入肿瘤细胞,提高特应性CTL的活性,达到杀伤肿瘤细胞的作用。
本实验根据双信号理论,选取共刺激分子mB7-1作为实验对象,针对绝大多数肿瘤细胞缺乏共刺激分子这一点,期望通过弥补或增强共刺激信号表达,提高肿瘤的免疫原性,从而诱导或增强CTL(特异性细胞)对肿瘤细胞的免疫识别和杀伤作用。本实验应用基因体外合成技术获得目的基因片段mB7-1,于体外构建重组mB7-1-pcDNA3真核表达载体,经酶切电泳鉴定获得大小约1 000 bp片段,经测序后证实与GenBank中mB7-1序列一致。此后采用脂质体介导的方法转染小鼠B16肿瘤细胞,经筛选获得稳定转染细胞株,应用RT-PCR方法获取的基因产物与鉴定后的mB7-1目的基因片段大小一致,而空白对照组无对应产物出现,从而在基因水平证实了该细胞系存在mB7-1的表达。将该靶细胞与效应细胞共混培养后,可发现诱导淋巴细胞活化,产生了有效的杀伤作用,并且mB7-1阳性组明显高于其他两组。实验结果表明转染B7共刺激分子后可增强肿瘤细胞的免疫原性,增强体外抑瘤效应,也验证上述双信号学说,表明B7共刺激分子可作为肿瘤基因治疗的靶点,为下一步的抗瘤研究奠定了良好的基础。
1 Bugeon L,Dallman MJ.Co-stimulation of T cells〔J〕.Am J Respir Crit Care Med,2000;162(1):164-8.
2 Collins M,Carreno BM.The B7 family of ligands and its receptors:new pathways for costimulation and inhibition of immune responses〔J〕.Ann Rev Immunol,2002;20(1):29-53.
3 Judith L,Katharina GP,Peter S.Receptor and ligands implicated human T cell costimulatory process〔J〕.Immunol Lett,2010;128(2):89-97.
4 Shi T,Kennedy G,Gorski K,et al.Cooperative B7-1/2(CD80/CD86)and B7-DCcostimulation of CD4+T cells independent of the PD-1 receptor〔J〕.JExp Med,2003;198(1):31-8.
5 Manish JB,Victor PC,Gordon JF,et al.Interaction of human PD-L1 and B7-1〔J〕.Mol Immunol,2008;45(13):3567-72.

