钝化NF-κB的活化对哮喘大鼠肺组织MIF及血清IL-4的影响
朱惠源,薛永志,闫少峰
(1.包头医学院药理学教研室,内蒙古 包头 014060,2.包头市中心医院呼吸内科,内蒙古包头 014040)
支气管哮喘是一种炎性气道高反应性疾病,其发病机制至今仍未完全阐明,可能与多种炎性细胞、炎症介质和以Th2型淋巴因子为主的细胞因子网络参与的慢性变应性炎症反应有关。以往的研究表明[1-3],巨噬细胞移动抑制因子(MIF)和 NF-κB 均参与了哮喘的疾病进程。而IL-4是哮喘炎症反应中Th2淋巴细胞分泌,促进IgE介导的免疫应答反应,还能促进血管内皮细胞黏附分子的表达从而导致嗜酸粒细胞在炎症部位的选择性聚集,导致气道炎症[2]。柳氮磺胺吡啶(SASP)为治疗炎症性肠病的主要药物,具有抗炎抗免疫作用,并可作为NF-κB的特异性抑制剂[4-5]。本研究观察哮喘大鼠肺组织中MIF、NF-κB及血清IL-4水平变化,并使用工具药SASP钝化NF-κB的活化,探讨对MIF、IL-4和哮喘的影响,揭示其在支气管哮喘发病机制中的作用及其环节,为支气管哮喘的药物治疗提供新的靶点和研究方向。
1 材料与方法
1.1动物清洁级♀Wistar大鼠40只,体质量180~230 g,购自河南省实验动物中心,实验动物许可证号:SCXK(豫)2005-0001。
1.2主要试剂卵蛋白(OVA,Ⅱ级,Sigma公司,A5253);氢氧化铝分析纯(天津金汇太亚化学试剂有限公司);柳氮磺吡啶结肠溶胶囊(潮州市强基制药厂,批号:100505);地塞米松针剂(郑州卓峰制药有限公司,批号:08121957);兔抗大鼠 MIF、NF-κB p65多克隆抗体、SABC试剂盒、DAB显色剂、大鼠IL-4 ELISA试剂盒(武汉博士德公司)。
1.3方法
1.3.1动物分组和模型建立大鼠于动物房(环境温度20℃ ~25℃,相对湿度50% ~70%)适应饲养1周后造模。造模方法依据文献报道进行[6]。按随机数字表分为4组,每组10只。A组(哮喘模型组):大鼠于d 1腹腔注射1 ml含有OVA 100 mg和氢氧化铝100 mg的生理盐水溶液进行致敏,自d15开始,将大鼠置于密闭容器内,以1%OVA生理盐水溶液雾化吸入激发哮喘,每次30 min,每天1次,连续7 d;B组(柳氮磺胺吡啶组):以同样方法致敏和激发大鼠,并于每次激发前30 min腹腔注射SASP生理盐水溶液(250 mg×2粒溶入10 ml NS中,配制成浓度为50 g·L-1的混悬液,超声助溶,每日投药量按成人70 kg体质量与大鼠200 g体质量1∶0.018比例,给药剂量300 mg·kg-1);C组(地塞米松组):以同样方法致敏和激发大鼠,并于每次激发前30 min腹腔注射地塞米松(1 mg·kg-1);D组(空白对照组):以生理盐水代替OVA注射致敏和雾化激发,余同模型组。
1.3.2取材各组于最后一次雾化激发后24 h麻醉处死,取肺左叶置于10%中性福尔马林液中固定12 h后,常规石蜡包埋切片,以备进行常规HE染色和免疫组化实验;腹主动脉取血,室温凝固2 h后,低温离心2 000×g15 min,分离血清并冷冻于-20℃以备进行血清IL-4含量测定。
1.3.3肺组织免疫组化分析MIF及NF-κB蛋白表达的检测参照免疫组化试剂盒说明书执行,一抗稀释度均为1∶100。PBS代替一抗作为阴性对照,切片染色中出现棕黄色为阳性表达。每张大鼠切片随机选取5支中小支气管高倍视野,采用Image-Pro Plus 6.0图像分析软件,分别计算每支中小支气管阳性染色区域的平均光密度值(MOD),以所有小支气管平均光密度值的均值作为该大鼠切片的蛋白表达值[7-8]。
1.3.4ELISA方法检测血清IL-4水平按照ELISA检测试剂盒说明书操作,TMB显色剂孔为空白对照孔,大鼠血清样品直接加样,按程序添加一抗、ABC及TMB显色剂,终止显色后立即使用酶标仪读取每孔的吸光度(OD)值。通过CurveExpert 1.3软件获得标准曲线,根据标准曲线计算每只大鼠血清的IL-4浓度值。
1.4统计学处理所有数据采用±s表示,利用SPSS 13.00统计软件进行统计分析,经正态性分布及方差齐性检验后进行单因素方差分析,两两比较采用LSD-t检验。
2 结果
2.1病理学检查模型组可见各级支气管周围炎性细胞大量浸润、管腔痉挛狭窄、黏膜上皮细胞水肿、脱落,多见黏液栓,肺组织中炎性细胞浸润明显,肺泡间隔增宽;B组和C组各级支气管周围炎性细胞浸润数量明显减少,管腔痉挛狭窄减轻,黏液栓减少,肺组织炎细胞浸润减轻。正常对照组各级支气管黏膜上皮完整,未见上皮细胞水肿、脱落,管腔无痉挛狭窄,肺组织中未见明显炎性细胞浸润,肺泡间隔正常,见Fig 1。

Fig 1 Pathological changes in lung in different groups (HE strains,×200)
2.2MIF、NF-κB免疫组化结果分析A组可见深棕黄色强阳性表达,阳性区域主要位于各级支气管黏膜上皮和黏膜下层;B组和C组可见棕黄色阳性表达,主要位于各级支气管黏膜上皮和黏膜下层;D组支气管黏膜上皮和黏膜下层可见弱阳性表达。A组肺组织中 MIF、NF-κB的表达高于 D组(P<0.05);B组、C组肺组织中MIF、NF-κB的表达低于A组(P均<0.05);B组和C组之间MIF、NF-κB的表达差异无显著性(P>0.05)。对 NF-κB、MIF蛋白表达与血清IL-4水平进行相关性分析,NF-κB与MIF蛋白表达之间具有高度相关性(r=0.94,P<0.01);NF-κB蛋白表达与血清IL-4水平之间具有高度相关性(r=0.73,P<0.01);MIF蛋白表达与血清IL-4水平之间具有高度相关性(r=0.71,P<0.01)。各组肺组织MIF、NF-κB表达免疫组化检测结果如Tab 1,各组肺组织MIF、NF-κB表达免疫组化染色见 Fig 2、3。
2.3血清IL-4水平ELISA检测结果模型组血清IL-4水平高于正常对照组(P<0.05);SASP组和DXM组血清IL-4水平低于模型组(P均<0.05);SASP组和DXM组之间血清IL-4水平差异无显著性(P>0.05)。各组IL-4检测的浓度值结果如Tab 1。
Tab 1 MOD of lung tissue MIF,NF-κB p65 expression and IL-4 level in serum in each group(±s,n=10)

Tab 1 MOD of lung tissue MIF,NF-κB p65 expression and IL-4 level in serum in each group(±s,n=10)
A:Asthmatic model;B:Sulfasalazine;C:Dexamethasone;D:Control.*P<0.05 vs control;#P<0.05 vs asthma;△P<0.05 vs Asthma+DXM
Group MIF(MOD)MOD IL-4 concentration/ng·L -1 A 0.220 ±0.013* 0.171 ±0.009* 25.70 ±7.61*B 0.166 ±0.011#△ 0.137 ±0.004#△ 11.73 ±5.94#△C 0.158 ±0.008# 0.132 ±0.004# 8.49 ±3.33#D 0.097 ±0.003 0.106 ±0.006 5.98 ±4.02

Fig 2 Expression of MIF protein in lung in different groups by immunohistochemistry(immunohistochemistry strains,×200)
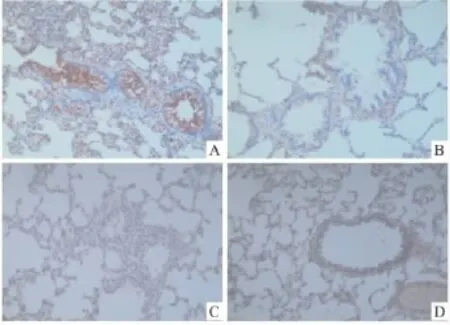
Fig 3 Expression of NF-κB protein in lung in different groups by immunohistochemistry(immunohistochemistry strains,×200)
3 讨论
大鼠哮喘模型的制备,通常的方法是采用两次致敏法(第1次致敏后1周再次OVA腹腔注射致敏1次),但我们的实验采用吴巧珍等[6]介绍的模型制备方法,仅进行1次致敏,病理结果显示,我们的大鼠哮喘模型与两次致敏模型具备同样效果,表明模型制备成功。
MIF是作用广泛的前炎症因子和促炎因子,可拮抗糖皮质激素的作用,促进多种炎性因子的表达[9]。Mizue 等[2]的研究显示,MIF-/-哮喘小鼠肺组织中IL-4、IL-5、IL-13 mRNA及其蛋白表达明显低于MIF+/+哮喘小鼠,可见MIF可上调哮喘中Th2细胞因子的表达。NF-κB作为一种重要的核转录因子,参与了多种炎症蛋白基因的转录[10]。研究表明,这两种因子均可促进Th2型细胞因子的表达,加重哮喘病程[1-3]。在我们的实验结果中显示,MIF和NF-κB在哮喘大鼠肺组织中明显表达,血清IL-4升高,与先前的研究一致。以往对MIF和NF-κB的关系研究表明[11],MIF可抑制糖皮质激素诱导的IκB的合成,从而使NF-κB转位至核内导致目的基因转录,产生相关的炎性因子;另有研究表明[12],TNF-α可通过激活NF-κB途径刺激子宫内膜间质细胞MIF的基因转录和蛋白表达,从而加重炎症反应。可见在MIF和NF-κB的关系中存在着正反馈机制,两者相互促进,进一步加重了炎症反应。因此,MIF和NF-κB或成为哮喘进程中重要的治疗靶点。
SASP具有抗菌、抗炎和免疫抑制等效应,主要用于炎症性肠病的治疗,Olmez等[13]对其在哮喘的应用中显示,SASP干预可使哮喘小鼠气道组织病理学参数获得明显改善,对基底膜厚度的改善优于地塞米松组。据以往的研究显示[4],SASP是 NF-κB的特异性抑制剂,Weber等[14]的研究进一步提示,SASP可通过直接抑制lκB激酶的活性,抑制lκB的磷酸化及其降解,从而抑制NF-κB的活化。在我们的实验中,经SASP干预后,大鼠肺组织中MIF和NF-κB的表达较模型组减轻,血清IL-4水平下降,组织病理学结果也改善,与DXM的作用差异无显著性,表明SASP抑制哮喘的机制之一有可能是通过对MIF和NF-κB的抑制作用。因此我们进一步推测,SASP可能是通过钝化NF-κB的活化,间接地抑制了MIF的基因转录和蛋白表达,减轻了MIF对糖皮质激素诱导的IκB合成的抑制作用,从而抑制了NF-κB和MIF介导的包括IL-4在内的多种Th2细胞因子的生成和活化,从而减轻哮喘的炎症反应。
目前,有关SASP对哮喘影响的研究较少,我们的实验提示,SASP对哮喘具有抑制作用,其可能是通过抑制 NF-κB、MIF而实现的。因此,对于 NF-κB、MIF等重要治疗靶点的研究,具有重要的指导意义,将为哮喘发病机制的深入研究以及临床治疗提供新的思路和方法。
[1]Kobayashi M,Nasuhara Y,Kamachi A,et al.Role of macrophage migration inhibitory factor in ovalbumin-induced airway inflammation in rats[J].J Eur Respir,2006,27(4):726 - 34.
[2]Mizue Y,Ghani S,Leng L,et al.Role for macrophage migration inhibitory factor in asthma[J].J Proc Nat Acad Sci USA,2005,102(40):14410-5.
[3]Pantano C,Ather J L,Alcorn J F,et al.Nuclear factor-κB activation in airway epithelium induces in ammation and hyperresponsiveness[J].Am J Respir Crit Care Med,2008,177(9):959 -69.
[4]Wahl C,Liptay S,Adler G,Schmid R M.Sulfasalazine:a potent and specific inhibitor of nuclear factor kappa B[J].J Clin Invest,1998,101(5):1163 -74.
[5]康晓琳,薛永志,许秀举,刘和莉.钝化NF-κB的活化对酒精性肝损伤大鼠CYP3A的影响[J].中国药理学通报,2010,26(9):1216-9.
[5]Kang X L,Xue Y Z,Xu X J,Liu H L.Blunted the increased hepatic nuclear factor-kappa B activity can influence hepatic CYP3A metabolism activity[J].Chin Pharmacol Bull,2010,26(9):1216-9.
[6]吴巧珍,殷凯生,王 祥.咪喹莫特对支气管哮喘大鼠辅助性T淋巴细胞亚群的作用[J].中华结核和呼吸杂志,2004,27(5):355-7.
[6]Wu Q Z,Yin K S,Wang X.Role of Imiquimod on T helper lymphocyte subsets in asthmatic rats[J].J Chin J Tubercul Resp Dis,2004,27(5):355 -7.
[7]齐金萍,王巧玲,金 韵,胡 颖.地塞米松抑制哮喘小鼠SH2-B蛋白表达[J].中国药理学通报,2008,24(11):1501-4.
[7]Qi J P,Wang Q L,Jin Y,Hu Y.The inhibitory effect of dexamethasone on the expression of SH2-B protein in a murine model of asthma[J].Chin Pharmacol Bull,2008,24(11):1501 -4.
[8]张宝辉,朱小兵,刘晓湘,方秀斌.Akt/PKB对哮喘小鼠Fas表达的调节作用[J].中国药理学通报,2010,26(9):1158 -61.
[8]Zhang B H,Zhu X B,Liu X X,Fang X B.Regulation of Akt/PKB to Fas expression in a murine model of asthma[J].Chin Pharmacol Bull,2010,26(9):1158 -61.
[9]Donn R P,Ray D W.Macrophage migration inhibitory factor:molecular,cellular and genetic aspects of a key neuroendocrine molecule[J].J Endocrinol,2004,182(1):1 -9.
[10]Tak P P,Firestein G S.NF-kappaB:a key role in inflammatory diseases[J].J Clin Invest,2001,107(1):7 -11.
[11]Baugh J A ,Donnelly S C.Macrophage migration inhibitory factor:a neuroendocrine modulator of chronic in ammation[J].J Endocrinology,2003,179(1):15 -23.
[12]Cao W G,Morin M,Sengers V,et al.Tumour necrosis factor-alpha up-regulates macrophage migration inhibitory factor expression in endometrial stromal cells via the nuclear transcription factor NF-kappaB[J].Hum Reprod,2006,21(2):421 -8.
[13]Olmez D,Babayigit A,Uzuner N,et al.Efficacy of sulphasalazine on lung histopathology in a murine model of chronic asthma[J].Exp Lung Res,2008,34(8):501 -11.
[14]Weber C K,Liptay S,Wirth T,et al.Suppression of NF-kappaB activity by sulfasalazine is mediated by direct inhibition of IkappaB kinases alpha and beta[J].J Gastroenterology,2000,119(5)1209-18.

