吡格列酮对HepG2细胞增殖和凋亡的影响及机制研究
伍仕敏,艾洪武,熊 焰,韩晓群,周 虹,章 敏,杨华芬,殷继东,刘永学
(1.武汉市医疗救治中心检验科,湖北武汉 430032;2.武汉市妇女儿童医疗保健中心检验科,湖北 武汉 430016;3.北京军事医学科学院放射与辐射研究所药理毒理室,北京 100850)
吡格列酮(pioglitazone)属于噻唑烷二酮(thiazolidinedione,TZD)类胰岛素增敏剂,在临床上主要用于治疗Ⅱ型糖尿病。Takeda等1975年首先发现TZD类药物的前体,该前体经过修饰改构后1982年吡格列酮首次被合成,随后罗格列酮(rosiglitazone)、曲格列酮(troglitazone)等TZD类药物亦相继得以合成[1]。尽管当时TZD类药物已用于Ⅱ型糖尿病的治疗,但其靶点并不明确。直到20世纪90年代中期过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)被发现之后,才确定其靶点为PPARs。继而发现其主要作用于PPARs的γ亚型,并被确认为 PPARγ的特异性外源配基[2]。
PPARγ属于核受体超家族成员,与其配基结合后被激活,然后与9-顺式维甲酸类受体(retinoid X receptor,RXR)形成异源二聚体,特异性结合于靶基因的启动子上游的过氧化物酶体增殖物反应元件(peroxisome proliferators response element,PPRE),从而调节靶基因的转录表达[3-4],这是经典的 PPARγ依赖途径的作用方式。PPARs也可以通过蛋白-蛋白间相互作用、竞争性结合辅因子等方式影响某些基因调控分子如核因子-κB(nuclear factor-κB,NF-κB)、激活蛋白-1(activating protein-1,AP-1)、信号转导子和转录激活子(signal transducer and activator of transcription,STAT)、CAAT 盒/增 强子 结合 蛋 白(CAAT box/enhancer binding protein,C/EBP)等的信号传导途径实现其调节基因转录的作用[5-7]。近来,许多研究亦表明 PPARγ配基还可以通过PPARγ 非 依 赖 途 径 发 挥 其 生 物 学 作 用[8-11]。PPARγ主要表达于脂肪组织,其它如心脏、骨骼肌、肝脏及肾脏等组织中亦有低水平表达[12]。早年的研究发现[13],PPARγ在糖代谢、脂代谢及能量调节中有重要作用。随着研究的深入和拓展,已有证据表明[8-11,14-16]PPARγ 还介入了多种炎症、心血管以及神经系统疾病的发生发展,甚至与肿瘤也难脱干系。因此,PPARγ作为探讨相关疾病机制的重要分子备受关注。
在多种肿瘤的体内外实验中,TZD类化合物作用后表现出细胞增殖抑制和凋亡诱导效应[5-7],具有潜在的抗瘤作用。但是,亦有相反的报道[17-18]。从目前的研究来看,作为PPARγ高亲和力的配基,吡格列酮对人肝癌细胞的作用尚有争议[19-23],是否经由PPARγ依赖途径发挥作用未见报道。因此,研究吡格列酮对人肝癌细胞增殖和凋亡的影响以及其是否通过PPARγ依赖途径来发挥作用,是深入认识其药理作用的重要方面。
1 材料与方法
1.1药物与试剂吡格列酮(二甲基亚砜溶解)、GW9662以及pSG5-PPARγ真核表达质粒由刘永学研究员惠赠;RPMI 1640培养液购自Hyclone公司;新生小牛血清、胰蛋白酶购自 Gibco公司;针对PPARγ编码基因(NM 005037,GI:116284367)CDS区的shRNA(pGCsi-PPARγ)由上海吉凯基因化学技术有限公司设计、合成并筛选(阴性对照con siRNA也由其提供);RT-PCR试剂盒、DNA Marker DL2000购自TaKaRa公司;总RNA提取试剂TRIzol、LipofectamineTM2 000(1 g·L-1)购自 Invitrogen公司;3H-TdR购自北京原子高科技术应用股份有限公司;噻唑蓝购自Amersham LIFE SCIENCE;G418 Sulfate购自Amresco公司;羊抗PPARγ多抗、羊抗actin多抗、ECL检测试剂盒购自Santa Cruz公司;AnnexinⅤ-FITC Kit、Coulter®DNA PrepTMReagents Kit以及IntraPrepTMPermeabilization Reagent购自 Backman Coulter公司。
1.2主要仪器高速冷冻离心机(Heraeus Labofuge 400);PCR扩增仪(GeneAmp®PCR-2400);酶标仪(Thermo Labsystems Multiskan Ascent V1.24);凝胶成像分析系统(Tanon Gis-2009 system);DYY-Ⅲ2稳压稳流电泳仪(北京六一仪器厂);垂直电泳系统和电转系统(Bio-Rad公司);DU®-640核酸蛋白分析仪、LS-6500液体闪烁计数仪和EPICS-XL流式细胞仪(Beckman Coulter公司)。
1.3细胞培养及处理人HepG2细胞株用含10%小牛血清的RPMI 1640培养液于37℃ 、5%CO2培养箱生长2~3 d,至60% ~70%融合状态,PBS洗3次,更换无血清培养液,24 h后加入吡格列酮至不同终浓度(0、10、20、50 μmol·L-1),继续培养 48 h后收集细胞。若要观察GW9662的作用,在加入吡格列酮前1 h先加入GW9662至所需浓度(终浓度30 μmol·L-1)。
1.4瞬时转染取对数生长期 HepG2细胞,用0.2%的胰酶消化细胞,以1×108cells·L-1接种于24孔板,培养至90%融合,LipofectamineTM2 000介导法进行转染,实验方法按照说明书进行,转染6 h后更换新鲜无血清培养液用于后续实验。
1.5稳定转染取HepG2细胞,用0.2%的胰酶消化细胞,以1×109cells·L-1接种于6孔板,培养至90%融合,LipofectamineTM2 000介导法进行转染,实验方法按照说明书进行,转染48 h后,加入G418(100 mg·L-1),待单克隆长成后,镜下挑取单克隆细胞于96孔板培养,荧光显微镜下挑取细胞克隆,移至24孔板、6孔板,最后于培养瓶中培养。流式细胞仪检测GFP荧光率,保留荧光强度高的细胞株用于后续研究。
1.6噻唑蓝(MTT)比色实验HepG2细胞以1×108cells·L-1接种于96 孔板,200 μl/孔。以下处理同“1.3”,培养24 h后,加入吡格列酮至所需浓度,继续培养48 h后收集细胞。培养结束前4 h,每孔加入噻唑蓝溶液(5 g·L-1)20 μl,继续培养4 h 后,吸弃上清液,每孔加入150 μl二甲基亚砜,轻轻振荡10 min,用酶联免疫分析仪测定492 nm处吸光度,以反映HepG2细胞的增殖情况。
1.73H-TdR的参入测定HepG2细胞以1×108cells·L-1接种于 96 孔板,200 μl/孔。以下处理同“1.3”,在加入吡格列酮工作液30 min后,每孔加入18.5 kBq3H-胸腺嘧啶(3H-Thymidine,3H-TdR),48 h后用预冷的PBS洗涤两遍,加入10%三氯醋酸(trichloroacetic acid,TCA)1 ml,4℃放置60 min 以沉淀蛋白。收集沉淀物,体积分数为95%乙醇洗涤3遍,加入 0.15 mol·L-1NaOH 20 μl重悬后收集到玻璃纤维滤膜上。烘干滤膜,放入闪烁瓶中,加入闪烁液3 ml,用LS-6500液体闪烁计数仪进行参入量的测定。结果以cpm值表示,参入量反映了HepG2细胞DNA合成速率。
1.8细胞凋亡检测收集对照及经处理后的HepG2细胞,用冰PBS洗涤细胞2次,并用1×结合缓冲液调细胞浓度至1×108cells·L-1。严格按照AnnexinⅤ-FITC Kit说明书操作,具体步骤为:取100 μl上述细胞至 5 ml试管中,加 5 μl AnnexinⅤ-FITC 和 2.5 μl碘化丙碇(propidium iodide,PI),置室温闭光孵育15 min后,每管加入400 μl 1×结合缓冲液。于30 min内上流式细胞仪检测。同时制备3个质控样本来设定流式细胞仪的荧光补偿和设置十字门的范围:①没有染色的细胞;② 仅用荧光标记的Annexin V染色的细胞;③仅用PI染色的细胞。结果以Listmode文件保存和systemⅡ软件分析。
1.9RT-PCR扩增目的基因以TRIzol试剂一步法提取细胞总RNA。经DU-640核酸分析仪检测纯度及浓度后,严格按照RT-PCR试剂盒说明书操作,分别以各自的引物扩增PPARγ和内参照GAPDH。各引物序列如下:GAPDH:上游,5'-ACG GAT TTG GTC GTA TTG GG-3';下游,5'-TGA TTT TGG AGG GAT CTC GC-3',扩增片段为 230 bp;PPARγ:上游,5'-GCA TTC TGG CCC ACC AAC-3';下游,5'-CTG AAA CCG ACA GTA CTG-3',扩增片段为 484 bp。PCR扩增条件为:95℃预变性5 min;95℃ 45 s、48℃1 min、72℃ 1 min,28 次循环;72℃延伸 8 min。取RT-PCR产物进行2%琼脂糖凝胶电泳(含溴化乙锭0.5 mg·L-1),紫外凝胶成像系统分析光密度值,以待测基因与相应内参照光密度比值作为mRNA相对表达量。
1.10Western blot检测PPARγ蛋白表达收集对照及经处理后的HepG2细胞,加入50 μl预冷的细胞裂解液提取细胞内蛋白,Bradford法进行蛋白质定量,用5%SDS-聚丙烯酰胺凝胶进行电泳分离,转PVDF膜。封闭液室温封闭4 h,将膜转入含一抗(羊抗PPARγ 1∶100稀释)的TTBS中,室温孵育2 h;TTBS洗膜3次,将膜转入含二抗(辣根过氧化物酶标记的马抗羊二抗1∶2 000稀释)的TTBS中,室温孵育40 min;TTBS洗膜3次,用ECL显色并曝光于X线。KODAK凝胶成像分析系统分析结果,PPARγ蛋白相对表达量以其特异性结合条带与βactin结合条带的光密度比值表示。
1.11细胞周期检测收集对照及经处理后的HepG2细胞,用冰PBS洗涤细胞2次,并用PBS调细胞浓度至1×108cells·L-1。严格按照 Coulter®DNA PrepTMReagents Kit说明书操作,具体步骤为:取 100 μl上述细胞至 5 ml试管中,1 500 r·min-1离心5 min,弃上清,加入 100 μl DNA Prep LPR,温和混匀后室温静置10 s,再加入1 ml DNA Prep Stain室温避光15 min后上机分析。
1.12统计处理实验数据以±s表示。用SPSS11.5统计软件,以One-way ANOVA分析各组别之间的差异,两组间的比较采用LSD检验。
2 结果
2.1吡格列酮对HepG2细胞增殖作用的影响如Tab 1所示,MTT比色实验表明,吡格列酮对HepG2细胞增殖有明显抑制作用,并且随着吡格列酮浓度的增高,其抑制作用逐渐增强,呈一定的剂量依赖关系。
2.2吡格列酮对HepG2细胞DNA合成速率的影响如Tab 1所示,3H-TdR的参入实验表明,吡格列酮对HepG2细胞3H-TdR参入有抑制作用,表明其DNA合成速率明显降低。并且,随着吡格列酮浓度的增高,其抑制作用逐渐增强,也呈一定的剂量依赖关系。由于吡格列酮具有抑制HepG2细胞的增殖效应,因此它抑制HepG2细胞3H-TdR的参入也主要是通过抑制细胞数量得以实现。
Tab 1 Effects of pioglitazone on cell growth,3H-TdR uptake and cell apoptosis index in human HepG2 cell lines(±s,n=3)

Tab 1 Effects of pioglitazone on cell growth,3H-TdR uptake and cell apoptosis index in human HepG2 cell lines(±s,n=3)
*P<0.05,** P<0.01 vs Con
Concentration/mol·L -1 MTT assay/OD· well-1values 3H-TdR uptake/cpm·well-1 Cell apoptosis index/%(D4 quadrant)0(Con)0.148 ±0.008 2342 ±162 9.10 ±0.46 10 0.121 ±0.006* 1826 ±131** 13.23 ±0.70**20 0.109±0.004** 1411±112** 16.57±0.91**50 0.082±0.003** 824±88** 30.20±1.18**
2.3吡格列酮对HepG2细胞凋亡的影响如Fig 1和Tab 1所示,Annexin V-FITC流式细胞术结果显示,吡格列酮能够诱导HepG2细胞凋亡,并且随着吡格列酮浓度的增高,其诱导作用逐渐增强,呈一定的剂量依赖关系。
2.4吡格列酮对PPARγmRNA和蛋白表达的影响结果如Tab 2和Fig 2所示,RT-PCR和Western blot分析表明,不同浓度的吡格列酮处理对HepG2细胞PPARγ mRNA和蛋白表达无影响。
2.5吡格列酮对HepG2细胞周期的影响如Fig 3和Tab 2所示,流式细胞术结果显示,吡格列酮作用HepG2细胞48 h后可干扰细胞周期。与对照组相比,不同浓度吡格列酮可导致G0/G1期细胞大量增加,S期细胞大量减少,且呈一定的剂量依赖性,G2/M期细胞无变化。
2.6PPARγ依赖途径参与吡格列酮对HepG2细胞的增殖抑制作用如Fig 4所示,GW9662在30 μmol·L-1时明显拮抗了吡格列酮(20 μmol·L-1浓度时)对HepG2细胞增殖的抑制作用,但拮抗作用并不完全,pSG5-PPARγ表达质粒瞬时转染可以逆转GW9662的上述作用。单独GW9662作用或pSG5-PPARγ表达质粒瞬时转染对HepG2细胞的增殖作用无影响。这些结果初步表明,吡格列酮抑制HepG2细胞的增殖作用部分经由PPARγ依赖途径,因GW9662不能完全拮抗吡格列酮的作用,提示也可能存在PPARγ非依赖途径。
2.7PPARγ非依赖途径参与吡格列酮对HepG2细胞的增殖抑制作用为证实PPARγ非依赖途径的存在,我们将PPARγ小干扰RNA(pGCsi-PPARγ)稳定转染HepG2 细胞,PPARγ 沉默后20 μmol·L-1的吡格列酮作用后细胞的增殖抑制作用较非转染组相同浓度的吡格列酮处理组(20 μmol·L-1)明显减弱,但与对照组(Con)相比仍有明显抑制作用。而单独Con siRNA或pGCsi-PPARγ转染对HepG2细胞增殖作用无影响。此结果证实,吡格列酮体外对HepG2细胞的增殖抑制作用不依赖PPARγ的表达,确实存在PPARγ非依赖途径。
3 讨论

Fig 1 Representative AnnexinⅤ-FITC analysis in experiment of Tab 1
Tab 2 Effects of pioglitazone on PPARγ mRNA,PPARγ protein,and cell cycle phases(±s,n=3)
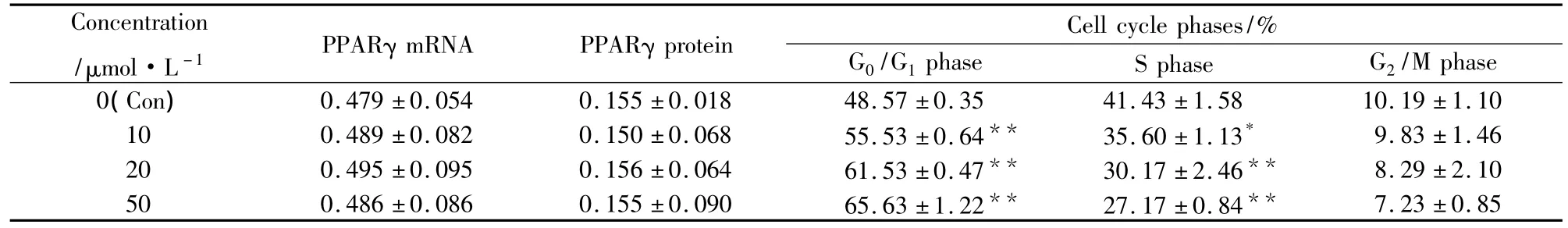
Tab 2 Effects of pioglitazone on PPARγ mRNA,PPARγ protein,and cell cycle phases(±s,n=3)
*P <0.05,** P <0.01 vs Con.The relative expression of PPARγ mRNA and protein was calculated by the densitometry value of PPARγ/GAPDH and PPARγ/β-actin.
Concentration/μmol·L-1 PPARγ mRNA PPARγ protein Cell cycle phases/%G0/G1phase S phase G2/M phase 0(Con)0.479 ±0.054 0.155 ±0.018 48.57 ±0.35 41.43 ±1 7.23 ±0.85.58 10.19 ±1.10 10 0.489 ±0.082 0.150 ±0.068 55.53 ±0.64** 35.60 ±1.13* 9.83 ±1.46 20 0.495 ±0.095 0.156 ±0.064 61.53 ±0.47** 30.17 ±2.46** 8.29 ±2.10 50 0.486 ±0.086 0.155 ±0.090 65.63 ±1.22** 27.17 ±0.84**
近年来研究发现,TZD类药物能够明显降低细胞生长速率或(和)诱导细胞的终末分化,表现出一定的抗瘤效应[19-23]。然而,在某些条件下,例如在结肠癌模型中,PPARγ的激活可以促进肿瘤的发生[17]。亦有报道PPARγ的激活在体内能够调控肝细胞生长因子的产生,后者能够促进肿瘤的生长[18]。最近,Kim 等[24]在人 HCC 细胞株中的研究表明PPARγ拮抗剂而不是激活剂具有抑制细胞增殖和诱导凋亡的作用,并认为PPARγ拮抗剂在降低细胞数量方面比曲格列酮和罗格列酮要强得多。因此,TZD类药物对人肝癌细胞的作用尚需进一步的研究予以证实。此外,从目前的研究进展来看,前述在人肝癌细胞中的研究均没有阐明其增殖抑制和(或)凋亡诱导作用是否经由PPARγ依赖途径,这对深入认识吡格列酮等TZD类化合物新的药理机制来说是至关重要的。

Fig 2A Representative RT-PCR in experiment of Tab 2
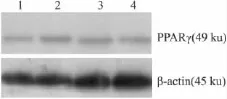
Fig 2B Representative Western blot in experiment of Tab 2

Fig 3 Representative flow cytometry analysis detecting cell cycle phases in experiment of Tab 2

Fig 4 Effects of pioglitazone on cell growth mediated through PPARγ signals.
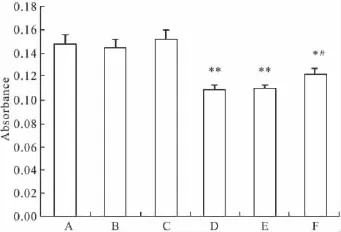
Fig 5 Effects of pioglitazone on cell growth not mediated by PPARγ signals.
本研究证实,吡格列酮能够明显抑制HepG2细胞的增殖、降低DNA合成速率并且诱导细胞的凋亡,表明吡格列酮在人肝癌细胞株中具有抗瘤作用,与Shim等[23]在HBV相关肝癌细胞株中最新的研究结果一致。本研究还显示,在上述作用中,PPARγ mRNA和蛋白表达并无明显变化,但吡格列酮能够明显干扰细胞周期,引起G0/G1期细胞大量增加,S期细胞减少,而G2/M期细胞无明显变化。G0/G1期阻滞是处于分化过程中的细胞所具有的共同特征,吡格列酮作用后HepG2细胞发生G0/G1期阻滞,表明其明显抑制了细胞的DNA合成和有丝分裂,与前述研究者利用曲格列酮的结果一致。而细胞周期状态和凋亡密切相关,细胞不能进展到分裂期,唯一的选择就是凋亡。因而,本研究中吡格列酮的增殖抑制作用可能与凋亡诱导作用相关。在肾细胞癌中的研究亦证实,除了细胞周期停滞的因素外,吡格列酮诱导的生长抑制亦是凋亡细胞增加的结果[25]。
在本研究中,吡格列酮并没有导致HepG2细胞PPARγ mRNA和蛋白表达增加,推测其并非通过改变受体数量实现上述作用,而可能通过后两种作用方式——即通过受体活化后引发的信号传导途径或通过PPARγ非依赖途径来完成。为探讨吡格列酮通过何种 PPARγ途径发挥上述作用,我们利用PPARγ特异性拮抗剂 GW9662、PPARγ-pSG5表达质粒以及PPARγ小干扰RNA进行了相关研究。结果发现,GW9662可以部分拮抗吡格列酮对HepG2细胞的增殖抑制作用,而在转染了PPARγ-pSG5表达质粒的HepG2细胞中,吡格列酮又恢复了上述作用,这一结果初步表明,吡格列酮抑制HepG2细胞的增殖作用部分经由 PPARγ依赖途径,但因GW9662不能完全拮抗吡格列酮的作用,提示也可能存在PPARγ非依赖途径。为证实PPARγ非依赖途径的存在,我们将pGCsi-PPARγ稳定转染HepG2细胞,发现吡格列酮对PPARγ沉默的HepG2细胞仍表现出细胞增殖抑制作用。上述结果表明,吡格列酮的细胞增殖抑制作用是通过PPARγ依赖和非依赖途径实现的。
迄今,从TZD类药物作用机制的有关文献来看,同种TZD类药物对不同的癌细胞株作用可以不一致,而不同的TZD类化合物对相同的癌细胞株作用亦不同,其中涉及不同TZD类药物复杂的药理学机制。本研究表明,吡格列酮能够抑制HepG2细胞的增殖和并诱导凋亡,具有潜在的抗瘤作用,这种作用与其诱导细胞G0/G1期的停滞有关,涉及PPARγ依赖途径和非依赖途径。但是,因PPARγ也表达于正常肝细胞,所以吡格列酮能否在体内发挥相同的作用以及PPARγ非依赖途径涉及的详细机制尚需进一步探讨。此外,研究不同TZD类药物的作用机制的异同之处对于其在抗癌方面的药理作用也具有重要意义。
[1]Smith U.Pioglitazone:mechanism of action[J].Int J Clin Pract,2001,121:13 -8.
[2]Willson T M,Brown P J,Sternbach D D,et al.The PPARs:from orphan receptors to drug discovery[J].J Med Chem,2000,43:527-50.
[3]Issemann I,Green S.Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J].Nature,1990,347:645 -50.
[4]Schoonjans K,Martin G,Staels B,Auwerx J.Peroxisome proliferators-activated receptors,orphans with ligands and functions[J].Curr Opin Lipido,1997,8:159 -66.
[5]Berger J,Bailey P,Biswas C,et al.Thiazolidinediones produce a conformational change in peroxisome proliferators-activated receptor-γ:binding and activation correlate with antidiabetic actions in db/db mice[J].Endocrinology,1996,137:4189 -95.
[6]Rosen E D,Spiegelman B M.Molecular regulation of adipogenesis[J].Annu Rev Cell Dev Biol,2000,16:145 -71.
[7]Delerive P,Martin-Nuzard F,Chinetti G,et al.Peroxisome proliferator-activated receptor activators inhibit thrombin-induced endothelin-1 production in human vascular endothelial cells by inhibiting the activator protein-1 signaling pathway[J].Circ Res,1999,85:394-402.
[8]Han S W,Roman J.Rosiglitazone suppresses human lung carcinoma cell growth through PPARγ-dependent and PPARγ-independent signal pathways[J].Mol Cancer Ther,2006,5(2):430 - 7.
[9]Galli A,Ceni E,Crabb D W,et al.Antidiabetic thiazolidinediones inhibit invasiveness of pancreatic cancer cells via PPARg independent mechanisms[J].Gut,2004,53:1688 -97.
[10]Shiau C W,Yang C C,Kulp S K,et al.Thiazolidenediones mediate apoptosis in prostate cancer cells in part through inhibition of BclxL/Bcl-2 functions independently of PPARg[J].Cancer Res,2005,65:1561 -9.
[11]Palakurthi S S,Aktas H,Grubissich L M,et al.Anticancer effects of thiazolidinediones are independent of peroxisome proliferator-activated receptor gamma and mediated by inhibition of translation initiation[J].Cancer Res,2001,61(16):6213 - 8.
[12]Braissant O,Foufelle F,Scotto C,et al.Differential expression of peroxisome proliferator-activated receptors(PPARs):tissue distribution of PPAR-α,-β,and-γ in the adult rat[J].Endocrinology,1996,137:354 -66.
[13]Lowell B B.PPAR gamma:an essential regulator of adipogenesis and modulator of fat cell function[J].Cell,1999,9:239 -42.
[14]伍仕敏,叶 平,周 新,等.吡格列酮体外对大鼠心肌肥大的改善作用[J].中国药理学通报,2004,20(1):45 -9.
[14]Wu S M,Ye P,Zhou X,et al.Pioglitazone inhibits cardiac hypertrophyin vitro.[J].Chin Pharmacol Bull,2004,20(1):45 - 9.
[15]董 燕,丁 奇,金 英,等.吡格列酮对Aβ25-35引起的皮层神经元损伤保护作用部分机制的研究[J].中国药理学通报,2010,26(12):1652 -7.
[15]Dong Y,Ding Q,Jin Y,et al.The mechanisms of neuroprotective effect of pioglitazone on amyloid beta-protein fragment 25-35-induced neurotoxicity in the cultured cortical neurons[J].Chin Pharmacol Bull,2010,26(12):1652 -7.
[16]隋海娟,金 英,潘月星,等.吡格列酮对脂多糖诱导的星形胶质细胞炎性细胞因子释放的影响[J].中国药理学通报,2010,26(9):1226-30.
[16]Sui H J,Jin Y,Pan Y X,et al.Effects of pioglitazone on the cultured cortical astrocytes induced by lipopolysaccharide expressions of inflammatory cytokines [J].Chin Pharmacol Bull,2010,26(9):1226-30.
[17]Saez E,Tontonoz P,Nelson M C,et al.Activators of the nuclear receptor PPAR gamma enhance colon polyp formation[J].Nat Med,1998,4(9):1058 -61.
[18]Jiang J G,Johnson C,Zarnegar R.Peroxisome proliferator-activated receptor γ-mediated transcriptional up-regulation of the hepatocyte growth factor gene promoter via a novel composite cis-acting element[J].J Biol Chem,2001,276:25049 -56.
[19]Toyoda M,Takagi H,Horiguchi N,et al.A ligand for peroxisome proliferators activated receptor inhibits cell growth and induces apoptosis in human liver cancer cells[J].Gut,2002,50(4):563 -7.
[20]Rumi M A,Sato H,Ishihara S,et al.Peroxisome proliferator-activated receptor ligand-induced growth inhibition of human hepatocellular carcinoma[J].Br J Cancer,2001,84(12):1640 -7.
[21]Okano H,Shiraki K,Inoue H,et al.Peroxisome proliferator-activated receptor augments tumor necrosis factor family-induced apoptosis in hepatocellular carcinoma[J].Anticancer Drugs,2002,13(1):59-65.
[22]Motomura W,Takahashi N,Nagamine M,et al.Growth arrest by troglitazone is mediated by p27Kip1 accumulation,which results from dual inhibition of proteasome activity and Skp2 expression in human hepatocellular carcinoma cells[J].Int J Cancer,2004,108(1):41-6.
[23]Shim J,Kim B H,Kim Y I,et al.The peroxisome proliferator-activated receptor gamma ligands,pioglitazone and 15-deoxy-Delta(12,14)-prostaglandin J(2),have antineoplastic effects against hepatitis B virus-associated hepatocellular carcinoma cells[J].Int J Oncol,2010,36(1):223 -31.
[24]Kim K R,Choi H N,Lee H J,et al.A peroxisome proliferator-activated receptor gamma antagonist induces vimentin cleavage and inhibits invasion in high-grade hepatocellular carcinoma[J].Oncol Rep,2007,18:825 -32.
[25]Yang F G,Zhang Z W,Xin D Q,et al.Peroxisome proliferator-activated receptor gamma ligands induce cell cycle arrest and apoptosis in human renal carcinoma cell lines[J].Acta Pharmacol Sin,2005,26(6):753 -61.

