新型芳烷酮哌嗪类衍生物YX0611-1对坐骨神经慢性压迫损伤大鼠的镇痛作用
王玉梅,谢 炜,徐祥清,刘世成,盛雨辰
(1.上海医药工业研究院,上海200040,2.江苏恩华药业股份有限公司,江苏 徐州 221007)
神经病理性疼痛是指由中枢或外周神经系统损伤或疾病引起的疼痛综合征。其疼痛机制极其复杂,治疗困难,常规镇痛药物治疗无明显疗效。已有研究表明,脊髓背角N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体在病理性疼痛的形成中发挥至关重要的作用[1],特别是NMDA受体的2B亚基(NR2B)在疼痛的产生及中枢性痛觉敏化形成中起到重要作用[2]。
因此,针对NMDA受体多胺位点设计合成了芳烷酮哌嗪类衍生物新结构化合物,以期寻找新型非阿片类镇痛药物。前期研究表明[3~5],芳烷酮哌嗪类衍生物具有明显镇痛活性,其中优选活性化合物YX0611-1实验结果显示对小鼠醋酸扭体实验模型、小鼠热板实验模型、大鼠蜂毒致痛实验模型及大鼠坐骨神经分支选择损伤模型(SNI)4种疼痛模型均有效,表现出了良好的抗急性痛和抗神经病理性疼痛的效能。为进一步考查YX0611-1对神经病理性疼痛的效果,我们拟构建大鼠坐骨神经结扎(chronic constriction injury of the sciatic nerve,CCI)模型,进一步验证YX0611-1对大鼠神经病理性疼痛的镇痛作用,为该化合物的进一步开发提供依据和决策参考。
1 材料与方法
1.1实验动物、仪器、试剂成年SD大鼠,♂,体质量140~180 g,由上海西普尔-必凯实验动物有限公司提供,饲养于正压净化通风动物房内,室温(24±1)℃,湿度40% ~70%,人工照明模拟昼夜变化,自由进食与饮水。
Electronic von Frey纤毛仪,美国IITC Life Science Inc公司产品。热痛刺激仪BME-410A,中国医学科学院生物工程研究所。
加巴喷丁(gabapentin)原料药,批号:20100301,普瑞巴林(pregabalin)原料药,批号:20100301,由江苏恩华药业股份有限公司提供,临用时用生理盐水配成相应浓度。YX0611-1,由上海医药工业研究院化学制药部提供,批号:20100801,临用时用生理盐水配成相应浓度。盐酸吗啡(morphine)注射液,东北制药集团公司沈阳第一制药厂生产,批号:20100510,批准文号:国药准字H21022436。水合氯醛,国药集团化学试剂有限公司,批号:T20100322。
1.2实验动物分组及给药大鼠随机分为7组,分别为假手术组、模型组、加巴喷丁(100 mg·kg-1)组、盐酸吗啡(10 mg·kg-1)组、普瑞巴林(40 mg·kg-1)组以及 YX0611-1 高剂量(160 mg·kg-1)组、中剂量(80 mg·kg-1)组,每组10只。假手术组仅暴露坐骨神经而不进行结扎,其他制备坐骨神经结扎(CCI)模型,各组大鼠手术前1 d测定机械刺激阈值和热刺激潜伏期,术后d 7测定机械刺激阈值和热刺激潜伏期以确定是否造模成功。造模成功的大鼠于手术后d 8灌胃给药(盐酸吗啡组腹腔注射),假手术组和模型组给予等体积的溶剂(生理盐水),连续给药6 d,每天1次。各组给药d 1和最后1 d进行测定机械刺激阈值和热刺激潜伏期测定,假手术组、模型组、普瑞巴林组、YX0611-1高、中剂量组给药后60 min测定,加巴喷丁组给药后120 min测定,盐酸吗啡组给药后30 min测定。
1.3坐骨神经结扎模型(CCI)的制备按照Benett等[6]的方法制备CCI模型,大鼠腹腔注射10%水合氯醛(350 mg·kg-1),麻醉后右下肢剪毛、常规消毒,在股骨外侧切开长约2 cm的纵行切口,切开皮肤及皮下组织,顺肌纹钝性分离肌肉,于股骨后找到坐骨神经主干,暴露坐骨神经,游离周围组织,在接近其分叉之前游离出约7 mm的神经,用4根4-0的手术线间隔1mm进行松结扎,结扎线以引起大鼠腿部轻微抽搐、收缩或蹬腿而不影响神经外膜的血运,使神经外膜轻度凹陷为度,然后逐层缝合。手术时间8~12 min,术后每只肌注青霉素2次,每次8万单位。
1.4机械刺激阈值测量将大鼠置于透明的有机玻璃箱(22 cm×12 cm×22 cm)中,底为0.5 cm×0.5 cm孔径的铁丝网。实验前使之适应30 min。用Electronic von Frey垂直刺激术侧后肢足底中部,缓慢施加力度,直到大鼠抬足或舔足,此力度为机械刺激阈值,测定4次,为避免或减少前一次刺激对随后刺激效应造成的影响,同一部位刺激的间隔时间为3 min,取其平均值。
1.5热刺激潜伏期测量将大鼠置于底为3 mm厚玻璃板的有机玻璃箱(22 cm×12 cm×22 cm)中,使其适应30 min后用BME-410A型热辐射刺激仪照射大鼠足底。照射开始至大鼠出现抬腿回避时间为热刺激潜伏期。切断时间为60 s,以防止组织损伤;测定4次,为避免或减少前一次刺激对随后刺激效应造成的影响,同一部位刺激的间隔时间为3 min,取其平均值。
1.6统计学处理数据以±s表示,组间比较采用单因素方差分析,组内比较采用配对t检验。
2 结果
2.1大鼠机械刺激阈值和热刺激潜伏期基础值及d 7测定值结果表明,与基础值相比,假手术组d 7时机械阈值和热刺激潜伏期都没有明显变化;各组造模大鼠d 7时机械刺激阈值和热刺激潜伏期明显降低(P<0.05)。结果见Tab 1、2。
2.2YX0611-1对CCI模型大鼠机械刺激阈值和热刺激潜伏期的影响在实验的d 8和d 13的上午给药后分别测定各组大鼠的机械刺激阈值和热刺激潜伏期,与模型组相比,YX0611-1单次给药160和80 mg·kg-1均能明显提高大鼠的机械刺激阈值和热刺激潜伏期(P<0.05),化合物YX0611-1的160 mg·kg-1组多次给药能明显提高大鼠的机械刺激阈值和热刺激潜伏期(P<0.05),化合物YX0611-1的80 mg·kg-1组多次给药均能明显提高大鼠的热刺激潜伏期(P<0.05),说明该化合物在该剂量下具有较好的镇痛作用。结果见Tab 3,4。
Tab 1 The paw withdrawal mechanical threshold of the baseline and measured value of the seventh day(±s)
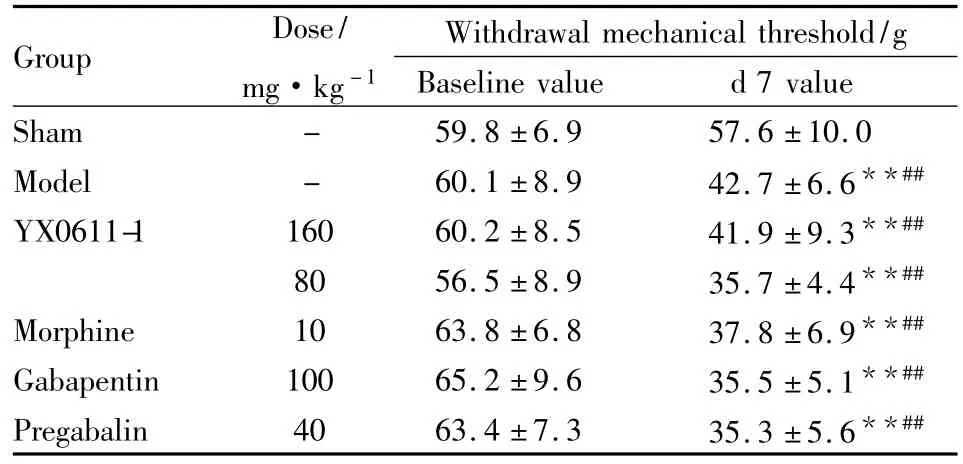
Tab 1 The paw withdrawal mechanical threshold of the baseline and measured value of the seventh day(±s)
**P<0.01 vs baseline value;##P<0.01 vs sham
Group Dose/mg·kg-1 Withdrawal mechanical threshold/g Baseline value d 7 value Sham - 59.8 ±6.9 57.6 ±10.0 Model - 60.1 ±8.9 42.7 ±6.6**##YX0611-1 160 60.2 ±8.5 41.9 ±9.3**##80 56.5 ±8.9 35.7 ±4.4**##Morphine 10 63.8 ±6.8 37.8 ±6.9**##Gabapentin 100 65.2 ±9.6 35.5 ±5.1**##Pregabalin 40 63.4 ±7.3 35.3 ±5.6**##
Tab 2 The Paw withdrawal thermal latency of the baseline and measured value of the seventh day(±s)
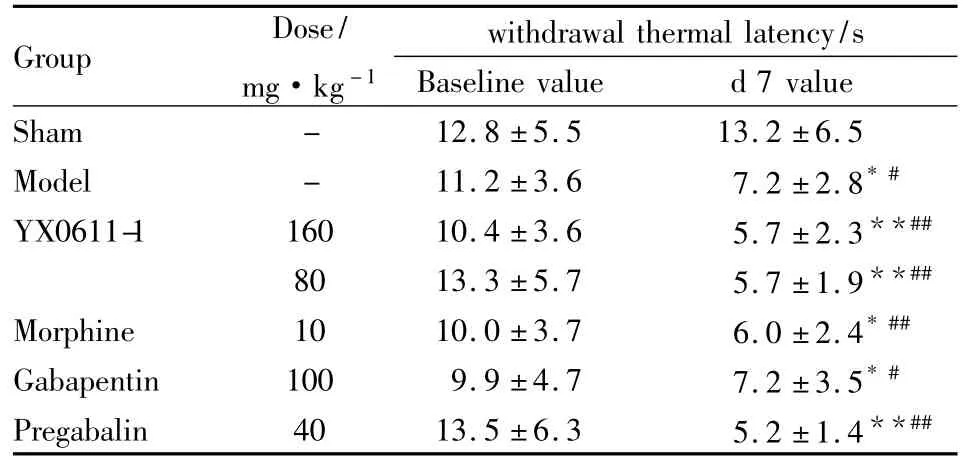
Tab 2 The Paw withdrawal thermal latency of the baseline and measured value of the seventh day(±s)
*P<0.05,**P<0.01 vs baseline value;#P<0.05,##P <0.01 vs sham
Group Dose/mg·kg-1 withdrawal thermal latency/s Baseline value d 7 value Sham - 12.8 ±5.5 13.2 ±6.5 Model - 11.2 ±3.6 7.2 ±2.8*#YX0611-1 160 10.4 ±3.6 5.7 ±2.3**##80 13.3 ±5.7 5.7 ±1.9**##Morphine 10 10.0 ±3.7 6.0 ±2.4*##Gabapentin 100 9.9 ±4.7 7.2 ±3.5*#Pregabalin 40 13.5 ±6.3 5.2 ±1.4**##
3 讨论
Tab 3 Effect of of YX0611-1 on the paw withdrawal mechanical threshold of CCI rats(±s)

Tab 3 Effect of of YX0611-1 on the paw withdrawal mechanical threshold of CCI rats(±s)
*P <0.05,**P <0.01 vs model
Group Dose/mg·kg-1 Withdrawal mechanical threshold/g d 8 d 13 Sham - 58.9 ±12.2 63.9 ±8.8 Model - 36.4 ±6.1 37.9 ±5.0 YX0611-1 160 48.5 ±12.3* 48.5 ±11.7**80 42.8 ±3.0** 38.4 ±6.2 Morphine 10 50.4 ±8.0** 49.4 ±8.9**Gabapentin 100 44.6 ±4.1** 43.7 ±6.2*Pregabalin 40 45.1 ±7.1** 47.5 ±8.2*
中枢神经系统最重要的兴奋性神经递质(excite mental amino acid,EAAs)是谷氨酸,谷氨酸及其受体参与脊髓水平伤害性信息的传递和整合。N-甲基-D-天冬氨酸受体(NMDAR,NR)是谷氨酸受体的一种类型,属于离子型受体。该受体由NR1、NR2AD及NR3A-B 7种亚单位组成[7],谷氨酸的结合位点由NR2B组成[8],脊髓背角神经元NR的激活在疼痛的中枢致敏过程中发挥关键作用[9],NMDA受体在痛敏中激活的信号传导通路包括对蛋白激酶C(PKC)的激活,对NO-cGMP通路的激活以及脊髓锰过氧化物歧化酶的硝化失活[10]等。进一步的研究发现NR2B是NR参与疼痛产生的调节亚基[11],NR2B受体与疼痛的传导密切相关[12]。NR2B在疼痛的产生及中枢性痛觉敏化形成中起到重要作用[13],NR2B高表达提示疼痛程度加强。脑室内注射NR2B拮抗剂明显减轻福尔马林引起的大鼠疼痛[14]。
Tab 4 Effect of of YX0611-1 on the paw withdrawal thermal latency of CCI rats(±s)

Tab 4 Effect of of YX0611-1 on the paw withdrawal thermal latency of CCI rats(±s)
*P <0.05,**P <0.01 vs model
Group Dose/mg·kg-1 Withdrawal thermal latency/s d 8 d 13 Sham - 11.7 ±4.3 12.2 ±5.44 Model - 7.3 ±3.0 6.1 ±2.0 YX0611-1 160 10.4 ±2.7* 9.3 ±3.7*80 12.5 ±6.5* 9.4 ±3.5*Morphine 10 15.7 ±7.0** 17.1 ±6.9**Gabapentin 100 10.9 ±3.0* 11.2 ±6.7*Pregabalin 40 12.2 ±4.7* 10.8 ±5.9*
CCI模型是研究神经病理性疼痛的经典模型,其疼痛特征和临床上神经病理性疼痛颇为相似,常用来研究神经病理性疼痛[15]。本实验采用CCI模型,结果显示,阳性药物对照组(吗啡组、加巴喷丁组、普瑞巴林组)单次和多次给药能明显提高大鼠机械刺激阈值,延长大鼠热刺激潜伏期(P<0.05),表明阳性药物吗啡、加巴喷丁、普瑞巴林对CCI模型有镇痛作用,也表明 CCI模型是成功建立的;YX0611-1 160 mg·kg-1组和 80 mg·kg-1组单次给药均能明显提高大鼠的机械刺激阈值,延长大鼠热刺激潜伏期(P<0.05);YX0611-1 160 mg·kg-1组多次给药能明显提高大鼠机械刺激阈值,延长大鼠热刺激潜伏期(P<0.05);YX0611-1 80 mg·kg-1组多次给药能明显提高大鼠的热刺激潜伏期(P<0.05),以上结果进一步证明了YX0611-1对神经病理性疼痛有较好的镇痛作用,与药物吗啡、加巴喷丁、普瑞巴林镇痛效果相当。80 mg·kg-1组多次给药提高大鼠的机械刺激阈值,但差别无统计学意义,其原因不清楚,可能有药物耐受性,需要在以后实验中进一步研究,同时可加设40 mg·kg-1剂量组。
化合物YX0611-1对神经病理性疼痛有较强的镇痛作用,其作用机制可能是通过以下途径抑制NR2B的表达:①抑制NMDA受体的激活;② 特异性地阻断NR2B受体;③抑制蛋白激酶 C的激活;④抑制NO-cGMP通路的激活;⑤ 抑制蛋白酪氨酸激酶和酪氨酸磷酸酶的激活等等,其具体镇痛机制还需要进一步的深入研究。
[1]Gogas K R.Glutamate-based therapeutic approaches:NR2B receptor antagonists[J].Curr Opin Pharmacol,2006,6:68 -74.
[2]LoGrasso P,Mckelvy J.Advances in pain therapeutics[J].Curr Opin Chem Biol,2003 ,7(4):452-6.
[3]L i J Q,Huang L Y,Zhang C N,et al.Aralky-ketonepiperazine derivatives and their uses as novel antalgic and sedative agents:CN,Z L 02111786 .1[P].2002-05-22 .
[4]Li J Q,huang L Y,Chen J X,et al.Design and synthesis of aralkyl-ketone piperazine derivatives and their antalgic activities[J].Acta Pharm Sin,2007,42:1166 -75.
[5]Li J Q,huang L Y,Chen J X,et al.Synthesis and central noneopioid analgesic activity of SIPI 5047[J].Acta Pharm Sin,2008,43:611-8.
[6]Bennett G J,Xie Y K.A peripheral mononeuropathy in rat that produced disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[7]Brown K M,Wrathall J R,Yasuda R P,et al.Glutamate receptor subunit expression after spinal cord in jury in young rats[J].Brain Res Dev Brain Res,2004,152:61 -8.
[8]Chen P E,Geballe M T,Stansfeld P J,et al.Structural features of the glutamate binding site in recombinant NR1/NR2AN-methyl-D-aspartate receptors determined by site-directed mutagenesis and molecular modeling[J].Mol Pharmacol,2005,67(5):1470.
[9]Cheng H T,Suzuki M,Hegarty D M,et al.Inflammatory pain-induced signaling events following a conditional deletion of theN-methyl-D-aspartate receptor in spinal cord dorsal horn[J].Neuroscience,2008,155(3):948 -58.
[10]Muscoli C,Mollace V,Wheatley J,et al.Superoxide-mediated nitration of spinal manganese superoxide dismutase:a novel pathway inN-methyl-D-aspartate-mediated hyperalgesia[J].Pain,2004,111(1-2):96-103.
[11]Xiao C,Huang Y,Dong M,et al.NR2B-selective conantokin peptide inhibitors of the NMDA receptor display enhanced antinociceptive properties compared to non-selective conantokins[J].Neuropeptides,2008,42(5-6):601 -9.
[12]Li T T,Ren W H,Xiao X,et al.NMDA NR2A and NR2B receptors in the rostral anterior cingulate cortex contribute to pain-related aversion in male rats[J].Pain,2009,146(1-2):183 -93.
[13]Kim Y I,Na H S,Yoon Y W,et al.NMDA receptors are important for both mechanical and thermal allodynia from peripheral nerve injury in rats[J].Neuoreport,1997,8(9/10):2149.
[14]Yang G Y,Woo Y W,Park M K,et al.Intracisternal administrationof NR2 antagonists attenuates facial formalin-induced nociceptive behavior in rats[J].J Orofac Pain,2010,24(2):203 -11.
[15]聂 鑫,朱珊珊,曾因明.γ-氨基丁酸转运体抑制剂NO-711术前鞘内注射对坐骨神经慢性挤压伤大鼠神经病理性痛觉过敏的影响[J].中国药理学通报,2006,22(7):895 -6.
[15]Nie X,Zhu S S,Zeng Y M.Effects of preemptive intrathecal administration of γ-aminobutyric acid transporters-1 inhibitor NO-711 on neuropathic pain induced by chronic constriction injury in rats[J].Chin Pharmacol Bull,2006,22(7):895 -6.

