交叉反应物质197转运大分子物质通过血肿瘤屏障的效果和机制
王 萍,刘云会,薛一雪
(1.中国医科大学基础医学院神经生物学教研室,辽宁沈阳 110001;2.中国医科大学附属盛京医院,辽宁沈阳 110004)
脑肿瘤是一种严重危害人类健康的疾病,手术切除结合术后化疗能有效延长患者的生存期。然而,由于血肿瘤屏障的存在极大的限制了抗肿瘤药物进入中枢神经系统,影响化疗疗效,如何安全有效的增加血肿瘤屏障的通透性是目前亟待解决的关键问题[1]。交叉反应物质 197(cross-reacting material 197,CRM197)是一类白喉毒素的无毒突变体,作为荚膜多糖抗原载体蛋白或疫苗在国外已尝试应用于临床[2-3]。CRM197的主要作用位点是白喉毒素受体,也称肝素结合表皮生长因子(heparin-binding epidermal growth factor,HB-EGF)的膜结合前体。CRM197与受体结合后可以抑制受体剪切,明显减少剪切后HB-EGF的形成,减弱由HB-EGF激活的多条信号途径,如 PI3K/Akt信号途径。因此,CRM197还具有抗癌的作用,可用于卵巢癌等HBEGF高表达的癌症的治疗[4-5]。最近有研究发现[6],CRM197可以作为一种安全有效的载体,转运大分子物质通过血脑屏障,提示CRM197有可能成为新的更为有效的脑内药物转运载体。对于CRM197转运大分子物质通过血肿瘤屏障的作用效果及相关机制目前尚未见报道。本研究通过检测分析CRM197转运HRP通过血肿瘤屏障的效果以及对p-Akt、转录因子FOXO1A及质膜微囊蛋白caveolin-1表达水平的影响,旨在为CRM197的临床应用提供实验依据。
1 材料与方法
1.1试剂和仪器CRM197、牛血清白蛋白购自Sigma公司;HRP偶联试剂盒购自Alpha Diagnostic公司;EGM-2 MV细胞培养液购自Lonza公司;兔抗p-FOXO1A(Ser256)多克隆抗体购自Abcam公司;兔抗p-Akt 1/2/3(Ser473)多克隆抗体、羊抗Akt 1/2多克隆抗体、兔抗caveolin-1多克隆抗体、小鼠抗β-actin单克隆抗体、辣根过氧化物酶标记的二抗和ECL化学发光检测试剂盒均购自Santa Cruz公司;SP试剂盒购自福建迈新生物技术公司。主要仪器:多功能酶标仪(Molecular Devices,美国);正置显微镜(Olympus,日本);电泳装置(Bio-Rad,美国)。
1.2制备CRM197-HRP和BSA-HRP偶联物按照HRP偶联试剂盒提供的说明,将CRM197、BSA与HRP偶联,即将1 mg CRM197或BSA溶于偶联buffer,加入1 mg预激活的HRP,于4°C孵育过夜。加入阻断buffer后,将混合物在室温下孵育1 h。将偶联物于 4°C用 PBS透析,加入稳定 buffer,经Sephacryl S-200 HR分离纯化后,置于4°C保存。
1.3细胞培养人脑微血管内皮细胞系hCMEC/D3 由 Pierre-Olivier Couraud(INSERM U567,Paris,法国)教授惠赠,培养于EGM-2 MV培养液(按照说明书加入添加物)。人U251胶质瘤细胞由中国医科大学神经生物学教研室提供,培养于含10%胎牛血清的DMEM高糖培养液。
1.4体外血肿瘤屏障模型的制作和跨细胞转运实验将hCMEC/D3细胞接种于transwell上室,培养3 d后,接种人U251胶质瘤细胞于transwell膜背面,共同培养2 d后都长至单层。经电阻测量系统检测血肿瘤屏障模型的跨内皮电阻值为70~110 Ω·cm-2。所有的细胞培养于37℃的湿润环境中(5%CO2和95%的空气)。向transwell上室中加入10 mg·L-1CRM197-HRP分别作用不同时间,而后通过TMB显色法检测下室中HRP的活性变化,即向含有HRP的下室溶液中加入TMB显色液室温孵育20 min后,加入0.5 mol·L-1H2SO4终止反应,酶标仪检测HRP的光吸收值,绘制HRP的标准曲线,检测CRM197-HRP的转运水平。对照组加入BSA-HRP(10 mg·L-1)分别作用不同时间,比较对HRP的转运效果。
1.5细胞免疫组化检测hCMEC/D3细胞在EGM-2 MV细胞培养液中培养3 d后,替换以人U251胶质瘤细胞条件培养液继续培养2 d后使用。将CRM197(10 mg·L-1)作用于hCMEC/D3细胞1 h后,弃掉培养液,PBS洗后4℃丙酮固定,PBS洗后,按照S-P试剂盒的说明,用10%BSA封闭30 min,兔抗p-Akt一抗孵育过夜,PBS洗后,生物素标记的羊抗兔IgG孵育30 min,PBS洗后,链霉菌抗生物素蛋白-过氧化酶孵育20 min,PBS洗后,DAB显色后显微镜观察。
1.6Western blot实验hCMEC/D3细胞在EGM-2 MV细胞培养液中培养3 d后,替换以人U251胶质瘤细胞条件培养液继续培养2 d后使用。将CRM197(10 mg·L-1)作用于hCMEC/D3细胞1 h后收集细胞,加入RIPA裂解液和蛋白酶抑制剂(10 g·L-1aprotinin,10 g·L-1PMSF 和 50 mmol·L-1sodium orthovanadate)。细胞提取物经考马斯亮蓝G250结合法测定蛋白浓度,以每加样孔10~20 μg蛋白总量经SDS-PAGE电泳进行分离,并转移至PVDF膜,于4℃封闭过夜。d 2 TBST洗后,分别加入一抗室温杂交2 h,辣根过氧化物酶标记的二抗室温杂交2 h。TBST洗后,向膜上滴加ECL工作液,进行压片检测,显影定影,获取图像。
1.7统计学处理所有数据以±s表示,两组间比较采用t检验,多组间采用One-way ANOVA分析。
2 结果
2.1体外血肿瘤屏障模型中CRM197-HRP的跨细胞转运效果CRM197-HRP在不同时间点的跨细胞转运实验结果显示,transwell下室中HRP的活性呈时间依赖性增加,均高于30 min组;CRM197-HRP作用60 min时,transwell下室中HRP的活性较前一组增加。CRM197-HRP在各时间点的转运水平均高于BSA-HRP对照组(Fig 1)。
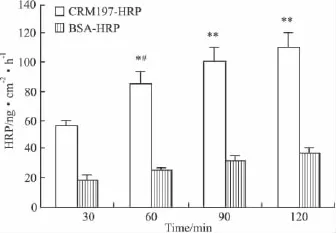
Fig 1 Transcytosis experiments of CRM197-HRP and BSA-HRP across the in vitro BTB model(±s,n=4)
2.2CRM197抑制hCMEC/D3细胞中p-Akt的表达水平结果显示hCMEC/D3细胞中CRM197作用前,p-Akt分布于胞质和细胞核中,且以胞质为主(Fig 2A);加入 CRM197作用1 h后,p-Akt的表达水平减弱(Fig 2B)。
2.3CRM197作用后p-FOXO1A、p-Akt和caveolin-1在hCMEC/D3细胞中的表达变化将CRM197或PI3K抑制剂LY294002加入hCMEC/D3细胞中作用1 h,Western blot结果显示与未处理组相比,CRM197作用后Akt和FOXO1A的蛋白磷酸化水平下降,总Akt的蛋白表达水平未发生变化;而质膜微囊蛋白caveolin-1的表达水平增加(Fig 3)。
3 讨论
血肿瘤屏障的存在极大的限制了化疗药物的转运,一些化学方法已尝试用于增加血肿瘤屏障的通透性[7-8]。最近研究发现,CRM197能够转运大分子物质通过血脑屏障,但其转运大分子物质通过血肿瘤屏障的效果和机制目前尚无文献报道。本研究结果证实,CRM197能有效转运HRP通过血肿瘤屏障,其机制可能与减少Akt和FOXO1A的磷酸化水平,增加质膜微囊蛋白caveolin-1的表达有关。

Fig 2 Expression and distribution of p-Akt analyzed by immunohistochemistry after treatment with CRM197 in the hCMEC/D3 cells for 1 h(±s,n=4)
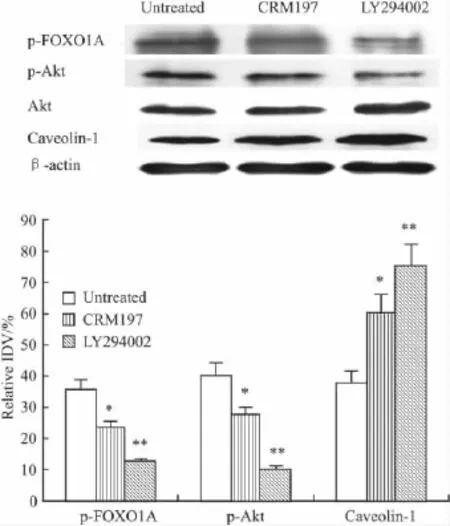
Fig 3 Western blot analysis of the expressing levels of p-Akt,p-FOXO1A and caveolin-1 in extracts of hCMEC/D3 cells after treatment with CRM197(±s,n=3)
在本研究中,首先采用hCMEC/D3细胞建立了体外血肿瘤屏障模型,并以此为研究对象检测了CRM197-HRP通过血肿瘤屏障的转运水平。结果显示,随着CRM197-HRP作用时间的延长,transwell下室中HRP的活性呈时间依赖性增加;和前一组相比CRM197-HRP作用60 min时,transwell下室中HRP的活性增加,提示在30~60 min时间段CRM197-HRP的转运水平较高。由于未经修饰的大分子量血浆蛋白,如白蛋白(67 ku),很难通过血脑屏障,所以白蛋白或BSA经常在体外或在体研究中被用来评价血脑屏障的完整性[9]。本研究中,CRM197-HRP通过血肿瘤屏障的转运水平约为BSA-HRP的4倍,表明CRM197-HRP具有更好的转运效果。
Caveolae是位于细胞膜表面的特异性内陷囊状结构,是第一个被确定的内皮细胞胞吞成分,由caveolin家族蛋白成员caveolin-1,-2和-3组成。研究表明,caveolae在脑微血管内皮细胞的跨细胞转运过程中起着重要的调节作用[10]。在脑组织中,caveolin-1在脑微血管,尤其在微血管内皮细胞中有较高的表达水平[11]。caveolin-1是caveolae的标志性蛋白,在维持caveolae的形态、结构和功能中起重要作用,在血肿瘤屏障跨细胞转运的调节过程中也起着关键的作用。caveolin-1的表达也受到某些调控因素的影响,如FOXO转录因子能直接与caveolin-1启动子区的5'-TTGTTTAC-3'位点结合,诱导caveolin-1的表达[12]。最近研究显示,叉头框(forkhead box,FOX)蛋白在内皮细胞生物学功能的调节中起着多方面的作用。FOXO1A是FOX家族中FOXO亚家族的成员之一,其上游受PI3K/Akt磷酸化级联通路的调节。活化的Akt能使FOXO1A的Thr24、Ser256和 Ser319发生磷酸化修饰,促使FOXO1A核排除,即由细胞核进入胞质中,进而失去转录活性[13]。在本研究中,CRM197作用后能够抑制hCMEC/D3细胞中Akt的磷酸化水平,减弱p-FOXO1A(Ser256)的活性,增加FOXO1A在细胞核中的分布,进而可能参与caveolin-1表达的上调。由于质膜微囊caveolin-1能够通过影响血肿瘤屏障的跨细胞途径参与屏障通透性的调节,上调的caveolin-1可能通过促进血肿瘤屏障内皮细胞中吞饮小泡的形成,增加CRM197-HRP通过血肿瘤屏障的转运水平。
综上所述,CRM197能有效转运HRP通过血肿瘤屏障,其作用机制可能与CRM197抑制血肿瘤屏障内皮细胞中PI3K/Akt信号通路,减少FOXO1A的磷酸化水平,进而增加caveolin-1的表达有关。CRM197有希望转运大分子药物通过血肿瘤屏障,治疗脑肿瘤,其作用效果及机制仍需深入研究。
[1]Nathanson D,Mischel P S.Charting the course across the bloodbrain barrier[J].J Clin Invest,2011,121(1):31-3.
[2]Dagan R,Poolman J T,Zepp F.Combination vaccines containing DTPa-Hib:impact of IPV and coadministration of CRM197 conjugates[J].Expert Rev Vaccines,2008,7(1):97-115.
[3]Shinefield H R,Black S,Ray P,et al.Safety and immunogenicity of heptavalent pneumococcal CRM197 conjugate vaccine in infants and toddlers[J].Pediatr Infect Dis J,1999,18(9):757-63.
[4]Tsujioka H,Yotsumoto F,Hikita S,et al.Targeting the heparinbinding epidermal growth factor-like growth factor in ovarian cancer therapy[J].Curr Opin Obstet Gynecol,2011,23(1):24-30.
[5]Sanui A,Yotsumoto F,Tsujioka H,et al.HB-EGF inhibition in combination with various anticancer agents enhances its antitumor effects in gastric cancer[J].Anticancer Res,2010,30(8):3143-9.
[6]Gaillarda P J,Brinka A,De Boer A G.Diphtheria toxin receptortargeted brain drug delivery[J].Int Cong Ser,2005,1277:185-98.
[7]马 腾,刘啸白,薛一雪.RhoA在缓激肽选择性开放血肿瘤屏障中的作用[J].中国药理学通报,2011,27(2):187-91.
[7]Ma T,Liu X B,Xue Y X.Study of the effect of RhoA in bradykinin selectively increasing the permeability of blood-tumor barrier[J].Chin Pharmacol Bull,2011,27(2):187-91.
[8]乔文芳,刘 坤,薛一雪.罂粟碱与缓激肽配伍开放血肿瘤屏障机制的初探[J].中国药理学通报,2008,24(11):1436-40.
[8]Qiao W F,Liu K,Xue Y X.Elementary inquiry into the mechanism of annexation of bradykinin and papaverine on BTB opening[J].Chin Pharmacol Bull,2008,24(11):1436-40.
[9]Abbott N J,Rönnbäck L,Hansson E.Astrocyte-endothelial interactions at the blood-brain barrier[J].Nat Rev Neurosci,2006,7(1):41-53.
[10]Candela P,Gosselet F,Miller F,et al.Physiological pathway for low-density lipoproteins across the blood-brain barrier:transcytosis through brain capillary endothelial cellsin vitro[J].Endothelium,2008,15(5-6):254-64.
[11]Virgintino D,Robertson D,Errede M,et al.Expression of caveolin-1 in human brain microvessels[J].Neuroscience,2002,115:145-52.
[12]Roy U K,Henkhaus R S,Ignatenko N A,et al.Wild-type APC regulates caveolin-1 expression in human colon adenocarcinoma cell lines via FOXO1a and C-myc[J].Mol Carcinog,2008,47(12):947-55.
[13]Brunet A,Bonni A,Zigmond M J,et al.Akt promotes cell survival by phosphorylating and inhibiting a forkhead transcription factor[J].Cell,1999,96:857-68.

