钩藤生物碱对自发性高血压大鼠胸主动脉平滑肌细胞凋亡和增殖的影响
孙敬昌,齐冬梅,周洪雷,李运伦
(1.山东中医药大学,山东济南 250355;2.山东中医药大学附属医院,山东 济南 250011)
中药材钩藤含有钩藤碱、异钩藤碱、柯诺辛碱、异柯诺辛碱、柯楠因碱和二氢柯楠因碱等30余种生物碱,其中钩藤碱和异钩藤碱是其发挥降压效应的主要成分。前期研究表明钩藤碱和异钩藤碱对血管紧张素Ⅱ(AngⅡ)刺激所诱导血管平滑肌细胞(VSMC)增殖和凋亡均有干预效应[1-2],并能降低自发性高血压大鼠(SHR)胸主动脉和肠系膜动脉中膜厚度/管腔直径比值,改善胸主动脉和肠系膜动脉病理组织学损害[3],但能否影响SHR胸主动脉中膜平滑肌细胞的凋亡和增殖尚不清楚。本文研究钩藤碱、异钩藤碱和钩藤总生物碱对SHR胸主动脉平滑肌细胞凋亡率、凋亡平滑肌细胞mRNA表达、Bcl-2、Bax、c-fos、c-myc 蛋白表达和 PDGF-B mRNA 表达的影响,初步探讨其干预SHR胸主动脉平滑肌细胞增殖和凋亡的机制。
1 材料与方法
1.1实验动物♂SHR 40只,8周龄,体质量192~217 g,由北京市维通利华实验动物中心提供〔许可证:SCXK(京)2002-0003〕;♂ Wistar大鼠8只,8周龄,体质量195~225g,山东大学实验动物中心提供〔许可证:SCXL(鲁)20030004〕。
1.2试剂与材料钩藤碱、异钩藤碱和钩藤总生物碱:由山东中医药大学药学院周洪雷教授提供,纯度分别为99.7%、99.7%和80%,用前经0.1 mol·L-1HCl溶解后,分别用蒸馏水稀释为5、0.5和0.5 mg·L-1,调pH至7.2。置4℃冰箱保存备用,使用前振荡,充分摇匀。卡托普利:济南东风制药有限公司,鲁药准字(2001)第 027510号,生产批号:0208023,25 mg/片。实验前加生理盐水适量,配制成1.75 g·L-1的混悬液,置4℃冰箱保存备用。即用型SABC免疫组化检测试剂盒、亲和纯化c-myc鼠单抗IgG、亲和纯化c-fos兔多抗 IgG、亲和纯化Bax鼠单抗IgG、亲和纯化Bcl-2鼠单抗IgG、DAB显色剂、生物素化山羊抗兔IgG,武汉博士德生物工程有限公司;PDGF-B原位杂交检测试剂盒、细胞凋亡原位杂交检测试剂盒,北京中杉金桥生物制品有限公司产品;Annexin V-FITC apoptosis detection kit,美国BD Pharmingen公司产品。
1.3动物分组给药将SHR随机分为5组:模型组、卡托普利组、异钩藤碱组、钩藤碱组和钩藤总生物碱组。Wistar大鼠8只作为正常组。卡托普利组给药量为每天17.5 mg·kg-1,异钩藤碱组、钩藤碱组和钩藤总生物碱组的给药量分别为每天5、5和50 mg·kg-1,模型组和正常组给予等容量生理盐水。给药容积为每次10 ml·kg-1,灌胃给药,每周给药6 d,每天下午定时给药,连续8周,并随体质量变化调整给药量。
1.4动脉留取末次用药后24 h禁食不禁水12 h,用2%戊巴比妥钠2ml·kg-1体质量腹腔注射麻醉,下腔静脉取血。取血后立即从颈静脉穿刺插管,用4℃生理盐水约50 ml快速灌注冲洗,待冲洗液无色后,快速分离、摘取胸主动脉,剥离血管外膜,刮去血管内膜,分为3份:1份作凋亡率检测;1份10%甲醛固定,石蜡包埋,用于免疫组化检测;1份4%多聚甲醛固定,石蜡包埋,用于原位杂交检测。
1.5胸主动脉平滑肌细胞凋亡检测采用Annexin V-FITC结合PI染色、流式细胞术分析细胞凋亡率的方法。将胸主动脉中膜在4℃生理盐水中剪成约1 mm3小块,0.4%胰酶溶液 37℃消化 1 h,加DMEM终止消化,过100目滤网,800 r·min-1离心5 min,4℃ PBS液漂洗2次,用1×Binding buffer将洗过的细胞悬起,使成约1×109cells·L-1,取100 μl细胞悬液,加 5μl AnnexinV-FITC 和 10 μl PI溶液,轻轻混匀,暗处放置 15 min,加 400 μl 1 × Binding buffer,轻轻混匀,过300目滤网,上机分析。以Annexin V+/PI-为凋亡细胞。
1.6胸主动脉凋亡平滑肌细胞mRNA及PDGF mRNA表达检测采用原位杂交法,严格按照试剂盒说明进行操作。并用Image-Pro Plus 4.5图像分析软件对结果进行半定量分析,测定平均灰度,以此作为该样本凋亡平滑肌细胞的mRNA和PDGF mRNA的相对表达量。
1.7胸主动脉Bcl-2、Bax、c-myc和c-fos蛋白表达检测采用免疫组织化学SABC法:石蜡切片脱蜡至水,3%H2O2室温10 min,PBS洗5 min×3次,微波修复抗原,5%BSA封闭20 min,滴加亲和纯化Bcl-2或Bax鼠单抗IgG(1∶100倍稀释),湿盒内37℃ 1 h,PBS代替一抗作为阴性对照,PBS洗2 min×3次,滴加生物素化山羊抗兔 IgG,37℃ 20 min,PBS洗2 min×3次,滴加试剂 SABC,37℃ 20 min,PBS洗5 min×4次,DAB显色,镜下控制时间,蒸馏水洗涤,脱水,透明,中性树胶封片。任选5个视野用HPIAS-1000高清晰度彩色病理图文分析系统9.0测定积分光密度,以均值作为该样本Bcl-2、Bax的相对表达量。
1.8统计学处理数据以±s表示,应用SPSS10.0软件进行统计分析,多组间比较采用单因素方差分析。
2 结果
2.1对SHR胸主动脉平滑肌细胞凋亡率的影响如Tab 1示,与模型组相比,钩藤碱组、异钩藤碱组和钩藤总生物碱组大鼠胸主动脉平滑肌细胞凋亡率均增高(P<0.05)。
Tab 1 Comparison of thoracic aorta smooth muscle cell apoptosis in each group(±s,n=8)
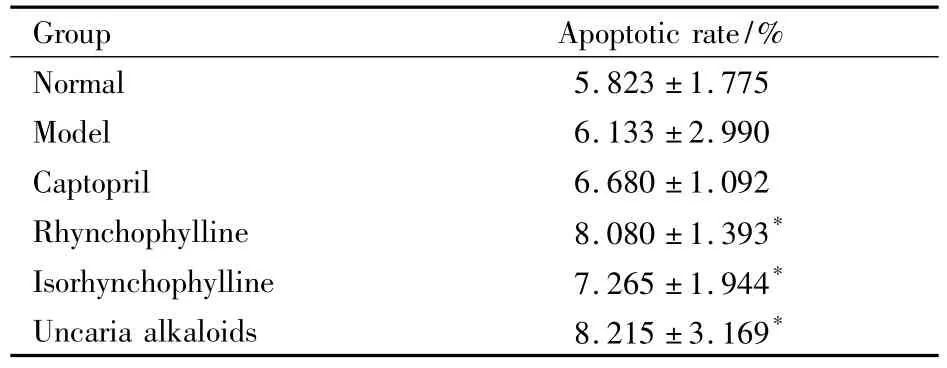
Tab 1 Comparison of thoracic aorta smooth muscle cell apoptosis in each group(±s,n=8)
*P<0.05 vs model
Group Apoptotic rate/%Normal 5.823 ±1.775 Model 6.133 ±2.990 Captopril 6.680 ±1.092 Rhynchophylline 8.080 ±1.393*Isorhynchophylline 7.265 ±1.944*Uncaria alkaloids 8.215 ±3.169*
2.2胸主动脉PDGF mRNA及凋亡平滑肌细胞mRNA表达如Tab 2所示,与模型组相比,钩藤碱组、异钩藤碱组和钩藤总生物碱组大鼠胸主动脉凋亡平滑肌细胞mRNA表达均增高(P<0.05),其中尤以异钩藤碱组和钩藤总生物碱组升高为明显(P<0.01)。与模型组相比,钩藤碱组、异钩藤碱组和钩藤总生物碱组大鼠胸主动脉平滑肌细胞PDGF mRNA表达明显降低(P<0.05)。
Tab 2 Comparison of the mRNA expression of thoracic aorta smooth muscle cell apoptosis in each group(±s,n=8)

Tab 2 Comparison of the mRNA expression of thoracic aorta smooth muscle cell apoptosis in each group(±s,n=8)
*P <0.05,**P <0.01 vs model
Group Apoptotic smooth muscle cell mRNA PDGF-B mRNA Normal 0.161 ±0.022 0.358 ±0.011 Model 0.222 ±0.021 0.412 ±0.011 Captopril 0.292 ±0.012** 0.409 ±0.004 Rhynchophylline 0.272 ±0.010* 0.378 ±0.013*Isorhynchophylline 0.289 ±0.023** 0.380 ±0.009*Uncaria alkaloids 0.283 ±0.005** 0.388 ±0.011*
2.3对胸主动脉Bcl-2和Bax蛋白表达的影响如Tab 3示,与模型组相比,异钩藤碱组大鼠胸主动脉平滑肌细胞Bcl-2蛋白表达明显降低(P<0.05)。与模型组相比,钩藤碱组、异钩藤碱组和钩藤总生物碱组大鼠胸主动脉平滑肌细胞Bax蛋白表达均升高(P<0.01)。
Tab 3 Comparison of the thoracic aorta protein expression of Bc1-2 and Bax in each group(±s,n=8)

Tab 3 Comparison of the thoracic aorta protein expression of Bc1-2 and Bax in each group(±s,n=8)
*P <0.05,**P <0.01 vs model
Group Bcl-2 Bax Normal 35.9 ±10.4 24.6 ±4.3 Model 74.2 ±12.5 34.6 ±5.4 Captopril 69.2 ±10.2 44.6 ±6.6**Rhynchophylline 62.1 ±8.5 48.7 ±6.7**Isorhynchophylline 59.2 ±11.2* 63.2 ±7.3**Uncaria alkaloids 63.2 ±8.3 57.8 ±6.2**
2.4对胸主动脉c-fos、c-myc蛋白表达的影响如Tab 4示,与模型组相比,钩藤碱组、异钩藤碱组和钩藤总生物碱组大鼠胸主动脉平滑肌细胞c-fos蛋白和c-myc蛋白表达降低(P<0.05)。
Tab 4 Comparison of the thoracic aorta protein c-fos and c-myc expression in each group(±s,n=8)

Tab 4 Comparison of the thoracic aorta protein c-fos and c-myc expression in each group(±s,n=8)
*P<0.05 vs model
Group c-fos c-myc Normal 114.0 ±10.8 21.2 ±10.1 Model 216.5 ±15.5 72.3 ±13.9 Captopril 146.1 ±8.9* 53.6 ±11.5*Rhynchophylline 126.4 ±7.5* 57.1 ±12.5*Isorhynchophylline 132.5 ±7.7* 34.3 ±17.8*Uncaria alkaloids 136.9 ±12.4* 42.9 ±2.8*
3 讨论
血管平滑肌细胞(VSMC)的增殖与凋亡是维持血管壁细胞数量相对恒定的一对基本因素,是血管重塑的细胞学基础。在高血压的病理进程中,VSMC的凋亡同增殖相伴行,正由于MSMC过度增殖、凋亡不足、增殖与凋亡之间的动态平衡被打破,导致血管壁异常增殖[4-5]。所以,在抑制VSMC增殖的同时,诱导VSMC凋亡不仅是抗血管重塑的基本策略,同时也是研制新型抗高血压药物的基本目标。
细胞凋亡是重要的生命现象之一,对于除去多余的有害或衰老细胞,调节细胞数量及维持组织构型具有重要意义。体外培养的大鼠VSMCs及高血压血管重塑的 VSMC都存在细胞凋亡现象[6-7]。VSMC发生过度凋亡是其由分化表型向去分化表型转化过程的一个重要病理特征,与VSMC异常增殖及成熟抑制状态相关[8],进一步的机制与上调Bax表达、caspase-3的激活及下调 Bcl-2的表达有关[9-10]。研究结果显示经钩藤碱、异钩藤碱和钩藤总生物碱干预后,SHR胸主动脉平滑肌细胞凋亡率及凋亡平滑肌细胞mRNA表达均增多,表明钩藤碱、异钩藤碱和钩藤总生物碱对SHR胸主动脉平滑肌细胞凋亡有诱导作用。
线粒体途径是最重要的细胞凋亡信号途径之一,Bcl-2家族蛋白是该途径的关键调节因素,对调控细胞凋亡有重要作用。Bax和Bcl-2是该家族中最重要成员,是一对正负凋亡调节基因,Bcl-2基因是哺乳动物重要的凋亡抑制基因,Bax是与Bcl-2功能相反的一个基因,促进细胞凋亡[11]。Bax的同源二聚体促进凋亡,Bcl-2的同源二聚体抑制细胞凋亡,Bax和Bcl-2形成的异源二聚体对凋亡无作用,Bcl-2高于Bax,Bcl-2的同源二聚体增多,细胞趋于存活,反之则细胞趋于凋亡,因此,Bcl-2/Bax值是反映细胞凋亡的敏感指标[12-13]。本研究显示,经钩藤碱和异钩藤碱干预后,SHR胸主动脉平滑肌细胞Bax蛋白表达上调、Bcl-2蛋白表达趋于下调,从而表明钩藤碱、异钩藤碱和钩藤总生物碱诱导SHR胸主动脉平滑肌细胞凋亡作用与从翻译水平调节Bax和Bcl-2表达相关联。
正常VSMC处于静止的非增殖状态,主要功能是调节血管张力[14]。VSMC增殖是高血压血管重塑的重要病理变化,是在各种外界剌激的作用下,细胞外信号经过细胞内信号传递系统到达核内,诱导一系列与VSMC增殖相关的基因表达,启动细胞周期,从而推动VSMC分裂、增殖的结果[15]。原癌基因的激活及其表达异常是VSMC增殖的内在基础,其中 c-myc 和 c-fos较受关注[16-17]。c-myc 和 c-fos基因编码产物c-myc蛋白和c-fos蛋白是细胞核内的DNA结合蛋白,与染色质DNA结合,对促进细胞从G0/G1期进入S期、完成DNA复制和转录具有关键意义。c-myc和c-fos基因的激活是VSMC增殖的始动因素[18],其表达增高与VSMC的增殖密切相关[19]。本实验发现,在SHR胸主动脉平滑肌细胞存在c-fos和c-myc蛋白高表达现象,经钩藤碱和异钩藤碱干预后,SHR胸主动脉平滑肌细胞c-myc和c-fos蛋白表达明显减弱,表明钩藤碱、异钩藤碱和钩藤总生物碱可通过下调原癌基因c-myc和c-fos蛋白表达来阻断SHR胸主动脉VSMC增殖效应。PDGF是VSMC强烈的促丝裂剂和趋化剂,其异常表达是SHR-VSMC生长加速的部分原因之一,与血管增殖病变密切相关[20-21]。本实验发现,钩藤碱、异钩藤碱和钩藤总生物碱能抑制SHR胸主动脉PDGF-B mRNA的表达,说明钩藤提取物可通过该途径抑制高血压患者胸主动脉壁平滑肌细胞的增殖。
综上所述,钩藤碱、异钩藤碱和钩藤总生物碱对SHR胸主动脉VSMC凋亡具有诱导作用,部分机制与下调Bcl-2蛋白表达、上调Bax蛋白表达有关;钩藤碱、异钩藤碱和钩藤总生物碱抑制SHR胸主动脉VSMC增殖的作用与下调c-myc和c-fos蛋白表达以及下调平滑肌细胞PDGF-B mRNA表达有关,体现出中药多途径、多靶点及整体调节的优势,从而可以推断钩藤碱、异钩藤碱和钩藤总生物碱对防治高血压血管重塑的发生发展具有积极意义。
[1]李运伦.钩藤碱和异钩藤碱抑制血管紧张素Ⅱ诱导血管平滑肌细胞增殖及相关机制[J].中国药理学通报,2008,24(1):53-8.
[1]Li Y L.Effect of rhynchophylline and isorhynchophylline on the proliferation of rat vascular smooth muscle cell induced by angiotensin Ⅱ[J].Chin Pharmacol Bull,2008,24(1):53 -8.
[2]李运伦.钩藤碱和异钩藤碱对血管紧张素Ⅱ致血管平滑肌细胞凋亡的影响及其机制[J].中国动脉硬化杂志,2008,16(9):681-4.
[2]Li Y L.Effect and mechanism of rhynchophylline and isorhynchophylline on the apoptosis of rat vascular smooth muscle cell induced by angiotensin Ⅱ[J].Chin J Arterioscl,2008,16(9):681-4.
[3]孙敬昌,周洪雷,齐冬梅,李运伦.钩藤提取物对自发性高血压大鼠动脉形态学及血管紧张素Ⅱ的影响[J].山东中医药大学学报,2011,35(4):351 -3.
[3]Sun J C,Zhou H L,Qi D M,Li Y L.Effect of Gouteng extract on artery morphology and angiotensin Ⅱof SHR[J].J Shandong Univ TCM,2011,35(4):351 -3
[4]Kockx M M,Knaapen M W.The role of apoptosis in vascular disease[J].J Pathol,2000,190(3):267 - 80.
[5]Khachigian L M.Catalytic oligonucleotides targeting EGR-1 as potential inhibitors of in-stent restenosis[J].Ann NY Acad Sci,2001,947:412-5.
[6]张 莉,张长平,李庆平.粉防己碱促进和敏化肾性高血压大鼠血管平滑肌细胞凋亡[J].中国临床药理学和治疗学,2007,12(4):412-6.
[6]Zhang L,Zhang C P,Li Q P.Tetrandrine induces and sensitizes vascular smooth muscle cell apoptosis in renovascular hypertensive rats[J].Chin J Clin Pharm Ther,2007,12(4):412 -6.
[7]Debbis D,Tea B S,Than V D,Hamet P.Smooth muscle apoptosis during vascular regression in spontaneously hypertensive rats[J].Hypertension,1997,29:340 -9.
[8]韩雅玲,徐红梅,邓 捷,等.E1A激活基因阻遏子过表达抑制体外人血管平滑肌细胞凋亡[J].生理学报,2006,58(4):324-30.
[8]Han Y L,Xu H M,Deng J,et al.Over-expression of the cellular repressor of E1A-stimulated genes inhibits the apoptosis of human vascular smooth muscle cellsin vitro[J].Acta Physiol Sin,2006,58(4):324-30.
[9]Cheng G,Shan J,Huang J,et al.Apoptosis induced by simvastatin in rat vascular smooth muscle cell through Ca2+-calpain and caspase-3 pendent pathway[J].Pharmacol Res,2003,48(6):571-8.
[10]Blanco-Colio L M,Villa A,Ortego M,et al.3-Hydroxy-3-methylglutaryl coenzyme A reductase inhibitors,atorvastatin and simvastatin,induce apoptosis of vascular smooth muscle cells by downregulation of Bcl-2 expression and Rho A prenylation[J].Atherosclerosis,2002,161(1):17 -26.
[11]牛英才,潘 志,李晓明,等.葛根异黄酮对 MPP+诱导的PC12细胞凋亡的保护作用[J].中国药理学通报,2009,25(1):112-5.
[11]Niu Y C,Pan Z,Li X M,et al.The protection action of total isoflavones from pueraria lobata against MPP+induced PC12 cellular apoptosis[J].Chin Pharmacol Bull,2009,25(1):112 - 5.
[12]万新红,邓利芝,陈朝霞,等.血管平滑肌细胞凋亡及Bcl-2和Bax蛋白表达在自发性高血压大鼠颈动脉血管间质胶原重构及逆转中的意义[J].介入放射学杂志,2004,12(suppl 2):197-200.
[12]Wan X H,Deng L Z,Chen Z X,et al.Vascular collagen remodeling,apoptosis and bcl-2/bax of vascular smooth muscle cells in carotid artery on SHR[J].J Intervent Radiol,2004,12(suppl 2):197-200.
[13]余良主,化长林,黄碧兰,朱晓琴.L-精氨酸对高血压大鼠主动脉平滑肌细胞凋亡的影响[J].咸宁学院学报(医学版),2006,20(5):396 -9.
[13]Yu L Z,Hua C L,Hang B L,Zhu X Q.Effect ofL-argine on the apoptosis of EH rat aorta vascular smooth muscle cell[J].J Xianning Coll(Med Sci),2006,20(5):396 -9.
[14]李 磊,戴 敏.动脉粥样硬化血管内皮分泌功能失调与平滑肌细胞增殖[J].中国药理学通报,2010,26(2):155 -8.
[14]Li L,Dai M.Research progress in osteopontin and pulmonary fibrosis[J].Chin Pharmacol Bull,2010,26(2):155 -8.
[15]许晓乐,张 伟,黄燕娟,王玉琴.二苯乙烯苷对平滑肌细胞增殖及其抗氧化作用的影响[J].中国药理学通报,2010,26(7):934-9.
[15]Xu X L,Zhang W,Huang Y J,Wang Y Q.Effect of 2,3,4,5-tetrahydroxystilbene-2-O-β-Dglucoside on proliferation and antioxidation of vascular smooth muscle cells[J].Chin Pharmacol Bull,2010,26(7):934 -9.
[16]刘艳春,刘 波,张 炎,姜宗来.低切应力对体外培养血管中膜平滑肌细胞原癌基因c-fos和c-myc表达的影响[J].生物物理学报,2004,20(6):434 -7.
[16]Liu Y C,Liu B,Zhang Y,Jiang Z L.Effect of low shear Stress on expression of c-fos and c-myc protein cultured arteryin vitro[J].Acta Biophys Sin,2004,20(6):434 -7.
[17]吴锦晖,章茂顺,王家良,符宗胤.醋柳黄酮及其单体对培养自发性高血压大鼠血管平滑肌细胞c-myc表达的影响[J].华西药学杂志,2001,16(1):72 -3.
[17]Wu J H,Zhang M S,Wang J L,Fu Z Y.The effect of TFH and its monomer on the c-myc expression in the vascular smooth muscle cells of SHR[J].West China J Pharm Sci,2001,16(1):72 -3.
[18]Braun Dullaeus R C,Mann M J,Sedding D G,et al.Cell cycle dependent regulation of smooth muscle cell activation[J].Arterioscler Thromb Vasc Biol,2004,24(5):845 -50.
[19]Hilker M,Tell nann G,Buerke M,et al.Expression of the proto oncogene c-myc in human stenotic aortocoronary by passgrafts[J].Patho Res Pract,2001,197(12):811 -6.
[20]李慧丽,黄定九.胰岛素对高血压大鼠血管平滑肌细胞血小板源生长因子A链和转化生长因子β1表达的影响[J].基础医学与临床,2001,21(1):28 -31.
[20]Li H L,Huang D J.The effect of insulin on PDGF chain A and expression of TGF β1[J].Basic Med Sci Clin,2001,21(1):28 -31.
[21]黄 警,黄燮南,张 纾,等.人参总皂苷对PDGF-BB所致血管平滑肌细胞增殖周期的影响[J].中国药理学通报,2010,26(6):787-91.
[21]Huang J,Huang X N,Zhang S,et al.Effect of total ginsenosides on the cell cycle of rat smooth muscule cell proferration induced by PDGF-BB[J].Chin Pharmacol Bull,2010,26(6):787 -91.

