内吗啡肽对小鼠树突状细胞免疫功能的影响
李正红,于 影,杨 锐,方迎艳,杨丽娟,高 琴
(蚌埠医学院生理学教研室,安徽蚌埠 233030)
内吗啡肽(endomorphins,EMs)是新发现的一种阿片样四肽。EMs有两种:内吗啡肽-1(EM-1)和内吗啡肽-2(EM-2)。它们有特异性的结构,对Mu阿片受体有很高的亲和力,被认为是Mu阿片受体的内源性配体[1]。EM-1和EM-2不仅参与镇痛、心血管、胃肠、内分泌等功能的调节,也参与对免疫功能的调节[2]。EM-1和EM-2在巨噬细胞/单核细胞中被检测到[3],它们可改变腹腔巨噬细胞的功能[4-6],包括抑制巨噬细胞的趋化性和超氧负离子的产生等。
树突状细胞(dendritic cells,DC)是目前发现的功能最强大的专职抗原递呈细胞(antigen presenting cells,APC),也是唯一能激活初始性T细胞的APC。DC的功能特点与其成熟状态密切相关,未成熟DC表达低水平的协同刺激分子和黏附分子,诱导T细胞的能力较弱,但是具有极强的吞噬和加工处理抗原能力。成熟DC细胞表面MHC-Ⅱ分子和协同刺激分子表达增加,其呈递抗原的能力增强,可与T细胞相互作用启动免疫应答。
既然DC是功能最强大的APC,并且有文献报道在人、鼠 DC可表达 Mu阿片受体[7],但 EMs对DC免疫功能的调节尚未见报道。本研究观察EMs对LPS活化DC过程中细胞表型、趋化性和T淋巴细胞增殖能力改变的影响,以期进一步揭示内吗啡肽的免疫调节作用。
1 材料与方法
1.1材料
1.1.1药品与试剂鼠源集落刺激因子(Pepro-Tech,Rocky Hill,NJ);CD11+磁珠(Miltenyi Biotech,Bergish-Gladbach,Germany);PE标记的DC特定的表面分子,如MHC classⅡ、CD11c、CD80、CD86购自 BD-Pharmingen。LPS(lipopolysacchairde,脂多糖)购自 Sigma Aldrich。CTOP(25 μmol·L-1,Mu阿片受体特异性拮抗剂,Sigma,MI)。T细胞尼龙毛柱购自伊普瑞斯科技有限公司。[3H]胸腺嘧啶核苷购自北京原子能研究所。
1.1.2实验动物C57BL/6J♀鼠,体质量18~22 g,购自北京协和医科大学实验动物研究所。
1.2方法
1.2.1骨髓来源的DC的制备与培养用 Inaba等[8]的方法来培养大量的DC,略作改动。将7~8周龄的正常C57BL/6J鼠颈椎脱位处死,无菌条件下取完整的股骨、胫骨,剔净周围组织,离断干骺端后,用皮试针抽吸RPMI 1640培养液冲洗髓腔,获得单细胞悬液;1 500 r·min-1离心10 min,弃上清后加入适量Tris-NH4Cl破解红细胞,再用PBS洗涤两次后用含10 μg·L-1GM-CSF、10%胎牛血清的RPMI 1640培养液重悬细胞,种于6孔板,接种密度为1 ×109·L-1~2 ×109·L-1、3 ~4 ml·well-1。d 3,轻轻吸弃未贴壁细胞、全量换液。d 5,吸弃半量培养基,并补充该量。d 6、d 7,收集悬浮和半贴壁细胞。
采用CD11c免疫磁珠进行磁性分选纯化DC。用20 mmol·L-1PBS洗涤细胞两次,加入CD11c免疫磁珠,4℃反应20 min,离心洗涤后将细胞悬液加入MS磁分离柱中进行分离纯化,获取CD11c+的骨髓来源的树突状细胞,所有操作根据autoMACS系统的厂商说明书进行。采用PE标记的仓鼠抗小鼠CD11c mAb,通过流式细胞仪(florescence-activated cell sorting,FACS)分析纯化前后的DC纯度。
1.2.2DC表面分子的检测流式细胞仪用于DC细胞表型分析。LPS激活的DC加入不同浓度的EM-1/EM-2,活化的DC不加入EMs用作对照。经过48h的培养,分析DC的表型,DC分别与下列抗体在 4℃ 孵育:CD11c、CD80、CD86 和 MHC classⅡ,20 min后,清洗3次,细胞经流式细胞仪分析。
1.2.3DC趋化性实验利用96 transwell趋化小室(Chemo TX system,Neuro Probe,MD,USA)和聚碳酸酯滤器(孔径5 μm)检测DC细胞迁移能力。DC的成熟需要 LPS(1 mg·L-1)培养 24 h。成熟的 DC 以 5 × 108·L-1的数目用 15 μmol·L-1Carboxy Fluoroscein Succinimidyl Ester(CFSE)(Invitrogen,CA,USA)标记20 min,然后冲洗2次。上层的隔室用有DC的200 μl细胞悬液RPMI 1640培养基,其中含有多种浓度的EM-1或-2,下层用含有 200 μg·L-1的趋化因子 CCL2、CCL3 和 CCL21(PeproTech)的0.5ml的培养基来填充。CTOP(25 μmol·L-1),是Mu阿片受体的特异性拮抗剂,在内吗啡肽(10-6mol·L-1)添加30 min之前加入到上室。每种条件设置3个平行实验。完整的小室放置在37℃的培养箱中培养90 min。培养之后,移除上层小室的细胞悬液,通过过滤器由上层迁移至下层小室的细胞可以用流式细胞仪完全计数。用下层小室中CSFE标记的DC的平均荧光强度(MFI)来表示结果。
1.2.4T淋巴细胞增殖反应的检测采用3H-TdR参入法。取正常C57/BL6小鼠脾脏,制备无菌的脾细胞悬液,以完全培养基悬浮,注入T细胞尼龙毛柱,置37℃,5%CO2孵箱培养1 h,冲出非黏附的细胞作为反应细胞(即纯化的T细胞),调节细胞浓度至 1 ×109·L-1,加入 96 孔圆底培养板,100 μl/孔;与此同时,培养7 d的DC经LPS刺激24 h,加入不同浓度的 EMs,或 CTOP 和 10-6mol·L-1的 EMs。处理的DC(5 000个)与105纯化的T细胞混合,并继续培养72 h,加入1.85×104Bq[3H]胸腺嘧啶核苷(thymidine),继续培养18 h。收集细胞,液闪计数仪检测cpm值,结果以3孔平均值表示。
1.3统计学分析Mann-Whitney U test用于比较不同试验组的不同。
2 结果
2.1EMs对DC表面分子表达的影响流式细胞仪的分析结果表明,CD11c阳性细胞纯度达95%以上。当用LPS刺激DC24h,细胞表面分子的表达上调。
LPS激活的DC加入不同浓度的EM-1/EM-2(10-6、10-8和 10-10mol·L-1),活化的 DC 不加入EM-1/EM-2用作对照。经过48 h的培养,检测DC表面分子的变化。结果表明,DC的表面膜分子MHC classⅡ、CD80和CD86,与LPS活化的DC组相比,没有明显的改变(Tab 1,EM-1/EM-2 10-8mol·L-1和 10-10mol·L-1的结果也是没有明显的改变,数据未列出)。
Tab 1 Expression levels of surface molecules in DCs(±s,%,)
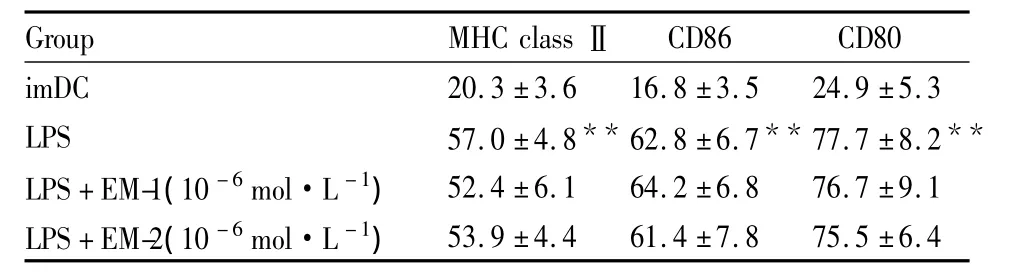
Tab 1 Expression levels of surface molecules in DCs(±s,%,)
imDC:Immature DCs;LPS:DCs cultured in the presense of LPS;**P <0.01 vs imDC
Group MHC classⅡCD86 CD80 imDC 20.3 ±3.6 16.8 ±3.5 24.9 ±5.3 LPS 57.0 ±4.8** 62.8 ±6.7** 77.7 ±8.2**LPS+EM-1(10 -6mol·L -1)52.4 ±6.1 64.2 ±6.8 76.7 ±9.1 LPS+EM-2(10 -6mol·L -1)53.9 ±4.4 61.4 ±7.8 75.5 ±6.4
2.2EMs抑制DC的趋化性为了证明EMs是否影响DC的趋化性,几种细胞因子包括CCL2、CCL3和CCL21被放置在小室的底部作为化学引诱物。CSFE-标记的 DC孵育在含有多种浓度EM-1/EM-2的上层孔室中,迁移到底部的DC的荧光强度可作为内吗啡肽对DC趋化性的抑制能力的评价。结果显示 EM-1 在浓度为10-6mol·L-1,EM-2 在浓度为10-7mol·L-1时,可以抑制 DC 的趋化性。预先CTOP处理,可以阻止这些内吗啡肽的抑制能力(Fig 1)。
2.3EMs处理的DC影响T淋巴细胞增殖反应DC的一个重要的功能就是指导T淋巴细胞的活化和增殖,引导获得性免疫的发展。由于T淋巴细胞可以表达Mu受体[9],因此为了排除T细胞上的效应,DC预先用LPS和多种浓度的激动剂EM-1和EM-2共孵育24h,然后用PBS洗去LPS和EMs。冲洗过的DC和同种基因型的T淋巴细胞共培养3 d。用3H-胸腺嘧啶核苷的参入来反映T淋巴细胞的增殖。如Fig 2所示,EM-1(10-6mol·L-1)或 EM-2(10-8和 10-6mol·L-1)处理的树突状细胞在与 T淋巴细胞共培养时,T淋巴细胞的增殖呈现出浓度依赖性的抑制。EM-1(10-6mol·L-1)和 EM-2(>10-8mol·L-1)明显地降低了细胞增殖的程度。CTOP预处理树突状细胞,T淋巴细胞的增殖反应不再降低,表现出与LPS活化的树突状细胞相似的增殖效果。实验结果说明,经EMs处理过的DC能抑制T淋巴细胞的增殖,这种抑制效应是由Mu受体介导的(Fig 2)。
3 讨论
EM-1和EM-2,作为内源性阿片类物质家族的一员,在1997年被Zadina等[1]发现。免疫细胞释放的类阿片活性肽不仅可以作用在神经元的阿片样受体[10],也可以作为有力的细胞内免疫应答的调控子影响免疫系统[11,20],这表明了通过类阿片活性肽和它们的受体可以进行双向的阿片能的神经免疫相互作用。近年来,越来越多的证据表明,EM-1和EM-2不仅参与炎症反应[12-13],而且它们可通过改变细胞因子的产生,来改变腹腔巨噬细胞的功能[4-6]。DC和巨噬细胞相似,都属于抗原提呈细胞,并且有文献报道在人、鼠DC可表达Mu阿片受体[7],而且我们以往的实验也发现EM-1和EM-2在树突状细胞可诱导性表达[14]。但是,目前关于EMs对DC的调节作用尚未见相关报道。
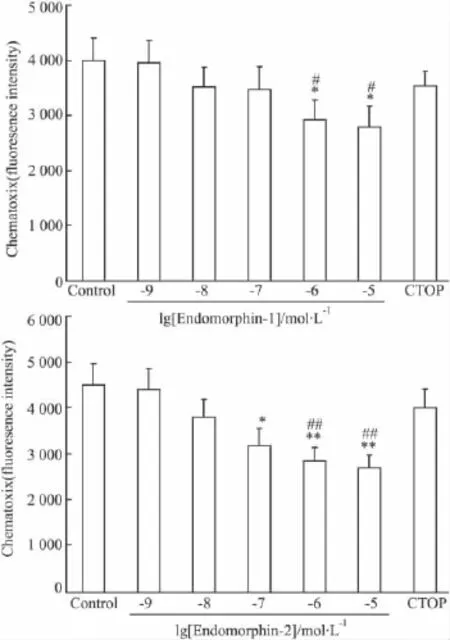
Fig 1 Endomorphin-1 and endomorphin-2 inhibit DCs chemotaxis
DC是最有效的抗原提呈细胞,在激活静止的T细胞和启动T细胞依赖的免疫应答中起特殊作用[19]。未成熟DC在摄取抗原或接受到某些刺激因素(如 LPS、TNF-α)后,细胞表面 MHC-Ⅱ分子和协同刺激分子表达增加,逐渐分化成熟,并同时向淋巴器官迁移。成熟DC在其表面将加工处理的抗原肽/MHC复合物呈递给T细胞,与T细胞相互作用发生免疫应答,该过程还需要协同刺激分子的参与,其中,最重要的是T细胞表面CD28与DC表面相应配体CD80和CD86的结合。因此,DC的成熟状态关系到能否激发有效的获得性免疫应答。本研究也证明了LPS激活DC后,其表面分子MHC classⅡ、CD80和 CD86表达增加,但是加入不同浓度的EM-1/EM-2共培养后,DC表面分子的表达没有明显改变,提示EMs可能不影响DC的表型分子表达。

Fig 2 Treatment by EM-1 or EM-2 impair the T cell stimulatory capacity of mDC
DC启动免疫反应的能力取决于它们特异的游走和向组织汇集的特点。DC可以有效的找到淋巴器官中T细胞区域,并与T细胞发生相互作用。在免疫应答的发展中,DC趋化性的调节起到重要的作用。有文献报道了吗啡可以抑制单核细胞的趋化性,支持了在单核细胞趋化性中Mu阿片受体和吗啡的调控作用[15]。近来的许多研究[12]也表明EM-1和EM-2可以抑制巨噬细胞的趋化性,并且具有抗炎作用。在本研究中,我们观察到EM-1和EM-2可以抑制DC的趋化性,并且这种抑制作用可以被Mu阿片受体的特异性拮抗剂CTOP逆转。我们的研究与EM-1和-2可以参与炎症反应或起始刺激的证据是一致的[16]。
DC的一个重要的功能就是指导T淋巴细胞的活化和增殖,引导获得性免疫的发展。由阿片肽引起的DC功能的变化,可以通过T细胞增殖来体现。本实验,我们首次报道EMs处理后的DC对T细胞增殖具有抑制效应。这样的抑制效应可以归结为在内吗啡肽处理后的DC中,抗炎的细胞因子IL-10的生成增加,和 IL-12、IL-23 的生成减少[17]。IL-12 主要由DC等在活化过程中产生、分泌,具有激活NK细胞、促进T细胞增殖、促进辅助性T细胞(T helper,Th)分化为 Th1 型细胞的作用[18]。
本实验结果表明,虽然EM-1和EM-2不影响DC表面分子的表达,但是EM-1和EM-2抑制DC的趋化性,抑制了DC对T淋巴细胞的增殖能力,提示EM-1和EM-2可能抑制了DC对T淋巴细胞的激活作用。推测M-1和EM-2可以通过影响DC、巨噬细胞等的免疫功能,调节先天的和适应性的免疫应答。
[1]Zadina J E,Hackler L,Ge J,et al.A potent and selective endogenous agonist for the mu-opiate receptor[J].Nature,1997,386(6624):499-502.
[2]任维华,霍笑风,吴 宁,等.内吗啡肽研究进展[J].中国药理学通报,2001,17(1):17 -20.
[2]Ren W H,Huo X F,Wu N,et al.Progress in the studies of endomorphins[J].Chin Pharmacol Bull,2001,17(1):17 - 20.
[3]Seale J V,Jessop D S,Harbu M S.Immunohistochemical staining of endomorphin 1 and 2 in the immune cells of the spleen[J].Peptides,2004,25(1):91 -4.
[4]Inui Y,Azuma Y,Ohura K.Differential alteration of functions of rat peritoneal macrophages responsive to endogenous opioid peptide endomorphin-1[J].Int Immunopharmacol,2002,2(8):1133 -42.
[5]Azuma Y,Ohura K.Endomorphin-2 modulates productions of TNF-alpha,IL-1beta,IL-10,and IL-12,and alters functions related to innate immune of macrophages[J].Inflammation,2002,26(5):223-32.
[6]Azuma Y,Ohura K.Endomorphins 1 and 2 inhibit IL-10 and IL-12 production and innate immune functions,and potentiate NF-kappaB DNA binding in THP-1 differentiated to macrophage-like cells[J].Scand J Immunol,2002,56(3):260 - 9.
[7]Makarenkova V P,Esche C,Kost N V,et al.Identification of delta-and mu-type opioid receptors on human and murine dendritic cells[J].J Neuroimmunol,2001,117(1-2):68 -77.
[8]Inaba K,Inaba M,Romani N,et al.Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor[J].J Exp Med,1992,176(6):1693-702.
[9]Borner C,Stumm R,Hollt V,et al.Comparative analysis of muopioid receptor expression in immune and neuronal cells[J].J Neuroimmunol,2007,188(1-2):56 -63.
[10]Cabot P J,Carter L,Schafer M,et al.Methionine-enkephalin-and Dynorphin A-release from immune cells and control of inflammatory pain[J].Pain,2001,93(3):207 -12.
[11]Salzet M,Vieau D,Day R.Crosstalk between nervous and immune systems through the animal kingdom:focus on opioids[J].Trends Neurosci,2000,23(11):550 -5.
[12]Jessop D S,Richards L J,Harbuz M S.Opioid peptides endomorphin-1 and endomorphin-2 in the immune system in humans and in a rodent model of inflammation[J].Ann N Y Acad Sci,2002,966:456-63.
[13]Mousa S A,Machelska H,Schafe M,et al.Immunohistochemical localization of endomorphin-1 and endomorphin-2 in immune cells and spinal cord in a model of inflammatory pain[J].J Neuroimmunol,2002,126(1-2):5 -15.
[14]李正红,高 琴,叶红伟,等.内吗啡肽在小鼠树突状细胞的诱导表达[J].中国药理学通报,2011,27(1):77-81.
[14]Li Z H,Gao Q,Ye H W,et al.Inducible expression of endomorphins in murine dendritic cells[J].Chin Pharmacol Bull,2011,27(1):77-81.
[15]Martucci C,Franchi S,Lattuada D,et al.Differential involvement of RelB in morphine-induced modulation of chemotaxis,NO,and cytokine production in murine macrophages and lymphocytes[J].J Leukoc Biol,2007,81(1):344 -54.
[16]Jessop D S.Endomorphins as agents for the treatment of chronic inflammatory disease[J].Bio Drugs,2006,20(3):161 -6.
[17]Li Z H,Chu N S,Shan L D,et al.Inducible expression of functional mu opioid receptors in murine dendritic cells[J].J Neuroimmune Pharmacol,2009,4(3):359 -67.
[18]Takei M,Umeyama A,Arihara S.Diterpenes inhibit IL-12 production by DC and enhance Th2 cells polarization[J].Biochem Biophys Res Commun,2007,355(3):603 -10.
[19]叶 红,余味一.药用真菌葡聚糖免疫调节作用的研究进展[J].中国药理学通报,2009,25(2):153 -6.
[19]Ye H,Yu W Y.Progress on the study of the immunomodulating action of glucans from macrofungi[J].Chin Pharmacol Bull,2009,25(2):153 -6.
[20]周 倩,李 俊,王婷玉,等.豹皮樟总黄酮对胶原性关节炎大鼠腹腔巨噬细胞产生细胞因子及其免疫功能的影响[J].中国药理学通报,2010,26(3):353 -8.
[20]Zhou Q,Li J,Wang T Y,et al.Effect of total flavonids of Litsea Coreana Leve on cytokines production and immunity of peritonealmacrophage from collagen-induced arthritis[J].Chin Pharmacol Bull,2010,26(3):353 -8.

