线粒体钙单向转运体在缺血后处理中对心肌保护的作用
俞图南,洪 浩,杨洁琼,高 琴,夏 强
(1.浙江大学医学院2004级七年制临床医学三系,浙江 杭州 310058;2.浙江大学医学院生理学系,浙江 杭州 310058)
缺血后处理(ischemic postconditioning)是指在心肌长时程缺血后,于复灌初期立即给予心肌反复多次的短暂的复灌、停灌,是近年心肌保护方面研究的热点之一。虽然缺血后处理的具体机制目前尚不完全清楚,但根据已有的研究,其涉及内源性腺苷、NO的释放、PI3kinase-Akt途径、胞膜/线粒体通道的改变[1-2]。线粒体机制已成为研究心肌缺血/复灌损伤机制的关键环节之一。线粒体钙单向转运体(mitochondrial ca1cium uniporter,MCU)是介导钙离子从线粒体外进入线粒体基质的重要转运体,对维持线粒体的钙基质稳态有重要的作用[3]。根据本实验室前期研究,线粒体钙单向转运体在缺血预处理、肿瘤坏死因子α诱导的心肌保护机制中发挥重要作用[4-5]。据此,本研究假设缺血后处理保护作用与钙单向转运体有关,对线粒体钙单向转运体在缺血后处理中的作用了进行探讨。
1 材料与方法
1.1 试剂 3-[4,5-dimethylthiazol-2-y1]-2,5diphenyhetrazolium bromide(MTT)、精 胺(spermine,Sper)、钌红(ruthenium red,RR)均为Sigma公司产品。
1.2 离体心脏Langendorff灌流和左室功能评价 雄性Sprague-Dawley大鼠,体重230~260 g(浙江大学动物中心提供),处死后迅速取出心脏,置于4℃改良Krebs-Henseleit(K-H)液中洗净血液,迅速转移、固定于Langendorff灌流装置,以改良K-H液行常规恒压(76 mmHg)灌流。改良K-H液成分(mmol/L):NaCl 118.0、KCl 4.7、K2PO41.2、MgSO41.2、NaHCO325.0、CaC121.25、葡萄糖 10.0,pH 7.3 ~ 7.4,以95%O2+5%CO2饱和,灌流液温度37℃。切开左心耳,将充水乳胶囊插入左心室,囊内压力经特氟纶管传递至压力传感器,由MedLab生物信号采集处理系统记录和分析。调节左心室内乳胶囊内水量,使左心室舒张末压(left ventricular end diastolic pressure,LVEDP)维持于4~8 mmHg,连续记录左心室发展压(1eft ventricular developed pressure,LVDP)、心 率(heart rate,HR)、心率与发展压的乘积(ratepressure product,RPP)、左心室内压最大上升和下降速率(maximalrise/fallrateofleft ventricular pressure,±dP/dtmax)指标。
1.3 缺血/复灌和缺血后处理的复制 本实验采用全心停灌的处理方法,以停止灌流30 min,恢复灌流120 min作为缺血/复灌过程。在停灌后复灌即刻立即给予6次全心停灌(10 s)/复灌(10 s)循环,共计 2 min[6],实现缺血后处理。
1.4 在复灌各时间点收集冠脉流出液 采用分光光度法测定乳酸脱氢酶(lactate dehydrogenase,LDH)的含量。
1.5 心肌formazan含量的测定 心脏从灌流装置上取下后切成薄片(1~2 mm),37℃水浴于1.25 g/L MTT中孵育30 min。取出心肌片,吸干其表面水分并称湿重,按5 ml/g的量加入二甲基亚砜后匀浆,匀浆液离心(1000 ×g,10 min),取上清液,测定其在550 nm处吸光度反映formazan的含量以观察心肌细胞的活性情况。
1.6 实验分组 大鼠随机分为4组,每组6只,各组样本来自同一批动物。①缺血/复灌组(ischemia/reperfusion,I/R):心脏平衡 20 min后,全心停灌30 min,然后复灌120 min;②缺血后处理组(ischemic postconditioning,Postcond):同I/R组,但在复灌初期立即给予反复6次短暂的全心停灌(10 s)/复灌(10 s)的循环,共计2 min;③精胺+后处理组(Postcond+Sper):在复灌期的前10 min给予钙单向转运体激动剂精胺(20 μmo/L)灌注,其余操作同缺血后处理组;④钌红+后处理组(Postcond+RR):在复灌期的前10 min给予钙单向转运体抑制剂钌红(5 μmo/L)灌注,其余操作同缺血后处理组。
2 结果
2.1 缺血后处理对心肌缺血/复灌损伤有保护作用 缺血后处理组在复灌期间,RPP、±dP/dtmax均明显高于I/R组(图1、表1)。复灌采样各时间点冠脉流出液中缺血后处理组LDH含量明显低于I/R组(P<0.01,表2),反映心肌细胞活动的心肌细胞formazan含量显著高于I/R组(1.47 ±0.11 vs 1.29 ±0.06,P <0.01,图2),提示缺血后处理有心肌保护作用。
2.2 精胺减弱缺血后处理的保护作用 精胺+后处理组在复灌期间 RPP、LVDP、±dP/dtmax较缺血后处理组均明显降低(图1、表1);与缺血后处理组相比,精胺+后处理组显著改变了复灌5 min时冠脉流出液LDH的释放(40.37±3.28 vs 26.85±4.86,P <0.01,表2)和心肌细胞活度formazan含量(1.34±0.05 vs 1.47±0.11,P<0.05,图2),提示精胺与后处理的联合处理减弱了后处理对左心室动力学功能的保护作用。
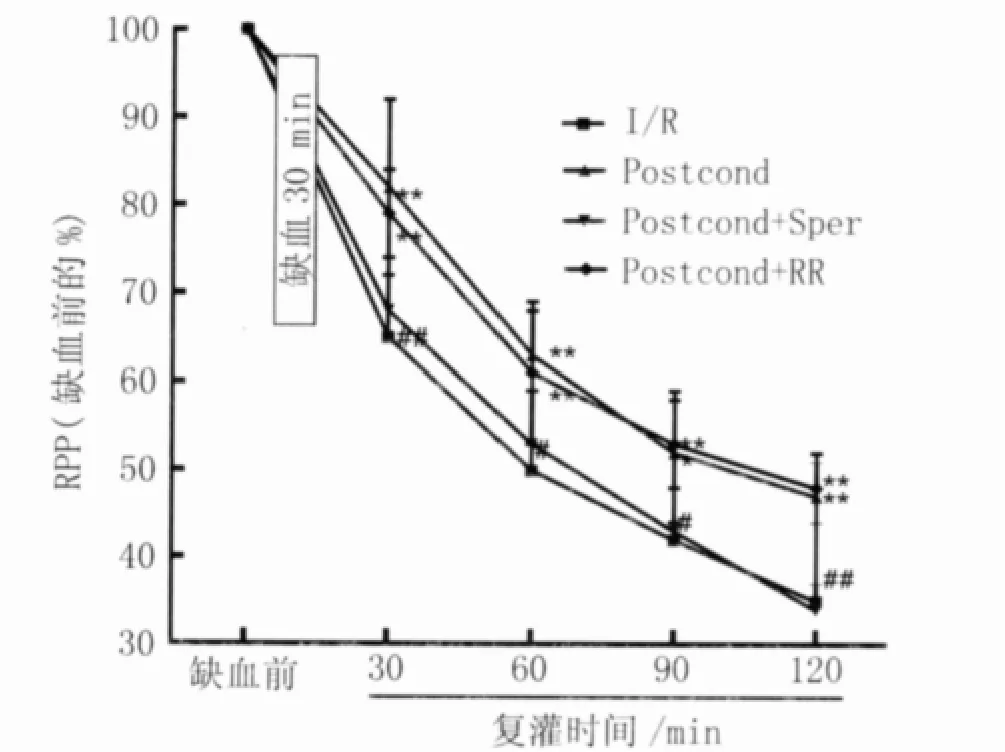
图1 缺血后处理、精胺(20 μmol/L)和钌红(5 μmol/L)对离体心脏复灌后各时间点心率与发展压乘积的影响Fig.1 Effect of ischemic postconditioning,spermine(20 μmol/L)and ruthenium red(5 μmol/L)on rate-pressure product of the isolated hearts after reperfusion
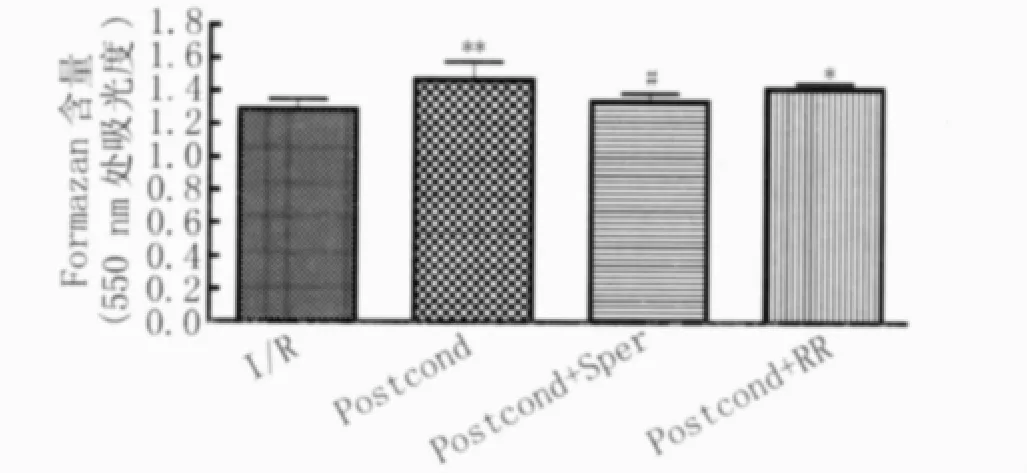
图2 缺血后处理、精胺(20 μmol/L)和钌红(5 μmol/L)对离体心脏复灌120 min后心肌formazan含量的影响Fig.2 Effectofischemic postconditioning,spermine(20 μmol/L)and ruthenium red(5 μmol/L)on the content of formazan extracted from the isolated hearts after reperfusion of 120 min
表1 缺血后处理、精胺(20 μmol/L)和钌红(5 μmol/L)对离体心脏复灌后各时间点左心室发展压和左心室内压最大上升和下降速率的影响Table 1 Effect of ischemic postconditioning,spermine(20 μmol/L)and ruthenium red(5 μmol/L)on left ventricular developed pressure and maximal rise/fall rate of left ventricular pressure of the isolated hearts after reperfusion(n=6,,缺血前%)
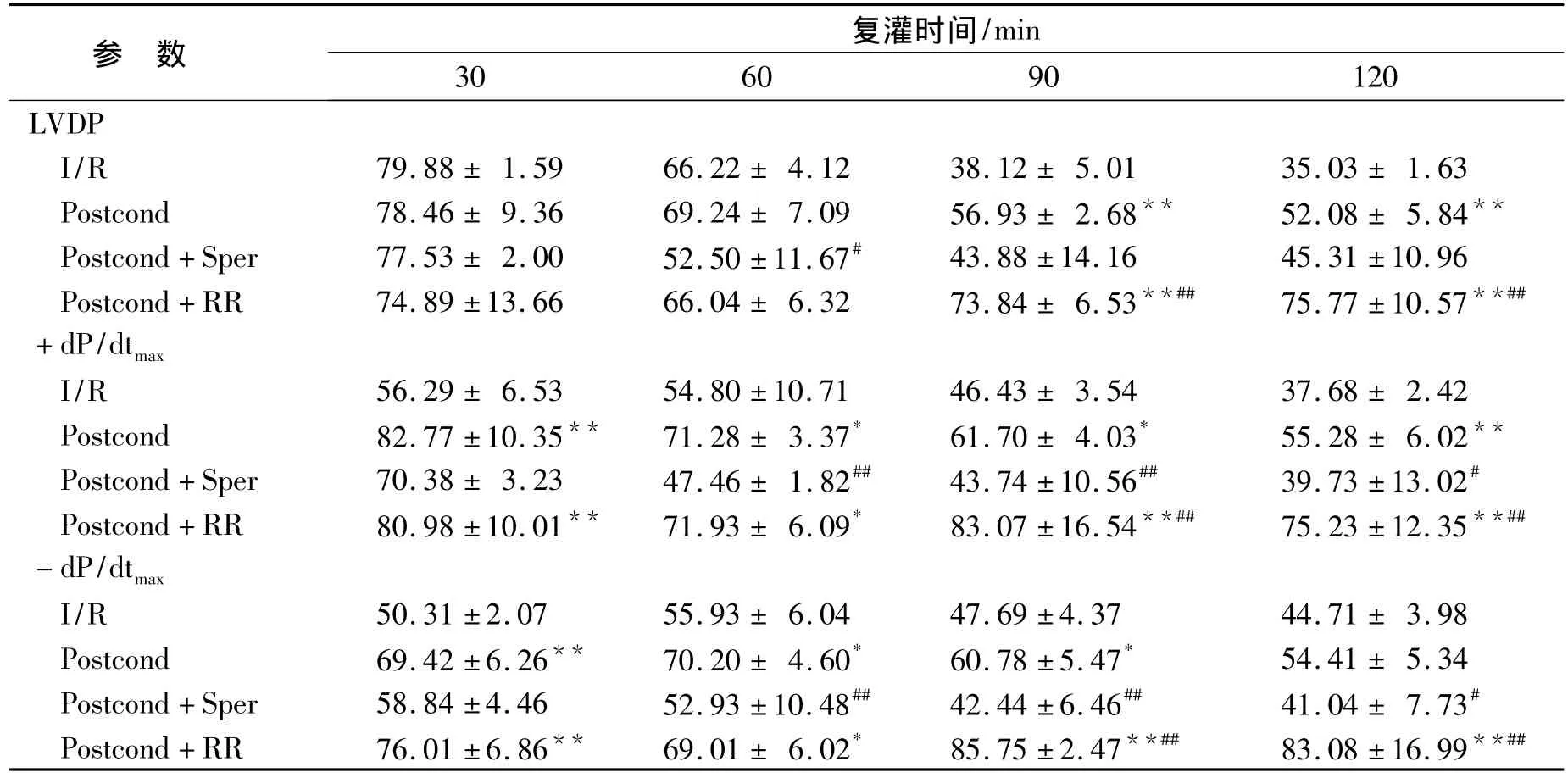
表1 缺血后处理、精胺(20 μmol/L)和钌红(5 μmol/L)对离体心脏复灌后各时间点左心室发展压和左心室内压最大上升和下降速率的影响Table 1 Effect of ischemic postconditioning,spermine(20 μmol/L)and ruthenium red(5 μmol/L)on left ventricular developed pressure and maximal rise/fall rate of left ventricular pressure of the isolated hearts after reperfusion(n=6,,缺血前%)
与 I/R 组比较,*P <0.05,**P <0.01;与 Postcond 组比较,#P <0.05,##P <0.01.
参 数复灌时间/min 30 60 90 120 LVDP I/R 79.88 ± 1.59 66.22 ± 4.12 38.12 ± 5.01 35.03 ± 1.63 Postcond 78.46 ± 9.36 69.24 ± 7.09 56.93 ± 2.68** 52.08 ± 5.84**Postcond+Sper 77.53 ± 2.00 52.50 ±11.67# 43.88 ±14.16 45.31 ±10.96 Postcond+RR 74.89 ±13.66 66.04 ± 6.32 73.84 ± 6.53**## 75.77 ±10.57**##+dP/dtmax I/R 56.29 ± 6.53 54.80 ±10.71 46.43 ± 3.54 37.68 ± 2.42 Postcond 82.77 ±10.35** 71.28 ± 3.37* 61.70 ± 4.03* 55.28 ± 6.02**Postcond+Sper 70.38 ± 3.23 47.46 ± 1.82## 43.74 ±10.56## 39.73 ±13.02#Postcond+RR 80.98 ±10.01** 71.93 ± 6.09* 83.07 ±16.54**## 75.23 ±12.35**##-dP/dtmax I/R 50.31 ±2.07 55.93 ± 6.04 47.69 ±4.37 44.71 ± 3.98 Postcond 69.42 ±6.26** 70.20 ± 4.60* 60.78 ±5.47* 54.41 ± 5.34 Postcond+Sper 58.84 ±4.46 52.93 ±10.48## 42.44 ±6.46## 41.04 ± 7.73#Postcond+RR 76.01 ±6.86** 69.01 ± 6.02* 85.75 ±2.47**## 83.08 ±16.99**##
表2 离体心脏复灌初期各时间点的灌流液中乳酸脱氢酶含量的变化Table 2 The changes of lactate dehydrogenase content in the coronary effluent of isolated hearts after reperfusion(n=6,,U·L-1)

表2 离体心脏复灌初期各时间点的灌流液中乳酸脱氢酶含量的变化Table 2 The changes of lactate dehydrogenase content in the coronary effluent of isolated hearts after reperfusion(n=6,,U·L-1)
与 I/R组比较,**P <0.01;与 Postcond组比较,#P <0.05,##P <0.01.
组 别复灌时间/min 10 20 30 I/R 75.55 ±18.92 78.85 ±13.91 52.50 ±16.56 32.550 ±2.50 Postcond 26.85 ± 4.86** 15.75 ± 4.50** 10.95 ± 2.33** 12.00 ±8.00**Postcond+Sper 40.37 ± 3.28**## 22.45 ± 2.52** 18.14 ± 5.08** 14.26 ±3.20**Postcond+RR 14.50 ± 6.54**# 18.63 ± 6.48** 16.50 ± 3.25* 9.00 ±2.14**
2.3 钌红增强缺血后处理的保护作用 与I/R组相比,钌红与后处理联合应用RPP、LVDP、±dp/dtmax均明显增高(图 1、表 1),LDH 释放减少(表2),心肌细胞活度formazan含量增高(1.42±0.03 vs 1.29±0.06,P <0.05,图2);同时,与缺血后处理组相比,其动力学各项指标明显升高(表1),复灌5 min时冠脉流出液LDH的释放减少(14.50±6.54 vs 26.85±4.86,P<0.05,表2),提示钌红和缺血后处理联合应用进一步增强后处理的保护作用。但心肌细胞活度formazan含量无明显增加(1.42±0.03 vs 1.47±0.11,P >0.05,图2)。
3 讨论
离体心脏Langendorff灌流模型自1895年发明以来,就显示出了其简易、稳定性高的特点。以往的研究发现,在无附加处理的数小时内离体心脏形态和功能基本保持稳定,不会影响实验研究[7-9]。本实验在Langendorff灌流模型上研究线粒体钙单向转运体在心肌缺血后处理保护中的机制。本实验结果显示,缺血后处理可明显减少大鼠离体心脏缺血/复灌后心肌细胞死亡,减少心肌损伤标志酶LDH的漏出,改善灌注后左心室收缩功能。线粒体钙单向转运体开放剂精胺减弱了缺血后处理的心肌保护作用,提示缺血后处理的心肌保护作用可能与抑制钙单向转运体有关。同时,本研究结果显示:钙单向转运体抑制剂钌红与后处理联合应用能增强后处理改善心室动力学指标的作用和减少冠脉流出液LDH的释放,提示后处理可能只是部分拮抗了线粒体钙单向转运体的活动,钌红抑制线粒体钙单向转运体开放可加强后处理的心肌保护作用。
已有文献报道,后处理减少了复氧初期氧自由基的大量产生和脂质过氧化程度,同时降低了胞浆内和线粒体内Ca2+浓度而发挥抗心肌细胞缺氧/复氧损伤作用[10]。本实验室已报道,钙单向转运体拮抗剂钌红可明显减弱离体大鼠心脏缺血/复灌对心脏的损伤,减少氧自由基的释放,其机制可能与钌红和线粒体钙单向转运体上Ca2+低亲和力位点结合,使其构象改变,阻断复灌过程中Ca2+过多进入线粒体,减少线粒体钙超载,从而减轻心肌细胞损伤有关[11]。精胺可以和线粒体S1与S2(主要是S1)精胺结合位点结合,通过构象改变作用促进胞浆内的Ca2+向线粒体内流,从而增加线粒体钙超载,加重缺血/复灌损伤。本实验中线粒体钙单向转运体开放剂精胺减弱了缺血后处理的保护作用,推测可能是其通过增加线粒体钙超载对抗后处理降低胞浆和线粒体内钙浓度增加的作用;而线粒体钙单向转运体抑制剂钌红增加后处理的保护作用可能是进一步降低钙超载而完成。其具体机制还有待进一步深入研究。
综上所述,缺血后处理可能通过抑制线粒体钙单向转运体来实现保护作用。
[1]ZHAO Z Q,CORVERA J S,HALKOS M E,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-H588.
[2]VINTEN-JOHANSEN J,ZHAO Z Q,ZATTA A J,et al.Postconditioning-A new link in nature's armor against myocardial ischemia-reperfusion injury[J].Basic Res Cardiol,2005,100(4):295-310.
[3]KIRICHOK Y,KRAPIVINSKY G,CLAPHAM D E.The mitochondrial calcium uniporter is a highly selective ion channel[J].Nature,2004,427(6927):360-364.
[4]ZHANG S Z,GAO Q,CAO C M,et al.Involvement of the mitochondrial calcium uniporter in cardioprotection by ischemic preconditioning[J].Life Sci,2006,78(7):738-745.
[5]GAO Qin,ZHANG Shi-zhong,MAO Huan-hao,et al(高 琴,张世忠,茅焕豪,等).Mitochondrial calcium uniporter participates in TNF-alpha induced cardioprotection in isolated rat hearts subjected to ischemia/reperfusion[J].Chin J Appl Physiol(中国应用生理学杂志),2006,22(3):278-282.(in Chinese)
[6]YANG X M,PHILIPP S,DOWNEY J M,et al.Postconditioning's protection is not dependent on circulating blood factorsorcellsbutinvolves adenosine receptors and requires PI3-kinase and guanylylcyclase activation [J].Basic Res Cardiol,2005,100(1):57-63
[7]SUTHERLAND F J,HEARSE D J.The isolated blood and perfusion fluid perfused heart[J].Pharmacol Res,2000,41(6):613 -627.
[8]FAGHIHI M,MIRERSHADI F,DEHPOUR A R,et al.Preconditioning with acute and chronic lithium administration reduces ischemia/reperfusion injury mediated by cyclooxygenase not nitric oxide synthase pathway in isolated rat heart[J].Eur J Pharmacol,2008,597(1-3):57-63.
[9]EBRAHIMI S,FAGHIHI M,KESHAVARZ M,et al.Anti-infarct effect of magnesium is not mediated by adenosine A1 receptors in rat globally ischaemic isolated hearts[J].Clin Exp Pharmacol Physiol,2004,31(12):868-872.
[10]SUN H Y,WANG N P,KERENDI F,et al.Hypoxic postconditioning reduces cardiomyocyte loss by inhibiting ROS generation and intracellular Ca2+overload [J].Am J Physiol Heart Circ Physiol,2005,288(4):H1900-1908.
[11]YE Ting-mei,ZHANG Shi-zhong,XIA Qiang,et al(叶挺梅,张世忠,夏 强,等).Role of mitochondrialcalcium uniporterin myocardial hypoxia/reoxygenation induced injury[J].Chin J Appl Physiol,(中国应用生理学杂志),2006,22(2):136-140.(in Chinese)

