CASP3基因多态及单体型分布与乳腺癌危险性的关联研究
倪 勤,刘 冰,金明娟,马新源,姚开颜,李其龙,陈 坤
(1.浙江大学公共卫生学院流行病学与卫生统计学系,浙江 杭州 310058;2.浙江省嘉善县肿瘤防治所,浙江 嘉善 314100)
乳腺癌是世界上女性最高发的恶性肿瘤。少见的高外显基因BRCA1、BRCA2为乳腺癌的易感基因,但是只有约5% ~10%的乳腺癌发生归因于这些易感基因的突变[1]。因而,人群中更为普遍的、低外显率的弱易感基因可能与内源性危险因素、不良生活方式共同作用,对散发性乳腺癌的形成起到促进作用。
Caspase级联凋亡通路中的效应子有CASP3、CASP6和 CASP7,其中 CASP3是最重要的凋亡效应子,与DNA断裂、染色质凝聚和凋亡小体形成有关。而CASP6和CASP7即使被大量消耗,对凋亡级联反应的影响也相当微小[2]。CASP3基因定位于 4q35.1 区,编码的前体蛋白含有277个氨基酸,分子量约32 kD。CASP3前体蛋白在活化过程中从Asp28~Ser29和Asp175~Ser176两处被剪切,形成P17(29~175)和P10(182~277)两个片段,两种亚基再组成活性形式的CASP3,随后则可进行下一步的自我催化。国外文献报道,CASP3基因多态与肺癌、卵巢癌、非霍奇金淋巴瘤发病密切相关[3-8],但是与乳腺癌易感性的相关研究尚未见报道。为了较全面地分析CASP3基因多态性与乳腺癌的易感性关联,本研究采用Tag SNP的方法选择单核苷酸多态性位点,以提高关联分析的有效性。
1 材料和方法
1.1 研究对象 本研究以浙江省嘉善县为研究现场,采用1∶1匹配的病例对照研究设计。乳腺癌病例均来自2005年5月-2008年5月在浙江嘉善县开展的现场病例。根据当地恶性肿瘤登记报告记录,251例乳腺癌均经病理组织学确诊。同时,按每个病例同居住地和同年龄(±5岁)的原则,选取健康对照者。研究对象共502例,均为女性,且是嘉善永久居民,由统一培训的调查员上门进行问卷调查。
1.2 血样采集及基因组DNA的提取 经研究对象知情同意后,每一个体采集静脉血5 ml,2 ml装入带有0.2 ml枸橼酸钠的真空小试管,3 ml装入无抗凝试剂的真空试管,放入-20℃冰箱保存。储存样品于1周内送回浙江大学医学院,取枸橼酸钠抗凝血1 ml,以RelaxGene血液基因组DNA抽提试剂盒(Tiangen生化科技,北京,中国)抽提全血基因组DNA后,于-20℃冰箱储存待检。
1.3 TagSNP的选取 根据 Hapmap数据库(http://www.hapmap.org)中 CHB(Chinese Han origin in Beijing,中国汉族)数据,运用Haploview软件进行TagSNP的选择。TagSNP的选取原则:①SNP位于CASP3基因区域内;②MAF>0.05;③TagSNP能代表1个以上的SNP,且 r2>0.8。共选取 3 个 TagSNPs,分别为rs4647693、rs2696056 和 rs4647610。
1.4 基因型检测 采用聚合酶链反应-限制性片段长度多态(PCR-RFLP)的方法对所有研究对象进行基因型的检测。本研究使用Primer Premier 5.0软件进行引物设计,然后在BLAST数据库中评价引物的特异性,最后在Oligo 6.0软件中分析引物对的二级结构,选取最优引物以保证实验能高效进行。rs4647693位点的上下游引物分别为5'-AATTCTGTTGCCACCTTTCG-3'和5'-ACCTTCTGCGTGTTTGCTC-3';rs2696056位点的上下游引物分别为5'-TTTCCACCAC CACTCTGATA-3'和 5'-ATTATGGCTGTTTCC CTTTT-3';rs4647610位点的上下游引物分别为5'-AACCGCTTGAAGAAATCCTG-3'和5'-ATC TGCCTTGTTGAGCCACT-3'。所有引物均由上海生物工程公司合成。PCR反应体系均为20 μl,包括 10 × PCR buffer 2 μl,25 mmol/L MgCl21.6 μl,2 mmol/L dNTPs 2 μl,DMSO 1 μl,10 μmol/L 引物各 0.2 μl,Taq DNA 聚合酶 0.5 U,约 50 ng 基因组 DNA 0.5 μl,由双蒸水稀释至 20 μl。扩增条件为:94℃预变性 5 min,94℃变性 30 s,在各位点退火温度(rs4647693:56℃、rs2696056:52℃、rs4647610:57℃)退火30 s,72℃延伸30 s,循环34次,最后72℃延伸5 min。使用的仪器为PTC-200型PCR扩增仪(Bio-Rad,USA)。
PCR扩增后产物进行酶切分型。酶切总反应体系为 8 μl,包括 10×反应缓冲液 0.8 μl,10 U/μl限制性内切酶 0.3 μl,双蒸水 1.9 μl,PCR 扩增产物 5.0 μl。酶切产物经 37℃ 水浴6 h后,在2.5%的琼脂糖凝胶中电泳约20 min,然后在凝胶成像系统中观察电泳结果并进行基因型的判定。限制性内切酶Alw26l识别rs4647693多态位点,AA基因型产生443 bp 1个片段,AG 基因型产生443、246、197 bp 3个片段,GG基因型产生246、197 bp 2个片段;限制性内切酶DdeI识别rs2696056多态位点,GG基因型产生139 bp 1个片段,GC基因型产生139、105、34 bp 3 个片段,CC 基因型产生 105、34 bp 2个片段;限制性内切酶 HinfI识别rs4647610多态位点,AA基因型产生230 bp 1个片段,AG基因型产生230、178、52 bp 3个片段,GG基因型产生178、52 bp 2个片段(图1~图3)。
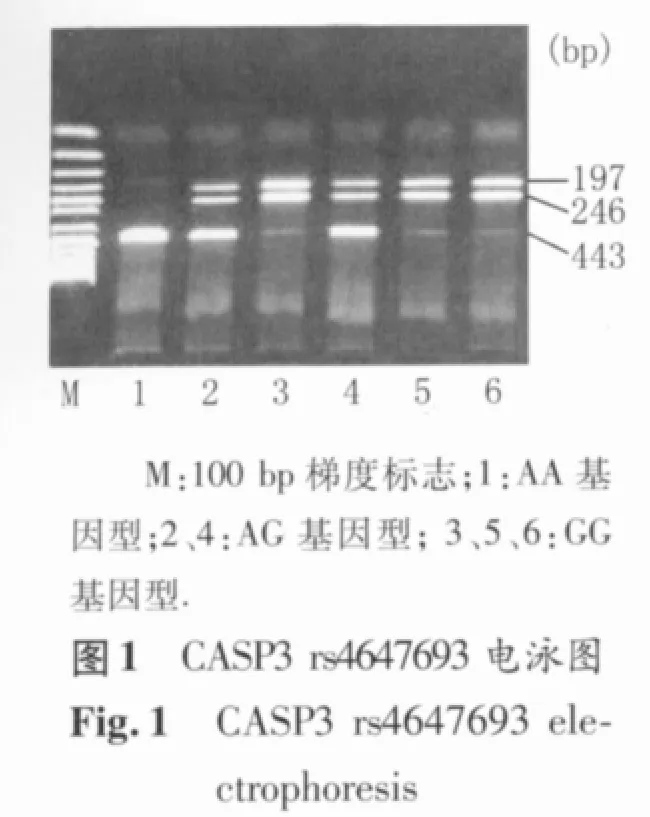
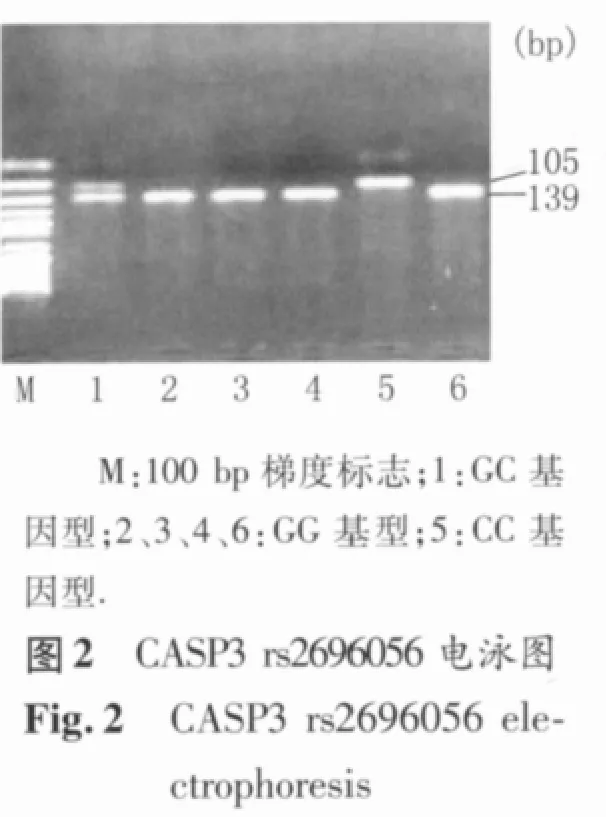
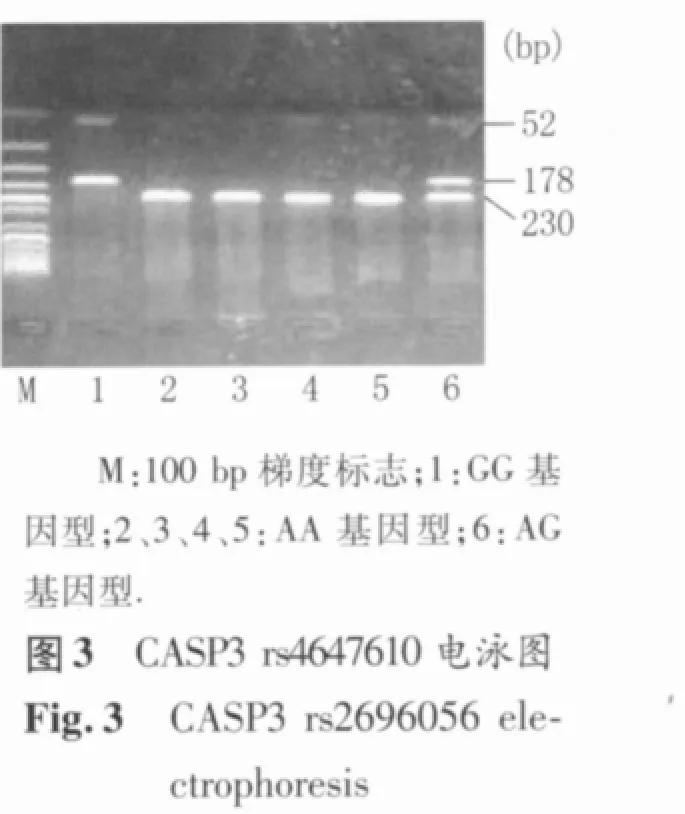
1.5 统计学方法 采用似然比χ2检验对照组中的基因型分布进行Hardy-Weinberg(H-W)平衡分析;分类变量和连续性变量在乳腺癌组和对照组中的分布比较分别采用Pearson χ2检验和Student-t检验;采用非条件logistic回归模型计算表示相对危险度的比值比(odds ratio,OR)及其95%可信区间(confidential interval,CI),并以年龄、生活方式因素和生理生育因素进行校正;采用PHASE软件对CASP3单体型进行评估和计算;以P<0.05为差异有统计学意义。以上统计分析均在SPSS 16.0 for Windows中进行。
2 结果
2.1 一般情况分析 乳腺癌组年龄为(54.87±11.20)岁,对照组年龄为(54.88 ± 11.46)岁,经t检验显示两组间年龄分布差异无统计学意义(P>0.05)。以对照组初潮年龄中位数(16岁)分组,两组间初潮年龄分布差异有统计学意义(P=0.007);以对照组初孕年龄中位数(24岁)分组,两组间分布有统计学差异(P=0.002);以对照组末孕年龄中位数29岁分组,未发现两组间分布有统计学差异。其余吸烟、饮酒、饮茶、女性生理生育因素在两组间的频率分布均无统计学差异(表1)。
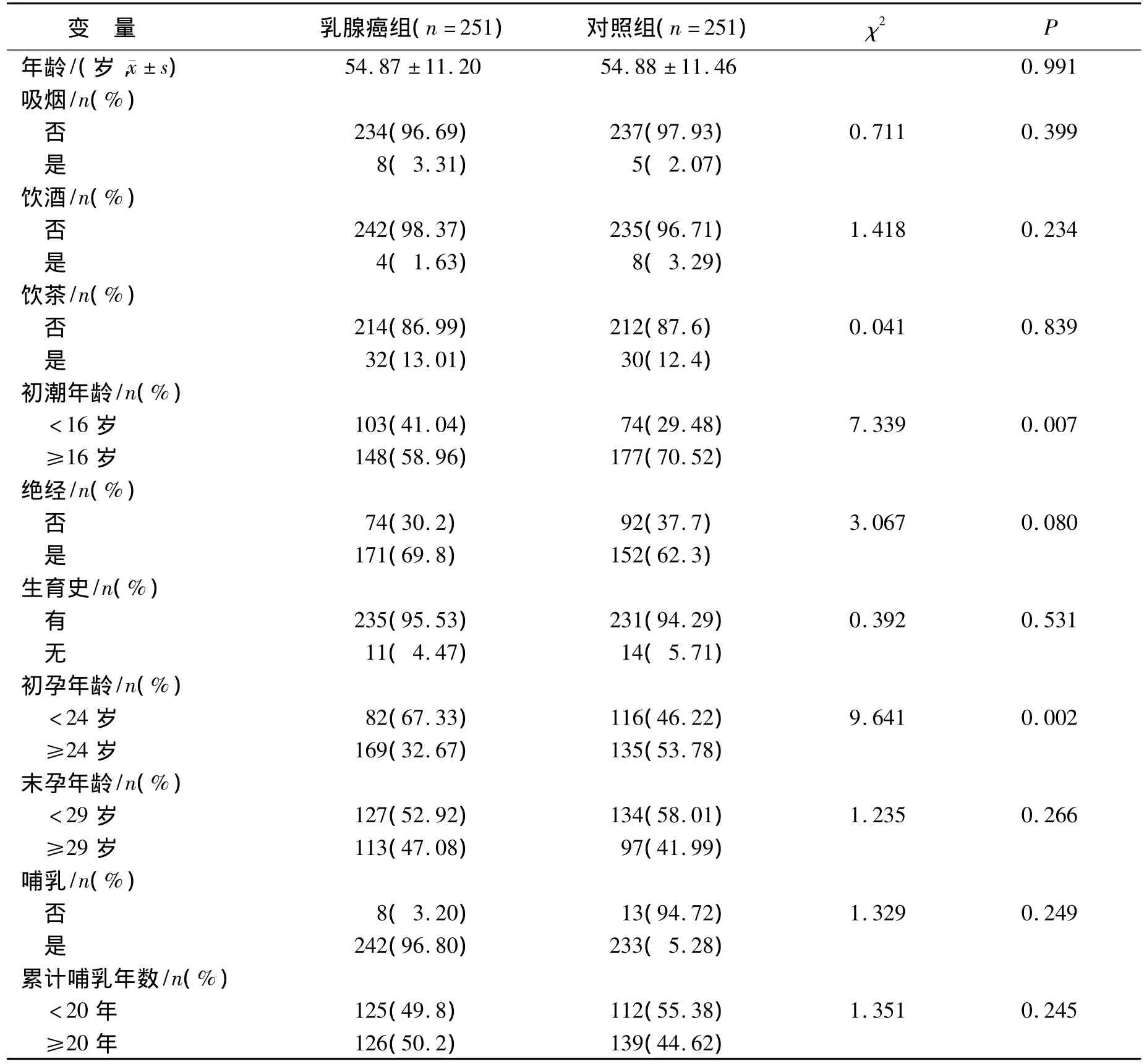
表1 研究对象的一般情况Table 1 The distribution of demographic characteristics among cases and controls
2.2 CASP3基因型频率分布及危险度分析对照组中CASP3和CASP9的基因型频率分布均符合 Hardy-Weinberg平衡(P>0.05),说明具有较好的人群代表性。由表2可见,CASP3基因rs4647693多态性的GG、AG、AA 3种基因型在乳腺癌组中的频率分布分别为67.87%、28.11%和4.02%;在对照组中的频率分布分别为 63.16%、29.96% 和 6.88%;rs2696056 GG、GC、CC 3种基因型在乳腺癌组中的频率分布分别为 80.00%、19.60% 和 0.40%;在对照组中的频率分布分别为82.73%、16.47%和0.80%;rs4647610 AA、AG、GG 3 种基因型在乳腺癌组中的频率分布分别为51.41%、38.15%和10.44%;在对照组中的频率分布分别为51.82%、37.25% 和 10.93%;经 χ2检验均无统计学差异(P>0.05)。经过年龄、吸烟、饮酒等因素调整后,未发现CAPSP33 个SNP与乳腺癌发病风险间存在有统计学意义的相关。
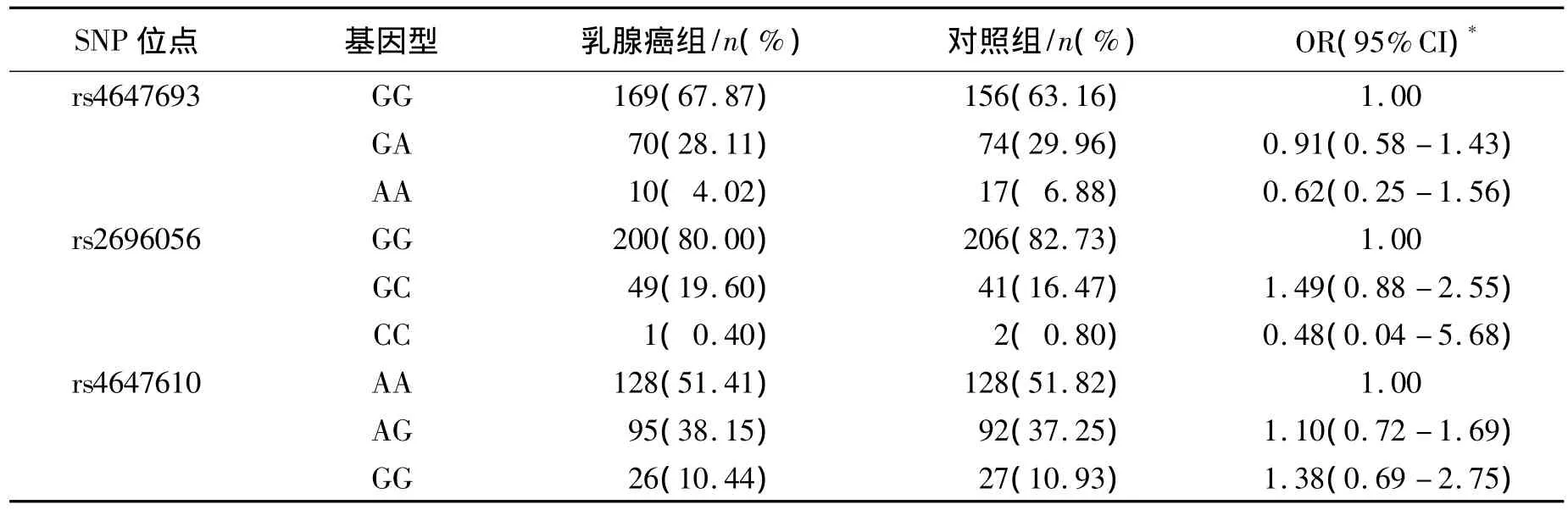
表2 CASP3 TagSNPs基因多态与乳腺癌患病风险的关联分析Table 2 CASP3 TagSNP polymorphisms and their association with the risk of breast cancer
CASP3单体型分析结果显示,GGA是最常见的单体型,其在乳腺癌组和对照组中分别占66.93%和65.54%,其次为AGG单体型,在乳腺癌组和对照组中分别占14.74%和16.33%;位居第三的是GCG单体型,在乳腺癌组和对照组中分别占9.36%和8.57%;其余单体型的构成均不足5%。CASP3的单体型在两组间的分布无统计学差异(χ2=4.694,P=0.584)。以单体型GGA作为参照,未发现其他单体型与乳腺癌遗传易感性存在统计学关联(表3)。
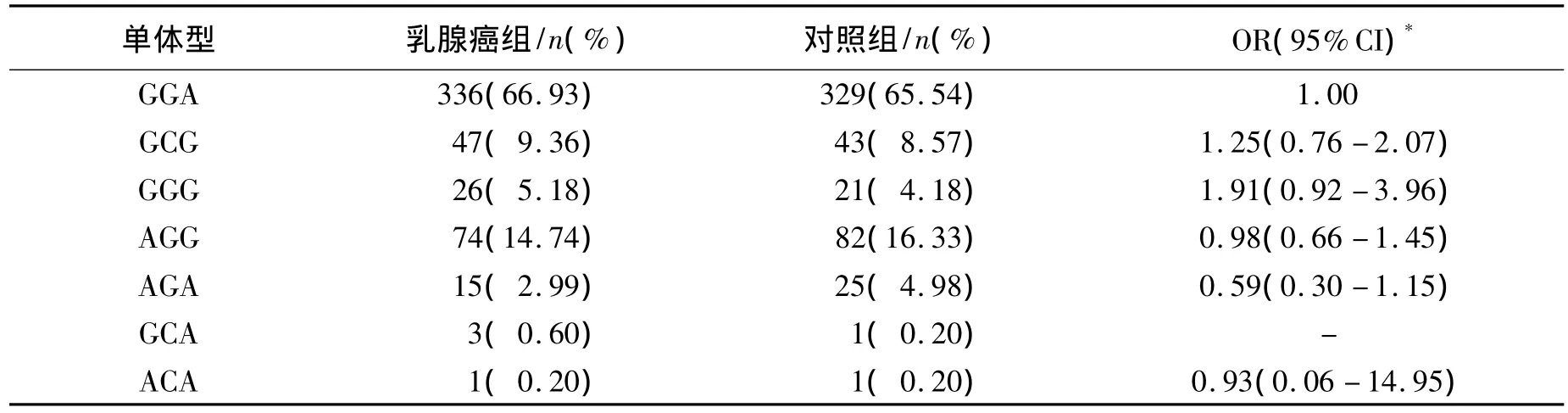
表3 CASP3单体型与乳腺癌患病风险Table 3 CASP3 haplotype frequencies and their association with the risk of breast cancer
3 讨论
CASP3在细胞凋亡过程中起着不可替代的作用。CASP3基因转染昆虫Sf9细胞后可引起细胞凋亡,这个过程可以被BCL-2阻断;但是在发生凋亡的细胞提取液中去除CASP3后,这些提取液就失去了诱导细胞凋亡的能力;再加入纯化的CASP3它就又恢复了致凋亡的功能[9]。多数的研究表明,肿瘤细胞过度增殖和凋亡受抑共同参与了细胞的累积和肿瘤的形成。CASP3蛋白在多种肿瘤组织呈低表达[10-13]。研究发现,CASP3的表达在乳腺腺病、乳腺纤维腺瘤、乳腺癌中逐渐降低(P=0.000),并且在乳腺癌中CASP3蛋白表达率越低,其临床分期越高(P=0.010)。
Lan等最早报道了CASP3基因多态与多发性骨髓瘤、非霍奇金淋巴瘤的相关性,发现rs1049216 C等位基因显著降低多发性骨髓瘤和非霍奇金淋巴瘤的发病风险[5-6]。Jang[7]的研究发现,携带 CASP3-928A>G、77G>A和17532A>C多态位点,以及它们单体型的个体,罹患肺癌的风险显著降低。而另一项研究发现,rs4647601 TT基因型能显著增加头颈部癌的发病风险(OR=1.32;95%CI=1.00-1.37)[14]。然而,以上四项研究的基因多态选择策略均为候选基因选择策略,对于CASP3基因多态性分析不够全面。Xu[8]等应用TagSNP选择策略挑选SNPs,研究CASP3基因多态性与子宫内膜癌的关联,结果显示,rs2705901 CC基因型能显著增加子宫内膜癌的发病风险(OR=2.25;95%CI=1.03-4.95)。本研究结果显示,rs2696056与 rs2705901呈完全连锁不平衡,但未发现其与乳腺癌的罹患风险存在关联。这可能是本研究样本量较小,CC基因型的检出率低。目前针对CASP3 TagSNP的单体型研究尚未见相关报告;但是,从本研究结果来看,单体型的分析结果与单个SNP的分析一致,也未发现单体型与乳腺癌的发病风险间存在显著关联。
综上所述,基于浙江省嘉善县开展的自然人群为基础的现场病例对照研究,未能发现CASP3的 TagSNPs rs4647693、rs2696056、rs4647610 与乳腺癌的发病风险存在显著相关;对单体型的分析发现,GGA是最常见的单体型,单体型与乳腺癌的发病风险间也不存在关联。
[1]CROPP C S,NEVANLINNA H A,PYRHÖNEN S,et al.Evidence for involvement of BRCA1 in sporadic breast carcinomas [J].Cancer Res,1994,54(10):2548-2551.
[2]SLEE E A,ADRAIN C,MARTIN S J.Executioner caspase-3,-6, and -7 perform distinct, nonredundant roles during the demolition phase of apoptosis[J].J Biol Chem,2001,276(10):7320-7326.
[3]GANGWAR R,MANDHANI A,MITTAL R D.Caspase 9 and caspase 8 gene polymorphisms and susceptibility to bladder cancer in north Indian population [J].Annals of surgical oncology,2009,16(7):2028-2034.
[4]PARK J Y,PARK J M,JANG J S,et al.Caspase 9 promoter polymorphisms and risk of primary lung cancer[J].Hum Mol Genet,2006,15(12):1963-1971.
[5]HOSGOOD H D,3rd,BARIS D,ZHANG Y,et al.Caspase polymorphisms and genetic susceptibility to multiple myeloma [J].Hematological oncology,2008,26(3):148-151.
[6]LAN Q,ZHENG T,CHANOCK S,et al.Genetic variants in caspase genes and susceptibility to non-Hodgkin lymphoma [J].Carcinogenesis,2007,28(4):823-827.
[7]JANG J S,KIM K M,CHOI J E,et al.Identification of polymorphisms in the Caspase-3 gene and their association with lung cancerrisk [J].Mol Carcinog,2008,47(5):383-390.
[8]XU H L,XU W H,CAI Q,et al.Polymorphisms and haplotypes in the caspase-3,caspase-7,and caspase-8 genes and risk forendometrialcancer:a population-based,case-control study in a Chinese population[J].Cancer Epidemiol Biomarkers Prev,2009,18(7):2114-2122.
[9]MUNGER J,CHEE A V,ROIZMAN B.The U(S)3 protein kinase blocks apoptosis induced by the d120 mutant of herpes simplex virus 1 at a premitochondrial stage [J].J Virol,2001,75(12):5491-5497.
[10]WANG J X,ZHENG S.Caspase-3 and survivin expression in pediatric neuroblastoma and their roles in apoptosis[J].Chin Med J(Engl),2004,117(12):1821-1824.
[11]ISOBE N,ONODERA H,MORI A,et al.Caspase-3 expression in human gastric carcinoma and its clinical significance [J].Oncology,2004,66(3):201-209.
[12]DEVARAJAN E,SAHIN A A,CHEN J S,et al.Down-regulation of caspase 3 in breast cancer:a possible mechanism for chemoresistance [J].Oncogene,2002,21(57):8843-8851.
[13]KANIA J,KONTUREK S J,MARLICZ K,et al.Expression of survivin and caspase-3 in gastric cancer[J].Dig Dis Sci,2003,48(2):266-271.
[14]CHENK,ZHAO H,HU Z,etal.CASP3 polymorphisms and risk of squamous cell carcinoma of the head and neck[J].Clin Cancer Res,2008,14(19):6343-6349.

