反胶束水合萃取藻蓝蛋白研究
丁 晧,裘俊红
(浙江工业大学 绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310032)
螺旋藻是一种丝状多细胞螺旋形原核藻类生物,具有蛋白含量高、繁殖速度快等特点[1-2].藻蓝蛋白是螺旋藻细胞中重要的光合作用天然色素,广泛应用于食品、化妆品、染料等工业.鉴于藻蓝蛋白具有良好的开发前景,其理论研究和应用已成为螺旋藻类蛋白研究的热点[3-7].藻蓝蛋白是胞内蛋白质,因此要破碎胞壁、胞膜使藻蓝蛋白以溶解的状态溶于提取液中,再将其沉淀,在提取过程应保持蛋白的活性.细胞破碎的方法主要有:反复冻融法、化学试剂处理法、溶胀法、超声波法和组织捣碎法等方法.蛋白质沉淀方法有:盐析法、结晶法、等电点沉淀法和超滤法等方法[8].
反胶束萃取技术是一项新型、有发展潜力的生物物质分离技术.反胶束萃取技术的应用过程中,不存在毒性试剂,对人体无害,成本低,且反胶束溶液可反复利用,还可以连续操作,处理量大,成本较低及近年来与其它应用技术如超临界的结合等方面,在工业化生产方面都显示了较大的应用潜力.反胶束体系内的“微水池”是一种类生命环境介质,其内的蛋白质不易变性,可广泛应用于生物质活性控制及提取.反胶束法在萃取单一或混合氨基酸的分离中也已表现出很大优越性,萃取机理也有了论断,但尚存在许多问题亟待解决,如萃取机理的实验验证等[9].反胶束水合萃取分离技术是将水合物的生成与反胶束萃取耦合在一起,生成水合物的同时可以消耗反胶束中的水分,帮助包含在反胶束中的蛋白质析出.Phillips等[10]曾利用水合物的生成从生化溶液中回收蛋白酶,而其它的相关研究甚少.反胶束水合萃取藻蓝蛋白在保证藻蓝蛋白活性的同时完成萃取和反萃取过程,操作较为简单.笔者通过构建CTAB/正辛烷-正戊醇反胶束体系,研究此体系中水合物生成对其内的藻蓝蛋白的萃取作用,考察温度、压力、CTAB浓度和初始含水量W0(初始条件下有机溶剂中水的摩尔浓度与表面活性剂的摩尔浓度之比)对反胶束水合萃取藻蓝蛋白的影响.
1 实验部分
1.1 仪器与试剂
仪器:水合物装置,低温冰箱,高速离心机,微量注射器等.
试剂:CTAB(十六烷基三甲基溴化铵),正辛烷,正戊醇,蛋白浓度测定试剂(Folin-酚试剂),牛血清蛋白等.
1.2 实验内容
1.2.1 螺旋藻细胞破壁
称取一定量的螺旋藻粉,加入0.1 mol/L的磷酸缓冲液(pH=7.0),采用反复冻融(3次)的方法[11]对藻体细胞进行破碎.将破碎的螺旋藻细胞悬浊液于4 000 r/min离心20 min,倾倒上清液,可得到含藻蓝蛋白的粗提液.
1.2.2 反胶束制备
将CTAB溶解于按一定比例配制的正辛烷和正戊醇混合液中,在磁力搅拌下用微量注射器逐步加入一定量的水.经过充分搅拌后,静置,观察溶液的透明度,若透明则表明溶液中形成反胶束体系.
1.2.3 反胶束水合萃取藻蓝蛋白
将螺旋藻粗提液用微量注射器加入形成反胶束体系的溶液中,然后将溶液置于高压釜内.在不同温度、压力、反胶束浓度以及初始含水量条件下进行反胶束水合萃取实验.图1为水合萃取装置简图.该装置依据加拿大 Bishnoi教授[12]实验室的湍动界面(气-水)型水合物装置设计而成.
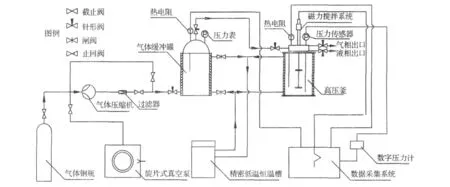
图1 反胶束水合萃取实验装置Fig.1 Experimental apparatus for reverse micellar hydrated extraction
1.2.4 藻蓝蛋白浓度及萃取率计算
Folin-酚法测定藻蓝蛋白浓度:不同浓度牛血清白蛋白标准溶液,经Folin-酚试剂处理,检测640 nm处的吸收值,绘制OD640-蛋白浓度标准曲线,适度稀释的待测样品经Folin-酚试剂同法处理后,测定640 nm处的吸收值,并在标准曲线上找出对应的蛋白浓度,计算待测藻蓝蛋白的浓度.
反胶束水合萃取藻蓝蛋白的萃取效果可以用藻蓝蛋白的萃取率E表示为

式中:[PC]t,[PC]0分别为萃取后溶液中藻蓝蛋白的质量浓度和粗提液中藻蓝蛋白的质量浓度,mg/mL;Vt,V0分别为萃取后溶液体积和粗提液体积,mL.
2 结果与讨论
2.1 藻蓝蛋白反胶束水合萃取效果分析
螺旋藻粗提液和反胶束水合萃取液用紫外光谱仪在λ取0~800 nm范围内分别测其吸收光谱峰的吸光度,在紫外区200~400 nm均有强吸收峰.粗提液在λ=618 nm处都有最大吸收,在λ=650 nm左右处有一肩峰,如图2所示.620 nm和650 nm处的吸收峰分别是藻蓝蛋白和别藻蓝蛋白的特征吸收峰[13].由于粗提液未经进一步提取纯化,650 nm处的肩峰表示别藻蓝蛋白的含量较高,如图3所示,经反胶束水合萃取后溶液中藻蓝蛋白纯度有所提高,λ=650 nm左右的峰已不明显,表示别藻蓝蛋白含量有所降低,藻蓝蛋白的纯度提高.但是反胶束水合实验方法不成熟,过程中有部分藻蓝蛋白损失,所以图3中吸光度相比粗提液有所下降.

2.2 藻蓝蛋白反胶束水合萃取过程分析
为分析反胶束体系中藻蓝蛋白的水合萃取行为,选取一个如图4所示的存在相界面的小型反胶束体系.
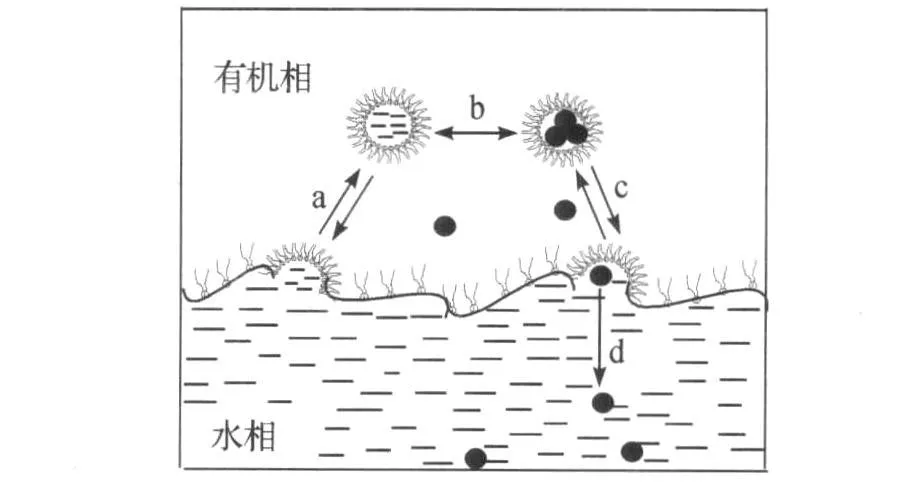
图4 藻蓝蛋白水合萃取行为Fig.4 Kinetic behavior of reverse micellar hydrated extraction of phycocyanin
反胶束水合萃取藻蓝蛋白的过程描述:螺旋藻粗提液中的藻蓝蛋白被包裹在反胶束体系内的“水池”中;伴随水合物的生成,“水池”中的部分水分用于生成水合物,“水池”中水分减少导致藻蓝蛋白从反胶束体系中析出.在有表面活性剂覆盖的相界面上,藻蓝蛋白的萃取过程可以认为由两个步骤组成:一是聚结,“满胶束”触及界面并聚结,但并不是每次与相界面碰撞都发生聚结;二是分离,反胶束的囊状表面活性剂层没入平的界面层,藻蓝蛋白同时从带电界面离开.有文献[14]认为聚结步骤为界面传质过程中最慢的一步,处于“水池”内的藻蓝蛋白与反胶束的表面活性剂层之间的静电作用,改变了胶束表面的性能,并影响到“满胶束”的表面活性剂层与主体界面间的作用.当整个实验体系达到平衡后,藻蓝蛋白将存在于4种位置:(1)存在于反胶束的“水池”内;(2)存在于反胶束外的连续有机相中;(3)存在于过剩水中;(4)独立或被水合物包裹沉淀于釜底.由于藻蓝蛋白在有机相中的溶解度极小,水合物的形成结合了绝大部分水分,因此实验中认为沉淀到釜底的藻蓝蛋白即为提取到的藻蓝蛋白.
2.3 影响藻蓝蛋白萃取率的因素分析
表1分析了温度、压力、CTAB以及初始含水量W0对藻蓝蛋白萃取率的9组正交实验的结果与极差分析.表中Kij求得的第 j列上第i个水平的实验结果总和平均值;D为对藻蓝蛋白萃取率的极差.
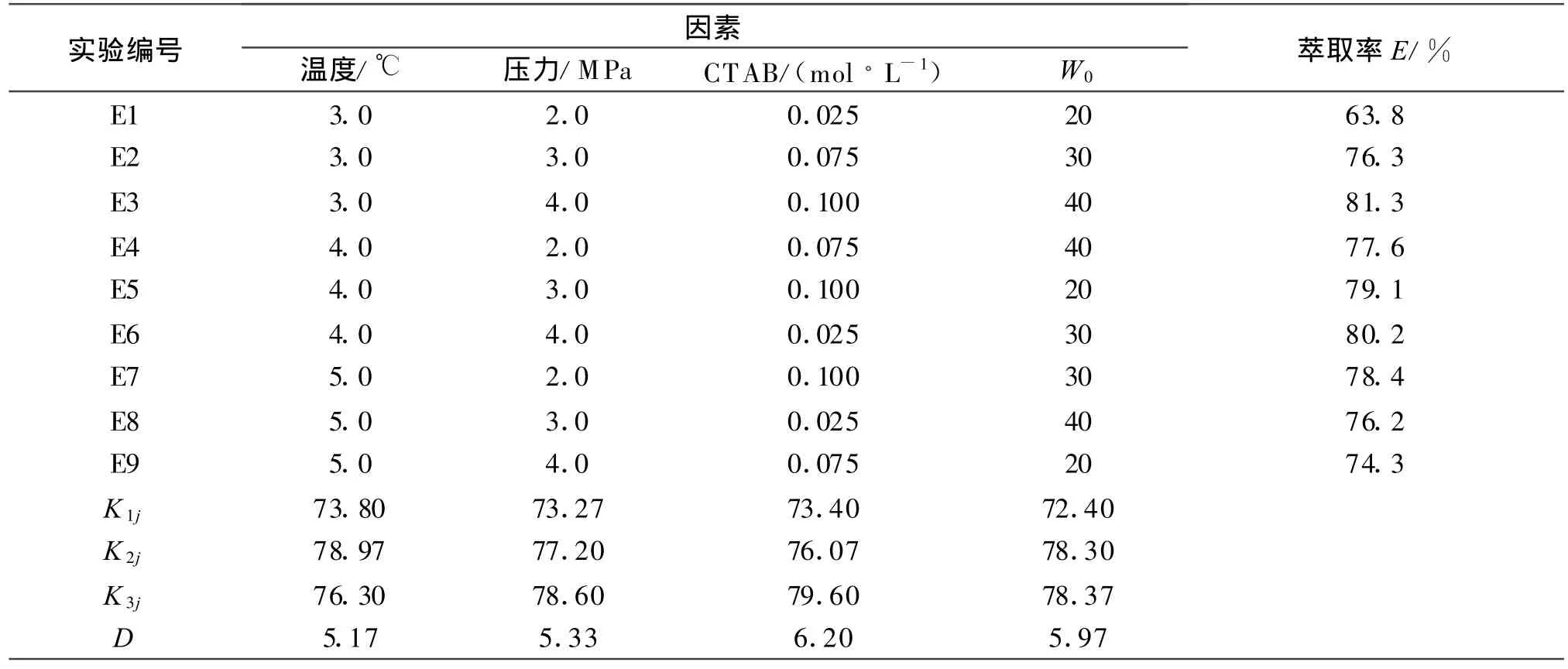
表1 藻蓝蛋白萃取率的极差分析数据Table 1 Range analysis date of phycocyanin extraction rate
由表1可见,温度、压力、CTAB浓度及初始含水量W0对反胶束水合萃取藻蓝蛋白萃取率的影响程度从大到小的顺序为CTAB浓度>初始含水量>压力>温度.
一定的压力是水合物生成必需满足的条件.压力越高,水合物生成的推动力越大,水合物就越容易生成,生长和成核速率也就越快.乙烯作为水合物形成气,随着压力的升高,溶解于反胶束体系的量也不断增加,即体系中乙烯过饱和度增加,促进了水合物进一步生成.压力是影响水合物生成的一个重要的因素,但是由于反胶束水合萃取藻蓝蛋白的实验中体系的水量非常少,所以气量对水量的比例很大,较低的压力也能很好的生成水合物,因此,在一定范围内的压力高低对藻蓝蛋白率的影响不大.
一定压力下水合物的平衡温度和实验温度之差称为过冷度.这说明温度对反胶束体系水合物生成的影响,实质上也就是过冷度的影响.随实验初始温度降低,过冷度增加,有利于水合物生成.但由于体系水量的稀少,温度在对水合物生成行为和实验前后反胶束含水量W0变化的影响中都属于非显著性因素.
水合萃取的本质是在调节反胶束体系含水量W0,从而使藻蓝蛋白从反胶束体系中析出.初始具有大量的水有利于水合物生成前反胶束体系能溶解更多的藻蓝蛋白,从而能有效提高藻蓝蛋白的萃取率.
为保持反胶束的稳定性,便于研究反胶束体系性质,反胶束中增溶的水分采用注入法,且增溶水量控制在反胶束最大含水量之内,所以实验反胶束体系中水量很少.由于CTAB浓度的适当增加也将会使得水合物生成速率大幅提高[15],有利于藻蓝蛋白从反胶束中析出.但是表面活性剂浓度过高将导致反胶束体系黏度增大,难以分相,同时水的乳化程度也加大,因此CTAB浓度不宜过高.
3 结 论
研究表明,在初始温度 3℃,初始压力4 MPa,CTAB浓度0.10 mol/L,初始含水量40的条件下,水合萃取藻蓝蛋白的萃取率可达81.3%,表明该条件时的萃取效果比较好.由于水合萃取实验中气液比较大,所以在一定范围内初始温度和压力对萃取效果影响不大,属于非显著性因素,而较大的反胶束浓度和初始含水量有利于提高藻蓝蛋白萃取率.研究发现水合萃取过程通过去除一定量的别藻蓝蛋白得以纯化藻蓝蛋白,提高了藻蓝蛋白纯度.反胶束水合萃取完成了萃取、反萃取以及纯化过程的有效耦合,相对于加盐反萃取操作难度有所下降;但此方法仍很不成熟,研究中也发现有部分藻蓝蛋白流失.
[1] 姚宝贞.螺旋藻的营养评价及其保健功能[J].食品研究与开发,1998,19(2):41-44.
[2] 何佳,赵启美.螺旋藻藻蓝蛋白稳定性的研究[J].生物学杂志,1998,15(5):171-176.
[3] 赵井泉,张建平.用脉冲辐解法研究藻胆蛋白与羟基自由基反应动力学[J].科学通报,2000,45(1):32-36.
[4] TOMOHIRO H,MISAKO M,KAORU H,et al.Activation of the human innate immune system by Spirulina:augmentation of interferon production and N K cytotoxicity by oral administration of hot water extract of Spirulina platensis[J].International Immunopharmacology,2002,2(4):423-434.
[5] 沈海雁,王习霞.螺旋藻藻蓝蛋白对人血癌细胞株HL-60,K-552和L-937生长影响[J].海洋科学,2000,24(1):45-48.
[6] ANAM IKA P,SANDHYA M,RICHA P,et al.Purification and characterization of c-phycocyanin from cyanobacterial species of marine and freshwater habitat[J].Protein Exp Purif,2005,40(2):248-255.
[7] 王勇,钱凯先.高纯度藻蓝蛋白分离纯化及光谱特性研究[J].生物化学与生物物理进展,1999,26(5):457-460.
[8] 孟春晓,高政权.钝顶螺旋藻藻蓝蛋白提取和纯化工艺研究进展[J].食品研究与开发,2007,9(28):151-154.
[9] 郭晓歌,赵俊廷.反胶束萃取氨基酸的研究进展[J].食品工程,2007,4:12-14.
[10] PHILLIPS J B,NGU YEN H,JOHN V T.Protein recovery from reversed micellar solutions through contact with a pressurized gas phase[J].Biotechnol Prog,1991,7:43-48.
[11] 彭卫民,商树田,刘国琴,等.钝顶螺旋藻藻胆蛋白的提取[J].食品科学,1996(6):48-49.
[12] VYSNIAUSKAS A,BISHNOI P R.A kinetic study of methane hydrates formation[J].Chem Eng Sci,1983,38(7):1061-1072.
[13] 殷钢,李晖.螺旋藻中藻胆蛋白和多糖的分离纯化及产品特性[J].精细化工,1999,16(2):10-13.
[14] BAUSCH T E,PLUCINSKI P K,NITSH W.Kinetics of the re-ex traction of hydrophilic solutes out of AOT reversed micelles[J].J Colloid Interface Sci,1992,150(1):226-234.
[15] 徐勇军,叶国兴,杨晓西,等.表面活性剂对水合物生成的影响及应用前景[J].天然气工业,2002,22(1):85-87.

