壳聚糖水凝胶的制备工艺对其吸附蛋白质的影响
钱俊青,吕坚方
(浙江工业大学药学院,浙江 杭州 310032)
壳聚糖(chitosan,CTS)是甲壳素(chitin)经脱乙酰化处理后的产物,是由N-乙酰-D-氨基葡萄糖单体通过β-1,4-糖苷键连接起来的直链状高分子化合物[1-2].壳聚糖具有良好的生物相容性和丰富的表面基团的优点可替代纤维素、葡聚糖等作为凝胶的载体,壳聚糖凝胶相比纤维素、二乙氨基葡聚糖凝胶等,克服了价格昂贵,合成和再生较复杂的缺点[3-6],因而应用于生物活性蛋白的分离前景广阔,已成为生物化工研究的热点,唐振兴等[7]合成一种采用戊二醛交联并去除过量醛基的方法制备出了壳聚糖为载体的生物凝胶,具有良好的分离效果;黄丽等[8]以壳聚糖凝胶为载体制备了一种新型的低密度脂蛋白吸附剂,该吸附剂同时利用疏水作用和静电作用对血浆中的胆固脂蛋白进行吸附,能有效的降低血浆中胆固醇的含量.不同的交联剂对壳聚糖有不同的影响,为了考察壳聚糖本身的吸附性能,本实验采用壳聚糖在酸性和碱性的水溶液中制备出不引进有机交联剂的壳聚糖水凝胶,用于蛋白质及酶的吸附,考察了不同壳聚糖水凝胶制备工艺对蛋白吸附性能的影响,并初步研究了纯水淋洗的吸附特征.
1 实验部分
1.1 材料与仪器
原料和试剂:甲壳素(食用级),牛血清蛋白(电泳单点纯),α-淀粉酶(食品级),醋酸 、磷酸 、盐酸和NaOH(均为化学纯).
套式恒温器,机械搅拌机,恒温水浴槽,紫外-可见分光光度计.
1.2 实验原理与方法
甲壳素(chitin)脱乙酰度的测定:根据文献[9],用碱量法.
蛋白质浓度的测定:在280 nm波长下,用紫外光度法测定[10].
酶活力测定:根据文献[11],用终点色对比法进行测定.
1.3 实验步骤
1.3.1 壳聚糖的制备
壳聚糖由甲壳素与质量分数为50%的NaOH反应而得,反应温度控制在110℃左右,不同的反应时间下制得不同脱乙酰度的壳聚糖.
1.3.2 壳聚糖水凝胶的制备
将制得的壳聚糖溶于酸性水溶液中,再滴入碱性水溶液中得粒状壳聚糖水凝胶,最后用水洗至中性备用[12].
1.3.3 壳聚糖水凝胶吸附实验
将壳聚糖水凝胶装入分离柱;蛋白或酶上柱后,用蒸馏水洗脱,洗出液每2 mL收集一次,逐次承接,洗出液在280 nm下进行紫外测定.
2 结果与讨论
2.1 壳聚糖水凝胶用于牛血清蛋白吸附
将不同性能的壳聚糖水凝胶装入分离柱;牛血清蛋白溶液上柱后,收集洗出液,每2 mL一次,逐次承接,洗出液在280 nm下进行紫外测定.
2.1.1 酸性水溶液对壳聚糖水凝胶吸附性能的影响
将壳聚糖溶于不同的酸性水溶液(HAc,HCl,H3PO4)中,再将壳聚糖酸溶液滴入碱液中得粒状壳聚糖水凝胶,再按实验步骤1.3.3检测壳聚糖水凝胶的吸附性能, 结果如图1 所示.

图1 不同酸性水溶液中制备的粒状壳聚糖水凝胶对牛血清蛋白的吸附Fig.1 Effect of kinds of acids on the absorption ability of the chitosan gel for BSA
从图1可知,使用醋酸和盐酸制备的壳聚糖水凝胶的分离效果较好,磷酸效果较差,且使用醋酸的效果稍好于盐酸.若以蒸馏水为洗脱液,从分离前的洗柱情况看,使用醋酸制得壳聚糖粒状水凝胶比用盐酸制得的壳聚糖粒状水凝胶易于洗至平衡,而Ac-比Cl-大,据此推测壳聚糖在此主要起凝胶分离作用.从分离效果和分离前的柱洗情况考虑,选用醋酸作为制备壳聚糖水凝胶的酸介质较适.
2.1.2 醋酸质量分数对壳聚糖水凝胶吸附性能的影响
将壳聚糖溶于不同质量分数的醋酸水溶液中(1%,2%,3%),再将壳聚糖酸溶液滴入碱液中得粒状壳聚糖水凝胶,再按实验步骤1.3.3检测壳聚糖水凝胶的吸附性能,结果如图2所示.
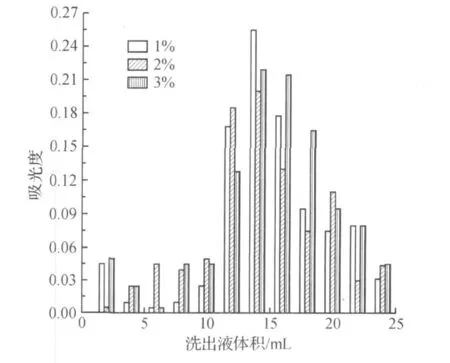
图2 不同的醋酸质量分数下制得的粒状壳聚糖水凝胶对牛血清蛋白的分离Fig.2 Effect of the content of acid on the absorption ability of the chitosan gel for BSA
从图2可知,2%醋酸下制得壳聚糖粒状凝胶对牛血清蛋白的分离效果最好.
2.1.3 壳聚糖质量浓度对壳聚糖水凝胶吸附性能的影响
将壳聚糖(2~6 g)溶于100 mL醋酸中,再将壳聚糖酸溶液滴入碱液中得粒状壳聚糖水凝胶,再按实验步骤1.3.3检测壳聚糖水凝胶的吸附性能,结果如图3所示.
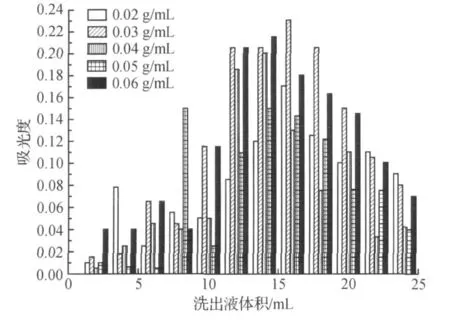
图3 不同壳聚糖质量浓度的壳聚糖粒状凝胶对牛血清蛋白分离的影响Fig.3 Effect of chitosan content on the absorption ability of the chitosan gel for BSA
从图3可知,壳聚糖质量浓度为0.04 g/mL时分离效果最好,壳聚糖过低和过高都会使壳聚糖粒状水凝胶对牛血清蛋白的分离性能降低.因而选用0.04g/mL的壳聚糖含量为最佳工艺参数.
2.1.4 壳聚糖脱乙酰度对壳聚糖水凝胶吸附性能的影响
将不同脱乙酰度(68.0%,72.0%,86.0%,88.8%,95.0%)的0.04 g/mL的壳聚糖醋酸溶液滴入碱液中得粒状壳聚糖凝胶,再按实验步骤1.3.3检测壳聚糖水凝胶的吸附性能,结果如图4所示.
从图4可知,脱乙酰度为88.8%的壳聚糖粒状水凝胶对牛血清蛋白的分离效果较好,脱乙酰度太高、太低均不理想,图4还表明,随着脱乙酰度增大,洗脱变难,即吸附现象变得越发严重.故选用脱乙酰度为88.8%为最佳最佳工艺参数.
通过对制备壳聚糖粒状水凝胶时酸性水溶液、醋酸质量分数、壳聚糖质量浓度和壳聚糖脱乙酰度四个因素的考察,得出了脱乙酸度为88.8%,质量浓度为0.04 g/mL的壳聚糖在2%醋酸下制得的粒状壳聚糖水凝胶对蛋白的分离能力最强.

图4 不同脱乙酰度的壳聚糖粒状凝胶对牛血清蛋白分离的影响Fig.4 Effect of the degree of deacetylation of chitosan on the absorption ability of the chitosan gel for BSA
2.2 壳聚糖水凝胶对α-淀粉酶的分离纯化
为了说明壳聚糖水凝胶既有良好的分离性能又能使被分离物质的生物活性尽可能保持,以过柱前后的α-淀粉酶活性变化来评价壳聚糖水凝胶.
将脱乙酰度为88.8%,质量浓度为0.04 g/mL的壳聚糖在2%盐酸下制得的粒状壳聚糖水凝胶装入分离柱,用5 g/L的α-淀粉酶上柱后,为别以蒸馏水和pH为6的磷酸缓冲液为洗脱液,洗出液每2 mL一次,逐次承接,分别检测过柱前后的酶活力,结果如表1,2所示.
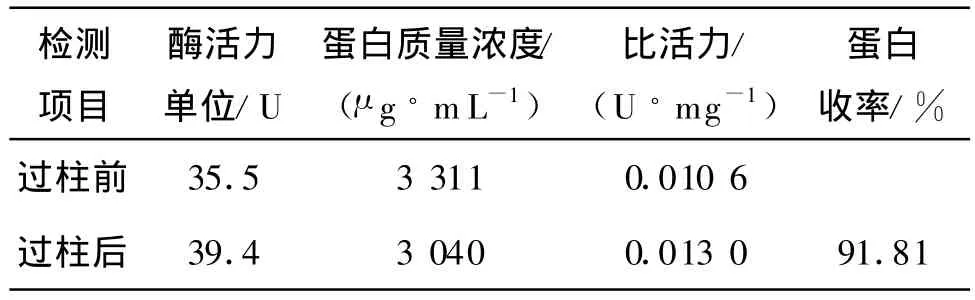
表1 蒸馏水为洗脱液的酶活力数据Table 1 Purification of α-amylase with chitosan gel by eluating with water

表2 pH6.0的缓冲液为洗脱液的酶活力数据Table 2 Purification of α-amylase with chitosan gel by eluating with buffer
从表2过柱前后的比活力比较,得出α-淀粉酶经过粒状壳聚糖水凝胶为层析分离材料的柱分离后,仍能保持良好的酶活力.
3 结 论
本实验考察了酸性水溶液、醋酸质量分数、壳聚糖质量浓度和壳聚糖脱乙酰度等因素对壳聚糖粒状水凝胶分离牛血清蛋白分离性能的影响,得出了壳聚糖粒状水凝胶分离牛血清蛋白具有最佳效果的性状参数:脱乙酰度为88.8%,质量浓度为0.04 g/mL的壳聚糖在质量分数为2.0%醋酸下制得的粒状壳聚糖水凝胶.用最佳条件下制得的壳聚糖水凝胶柱层析分离α-淀粉酶,通过考察酶过柱前后的酶活力变化,表明了壳聚糖水凝胶对蛋白质的生物活性保持良好.将壳聚糖水凝胶作为分离介质,有较好的应用价值.
[1] 蒋挺大.甲壳素[M].北京:化学工业出版社,2001.
[2] 杨新超,赵祥颖,刘建军.壳聚糖的性质、生成及应用[J].食品与药品,2005,7(8):59-62.
[3] 唐振兴,钱俊青.壳聚糖凝胶的制备及应用研究[J].浙江工业大学学报,2005,33(6):610-613.
[4] 唐振兴,钱俊青,石陆娥.壳聚糖凝胶吸附蛋白质机理研究[J].精细化工,2004,21(11):832-730.
[5] LOW C R.An introduction to affinity chromatography[M].Mishawaka:North-Holland Pub Co,1979.
[6] LUONG J H T.High performance liquid chromatography of biomacromolecules[J].Biotechnology and Bioengineering,1988,31(6):439-445.
[7] 唐振兴,钱俊青,石陆娥.壳聚糖层析凝胶洗脱条件优化[J].精细化工,2004,21(10):726-730.
[8] 黄丽,方波,朱叶,等.新型低密度脂蛋白吸附剂的制备及吸附性能初步研究[J].中国血液流变学杂志,2006,16(4):509-522.
[9] 陈洁,杨方琪.甲壳素脱乙酰度的测定方法[J].无锡轻工业学院学报,1993,12(3):255-259.
[10] 焦利敏,廖学品,石碧.紫外分光光度法下直接测定蛋白质溶液的浓度[J].化学研究与应用,2007,19(5):562-565.
[11] 荣俊,杨待建,伍晓雄.加酶饲料中淀粉酶总活力的测定-碘淀粉比色法[J].饲料工业,1994,15(3):40-42.
[12] 王家东,王荣荣,侯红萍.壳聚糖的制备及应用进展[J].食品研究与开发,2005,26(5):173-176.

