头孢拉定与血清白蛋白相互作用的光谱学研究
宋熙熙 陈树大 刘 涛
(嘉兴学院生物与化学工程学院,浙江嘉兴 314001)
头孢拉定与血清白蛋白相互作用的光谱学研究
宋熙熙 陈树大 刘 涛
(嘉兴学院生物与化学工程学院,浙江嘉兴 314001)
采用荧光和紫外吸收光谱法研究头孢拉定和牛血清白蛋白(BSA)的相互作用。研究发现,头孢拉定荧光猝灭牛血清白蛋白是由于形成了头孢拉定-牛血清白蛋白复合物。分别计算了不同温度下双分子猝灭常数kq和结合常数K。由热力学参数焓变(ΔH)、熵变(ΔS)和吉布斯自由能(ΔG),推断出头孢拉定与BSA的相互作用是一个疏水作用的自发过程。
头孢拉定 牛血清白蛋白 荧光猝灭 热力学参数
头孢拉定(分子式C16H19N3O4S)是一种稳定性好、刺激性小,在临床上广泛使用的唯一可供口服和注射的头孢菌素。头孢拉定毒性低,治疗指数大,不良反应少,对肾毒性低,因此在治疗和预防多种感染中具有较好的疗效。
血清白蛋白是血浆中含量最为丰富的蛋白质,具有贮运内源代谢产物和外源药物小分子等重要生理功能,对药物在体内的代谢和分布产生很大影响。笔者选用牛血清白蛋白为蛋白模型,从不同角度考察血清白蛋白与头孢拉定的相互作用,对阐明头孢拉定在体内的存储和转运过程、血清白蛋白的结构与功能之间的关系以及生物大分子与药物小分子的相互作用的化学本质具有重要意义。
1 实验部分
1.1 主要仪器与试剂
分子荧光分光光度计:Gary Eclipse型,美国Varian公司;
紫外分光光度计:UV-2550型,日本岛津公司;
头孢拉定:浙江医药股份有限公司新昌制药厂生产,以pH 7.4 Tris-HCl缓冲液配制成浓度为1.5×10-3mol/L的储备液;
牛血清白蛋白V(BSA):北京鼎国生物技术有限责任公司生产,用缓冲液配制成浓度为2.0×10-5mol/L的储备液,保存于4℃的冰箱中,备用;
NaCl溶液:0.1 mol/L,用以维持溶液离子强度,宁波市化学试剂有限公司;
实验所用其它试剂均为分析纯。
1.2 实验方法
在不同温度(25、30、37℃)下,采用分子荧光光谱法测定牛血清白蛋白溶液及与不同浓度的头孢拉定溶液混合后的荧光光谱,分析荧光强度变化的原因。
2 结果与讨论
2.1 荧光分析
对BSA预扫描,得到BSA最大激发波长为228 nm,最大发射波长为339 nm。因此以228 nm为激发波长,记录BSA的荧光光谱及头孢拉定对BSA的荧光猝灭;以228 nm为激发波长,记录BSA和含不同浓度头孢拉定时BSA的发射光谱,结果见图1。
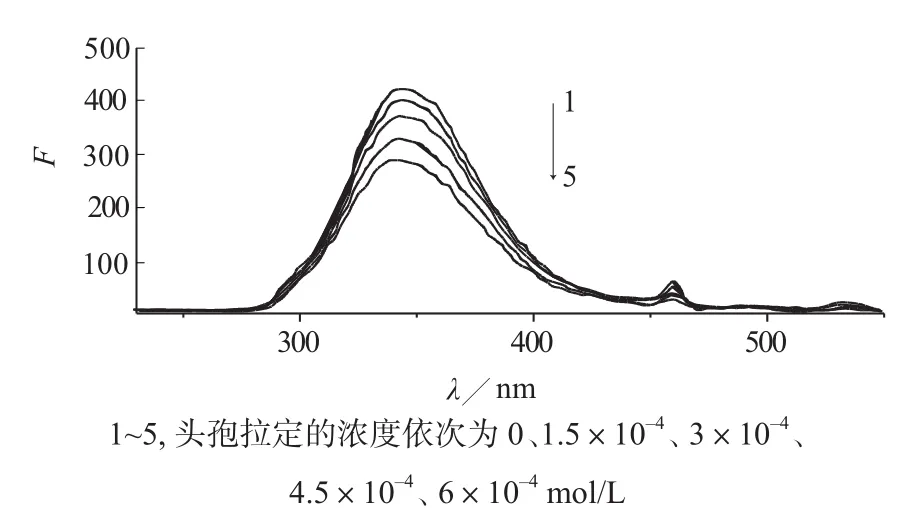
图1 不同浓度头孢拉定的BSA荧光猝灭光谱
2.2 猝灭常数kq
分子间的作用不同可以导致不同的猝灭方式,典型的猝灭方式有动态猝灭和静态猝灭[1]。为了确定此猝灭过程的机制,先假设头孢拉定对BSA的荧光猝灭为动态猝灭过程,应服从Stern-Volmer方程:
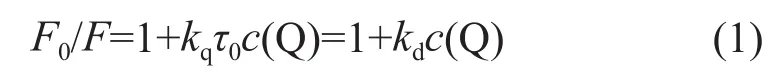
式中:F0——猝灭体不存在时的荧光强度;
F——加入猝灭体后的荧光强度;
kq——双分子猝灭常数,L/(mol·s);
τ0——猝灭体不存在时荧光体的荧光寿命,ns;
c(Q)——猝灭体浓度,mol/L;
kd——Stern-Volmer常数。
实验测得τ0的值在1~10 ns之间[2],为了计算方便,一些文献取τ0为1 ns[3,4],另有文献取τ0=l0 ns[5,6]。本实验取τ0=1 ns。以F0/F-1对c(Q)作图,得到不同温度下的kq值,见表1。

表1 不同温度下BSA与头孢拉定的双分子猝灭常数kq(pH 7.4)
由表1可以看出,头孢拉定与BSA相互作用,在228 nm激发波长下,不同温度时的双分子猝灭常数kq远大于各种猝灭体对生物大分子的最大扩散碰撞猝灭常数2.0×1010L/ (mol ·s)[7],说明此猝灭过程不是由于动态猝灭引起的。随着头孢拉定浓度的增加,BSA的荧光强度有不同程度的猝灭,且BSA的荧光峰位没有发生改变,所以初步确定加入药物后,BSA的结构基本上没有发生变化。由此推测,此猝灭过程可能是由于头孢拉定与BSA形成了缔合物而引起的静态猝灭,也就是说此猝灭过程是由于药物与BSA在基态时生成了复合物,从而导致BSA的荧光强度猝灭。
2.3 结合常数K和活化能Ea
头孢拉定和BSA的结合常数较大,形成结合位点,且受温度影响较大,说明头孢拉定与BSA有较强的结合作用,可以被蛋白质运输和储存。
根据方程[8]:
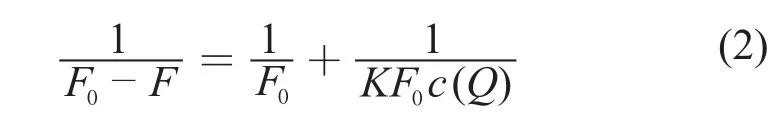

表2 不同温度下BSA与头孢拉定的结合常数K(pH 7.4)
根据阿伦尼乌斯方程lnK=lnA-Ea/RT,可得结合活化能Ea为935.2 kJ/mol ,表示活化分子的平均能量与反应物分子平均能量的差值。温度升高,体系中分子间的碰撞的几率增加,BSA与头孢拉定分子的有效碰撞加剧,活化分子增多。活化能与反应速率的大小有着密切的关系,活化能越小反应速率越大。
2.4 结合距离
根据Forster理论[9,10],无辐射能量转移效率E可表示为:

其中R0为转移效率为50%时的临界距离,计算公式为:

根据文献[11],其中K2=2/3,为空间取向因子,φD为供体的荧光量子产率,φD=0.118,n是介质的折射指数,n=1.336,J为供体的荧光发射光谱与受体的吸收光谱之间的光谱重叠积分:
其中FD(λ)为荧光供体在波长为λ时的荧光强度,ε(λ)为受体在波长为λ时的摩尔消光系数。能量转移效率E还可以表示为:

式中:F——药物与BSA的浓度比为1∶1时的荧光强度;
F0——未加入药物时的荧光强度。
根据式(3)~式(6)可以求得在228 nm波长激发下,不同的J,E和r值。以25℃为例:

2.5 荧光猝灭过程中热力学函数的变化与作用力判断
药物等有机小分子和蛋白质等生物大分子之间的结合力主要有疏水作用力、氢键作用力、范德华力和静电引力等。Ross等[12]根据大量实验规律总结,利用反应前后热力学焓变ΔH和熵变ΔS的相对大小来判断药物与蛋白质之间的主要作用力类型:ΔH>0,ΔS>0时为疏水作用力;ΔH<0,ΔS<0时为氢键和范德华力;ΔH<0,ΔS>0时为静电引力。在温度变化不大时,反应的ΔH可以看作一个常数。由下列公式可得ΔG、ΔH和ΔS。

应指出BSA结构很复杂,药物与它之间往往同时存在几种作用力。根据以上公式求得荧光猝灭实验中头孢拉定与BSA结合反应的热力学函数值见表3。可知荧光猝灭实验推测出头孢拉定药物与BSA之间的主要作用力均为疏水作用力[13,14]。

表3 BSA与头孢拉定相互作用的热力学常数及作用力
3 结论
采用分子荧光光谱法研究了生物大分子牛血清白蛋白BSA与药物小分子头孢拉定的相互作用,研究结果表明,BSA的荧光峰位置相同,均为343 nm左右,说明了结合过程中BSA的结构基本保持不变,并且随头孢拉定浓度的增加,荧光强度不断减弱,BSA与头孢拉定分子结合,生成了相应的复合物,导致BSA内源荧光猝灭。由Stern-Volmer方程可到结合作用的双分子猝灭常数,该猝灭常数远小于生物大分子的最大扩散碰撞猝灭常数,说明该结合过程是一个静态猝灭过程,由Linewerver-Burk双倒数模型,得到不同温度下BSA与头孢拉定相互结合的结合常数K,讨论了相关的热力学常数,可知该结合作用是在自发的作用下进行,通过一定的非价键力,即分子间疏水作用进行,结合反应速率较快。
[1]杨频,高飞.生物无机化学原理[M].北京:科学出版社,2002:331-335.
[2]Lakowicz J R,Weber G.Quenching of fluorescence by oxygen:a probe for structural fluctuations in macromolecules[J].Biochemistry,1973,12(21): 4 161-4 165.
[3]杨斌盛,杨频.人血清白蛋白与金属离子作用的荧光光谱研究[J].生物化学与生物物理进展,1992,19(2):110-114.
[4]朱铿,童沈阳.荧光黄与蛋白质相互作用的研究[J].高等学校化学学报,1996,17(4): 539-542.
[5]上官云凤,颜承农,冯志云,等.二苯基(2-氯苯基)甲醇与牛血清白蛋白结合反应特征研究[J].光谱学与光谱分析,2004,23(6):32-35.
[6]姚武,高峰,王伦.依诺沙星与牛血清白蛋白相互作用的荧光法研究[J].分析测试学报,2005,24(1): 76-82.
[7]Elo Ware W R. Oxygen quenching of fluorescence in solution: an experimental study of the diffusion process[J].J Phys Chem,1962,66: 455-463.
[8]马贵斌,杨频.荧光法研究血清自蛋白与药物的结合作用[J].生物化学杂志,1992,8(5): 624-628.
[9]杨曼曼,杨频,张立伟.荧光法研究咖啡酸类药物与自蛋白的作用[J].科学通报,1994,39(1): 31-38.
[10]Forster T. Modern Quantum Chemistry (Vol.3) [M]. New York:Academic Press, 1996: 93-106.
[11]Lakowicz J R. Principles of Fluorescence Spectroscopy [M].3rd Ed. New York: Springer, 2006: 445-457.
[12]Ross P D, Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability [J]. Biochemical, 1981, 20(11): 96-102.
[13]熊和玉,汪敬武.头孢菌素类抗生素分析方法研究进展[J].江西化工,2003(3): 16-22.
[14]刘洛生,赵丽,葛蔚颖.头孢克罗与人血清白蛋白相互作用机制[J].光谱学与光谱分析,2003,23(4): 769-774.
SPECTROSCOPIC STUDIES OF INTERACTION BETWEEN CEPHRADINE AND BOVINE SERUM ALBUMIN
Song Xixi, Chen Shuda, Liu Tao
(College of Biological, Chemical Sciences and Engineering, Jiaxing University, Jiaxing 314001, China)
The interaction between cephradine and bovine serum albumin (BSA)was investigated by fluorescence and UV absorption spectroscopy. In the mechanism discussion,it was proved that the fluorescence quenching of BSA by cephradine resulted from the formation of cephradine-BSA complex. The quenching constantkqand the binding constantKat different temperatures were calculated. The thermodynamic parameters,enthalpy change(ΔH), entropy change(ΔS) and Gibbs free energy change (ΔG) were calculated respectively,which indicated that the interaction of cephradine with BSA was a spontaneous process mainly by hydrophobic interaction.
cephradine, bovine serum albumin, fluorescence quenching, thermodynamic parameter
2011-05-08

