正交试验法优选红参加工工艺
李卓艳, 李德坤, 周大铮, 叶正良, 李 萍
(1.中国药科大学中药学院,江苏南京 210009;2.天津天士力之骄药业有限公司,天津 300402)
人参为五加科植物人参Panax ginsengC.A.Mey.的干燥根和根茎,主要分布于东北三省。人参中化学成分复杂,但是普遍认为主要有效成分是人参皂苷,约占4%。一般人参炮制后入药,其中,红参是最常见的炮制品。经过炮制后的红参除了容易保存外,还降低了有神经毒害的田七素,并且形成了新的人参皂苷,如抗肿瘤活性的Rg3和Rh2[1-5]。
近期对东北人参资源考察过程中发现,红参加工厂的红参加工工艺各不相同,这样势必造成红参内在质量的差异。这些加工厂注重的是红参的外在质量,对皂苷类成分的量及皂苷类指纹图谱并不关注。所以市场上红参质量参差不齐,同时由于品牌多且杂,企业间的内耗导致中国红参至今无法与西洋红参、高丽红参相抗衡。
为了给生产厂家提供一个统一的质量标准,我们参考加工厂的工艺,首次以人参总皂苷和高活性人参皂苷Rg3共同作为指标,采用正交加工方法对红参加工工艺进行优化[6-7]。
1 材料与仪器
1.1 材料 5年生鲜人参,鑫泰药业提供,经天津天士力之骄药业有限公司杨悦武研究员鉴定,为人参Panax ginsengC.A.Mey。
1.2 对照品 人参皂苷Re、Rg3为中国药品生物制品检定所购买(批号为110754-200822、110804-200402)。
1.3 仪器 Waters 2695高效液相色谱仪,2489紫外检测器;Hach DR 5000紫外分光光度计;DIKMA ProElutTMSPE小柱。
2 实验方法
2.1 红参加工正交试验设计 采用正交设计试验,对红参蒸制时间、烘干温度、烘干时间进行条件优选[8],考察指标为人参总皂苷以及高活性皂苷Rg3。用L9(34)正交表安排实验。因素水平表见表1。

表1 因素水平Tab.1 Levels of factors
蒸制时间分为3阶段,50 min升温阶段,恒温阶段和30 min降温阶段,3阶段时间总和为正交表中蒸制时间[9-10]。试验烘干过程采取二次烘干法,第1次烘干根据正交试验表进行,第2次是把第一次烘干好的人参统一放入50℃的烘箱中烘至完全干为止[11-12]。实验共得9种红参样品。
2.2 人参总皂苷的测定
2.2.1 供试品溶液的制备 取红参100 g(红参原药材去芦头),粉碎过4号筛,混匀,取5 g粉末,精密称定,置圆底烧瓶中,加入三氯甲烷50 mL加热回流3 h,弃去三氯甲烷液[1];然后药渣挥干溶剂后,加入85%乙醇回流提取2次,每次加入量为40 mL,回流时间分别为2 h和1 h。提取液减压回收乙醇至无醇味,用0.5 mol/L氢氧化钠的20%的甲醇溶液转移定容至50 mL量瓶中。精密量取上述溶液10 mL,上预先处理好的DIKMA ProElutTMSPE小柱(先用约10 mL甲醇冲洗,再用0.5 mol/L的氢氧化钠的20%甲醇溶液约5 mL冲洗处理),以0.5 mol/L的氢氧化钠的20%甲醇溶液5 mL冲洗,流出液弃去,再以20%甲醇溶液10 mL冲洗,流出液弃去,最后用甲醇洗脱收集于10 mL量瓶中至近刻度,加甲醇至刻度,摇匀,过0.45 μm滤膜,取续滤液作为供试品溶液。
2.2.2 对照品溶液制备 精密称取人参皂苷Re对照品,加甲醇制成每1 mL含1.736 mg的溶液,摇匀,即得。
2.2.3 测定 精密量取对照品溶液20、40、60、80、100 μL及供试品溶液40 μL,分别置10 mL具塞试管中。置水浴中挥尽溶剂后取出,放冷,精密加新配制的5%香草醛-冰醋酸和高氯酸混和液(2∶8)1 mL,摇匀。置60℃水浴中加热15 min,取出,立即置冰浴中冷却2 min。精密加冰醋酸5 mL,摇匀,在室温下放置5 min。以相应试剂为空白,在550 nm处测定吸收度,计算,即得。
2.2.4 方法学考察 应用该方法测定红参药材中的人参总皂苷,标准曲线为y=0.473 4x-0.012 2(0.347 mg/mL≤x≤1.736 mg/mL),r2=0.999 2;重复性(n=6)RSD为1.33%;加样回收率(n=6)均在98.27% ~101.83%之间,RSD 为 1.40%。说明该方法可用于测定药材中人参总皂苷。
2.3 人参皂苷Rg3的测定
2.3.1 供试品溶液的制备 同2.2.1项。
2.3.2 对照品溶液制备 精密称取人参皂苷Rg3对照品,加甲醇分别制成每 1 mL含 0.400 mg、0.200 mg、0.100 mg、0.050 0 mg、0.010 0 mg 的溶液,摇匀。
2.3.3 色谱条件 Diamonsil TM C18(250 mm×4.6 mm,5 μm)色谱柱;以乙腈为流动相 A,以 0.05%磷酸溶液为流动相B,按表2进行梯度洗脱;检测波长为203 nm;柱温为30℃;体积流量1.0 mL/min;积分范围8~70 min。分别取对照品溶液和供试品溶液各10 μL,注入色谱仪,测定。该色谱条件下,Rg3得到较好的分离。见图1。
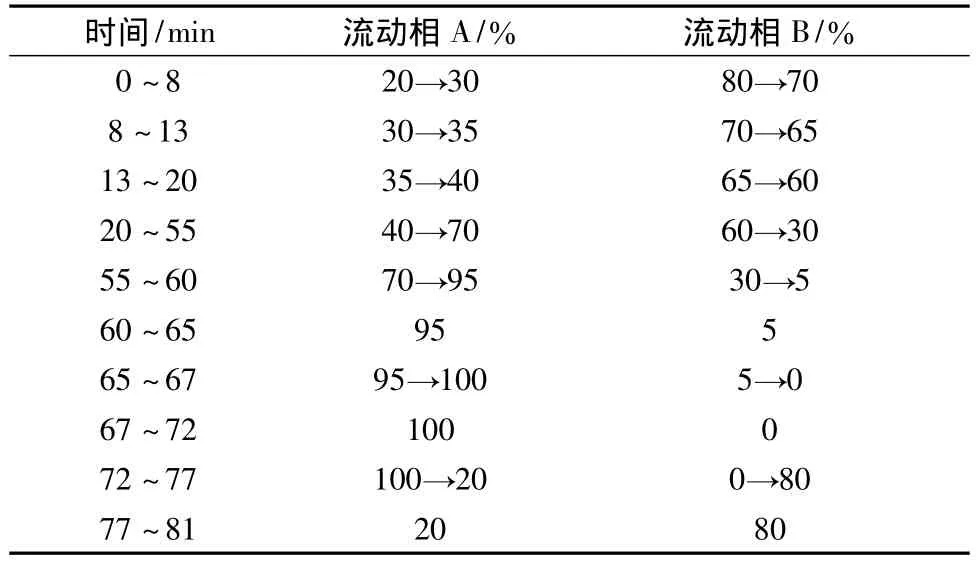
表2 梯度洗脱程序Tab.2 Mobile phase program of gradient elution

图1 人参总皂苷Rg3对照品及红参药材样品色谱图Fig.1 Chromatograms of reference substance of Rg3and Ginseng Radix et Rhizoma rubra
3.3.4 方法学考察 应用该方法测定红参药材中的人参皂苷Rg3,标准曲线为y=8×106x+1 733.9(0.010≤x≤0.400 mg/mL),r2=0.999 9;仪器精密度(n=5)RSD为0.10%;重复性(n=6)RSD为1.09%;样品在24 h内稳定性RSD为0.46%;加样回收率(n=6)均在98.13% ~100.74%之间,RSD为1.06%。说明该方法准确稳定,可用于测定药材中人参皂苷Rg3。
3 实验结果
3.1 正交试验结果 见表3。

表3 正交试验结果Tab.3 Results of the orthogonal test
3.2 人参总皂苷的方差分析 见表4。
3.3 人参皂苷Rg3的方差分析结果 见表5。

表5 方差分析结果-人参皂苷Rg3Tab.5 Variance analysis results of ginseng Rg3
4 分析与讨论
4.1 由表3和表4,因素A对人参总皂苷有极显著性影响(P<0.01),因素 C有一定影响(P<0.10),各因素对人参总皂苷影响的主次关系为A>C>B。从均值看,因素A和C各水平顺序均为K2>K1>K3,说明3个水平中,A2C2,即蒸制4 h,烘干10 h总皂苷质量分数最高。
4.2 由表3和表5,因素B和C对人参皂苷Rg3有一定影响(P<0.10)。各因素对人参皂苷Rg3影响的主次关系为C>B>A。从均值看,因素C各水平顺序为K1>K2>K3,因素B各水平顺序为K3>K2>K1,说明3个水平中,B3C1,即70℃烘干8 h Rg3最高。
4.3 综合考虑人参总皂苷和Rg3的质量分数,我们最终选择的最优加工方案为A2B3C1,即鲜人参洗尽后,蒸制4 h,70℃下烘8 h,然后在50℃下彻底烘干。
5 验证试验
按上述优化的最佳条件,加工3批红参药材,并检测其人参皂苷Rg3和总皂苷。结果见表6。3批验证试验结果表明该工艺稳定可行。

表6 3批红参加工试验结果Tab.6 Test results of samples
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:143.
[2]石楸鸣.人参皂苷的药理作用研究进展[J].中国药房,2010,21(31):2967-2969.
[3]李向高,郑毅男,张连学,等.田七素在加工红参中的变化及其转化机理[J].吉林农业大学学报,2005,27(04):405-407.
[4]李向高.人参加工炮制前后化学成分的变化[J].中国中药杂志,1986,11(4):194-199.
[5]李 震,刘 兵,李文艳.改进工艺提高红参加工质量[J].人参研究,2001,13(3):37.
[6]于晓黎.正交法优选麸炒枳实最佳炮制工艺[J].中成药,2010,32(7):1166-1168.
[7]王 平,韩丽妹,王建新.正交设计法优化炒牛蒡子的炮制工艺[J].中成药,2010,32(4):607-610.
[8]张宪臣.红参炮制及红参与五味子配伍的化学研究[D].吉林:吉林农业大学,2006.
[9]李景发,李吉成,王玉良.红参加工工艺的研究[J].中成药研究,1983,6(12):8.
[10]蔡荣春,安克全,郝绍卿.浅谈红参的加工技术[J].特产研究,1984,23(3):41-42.
[11]李 刚,郭耀忠,车熙哲.常压蒸参加工红参技术工艺[J].中国林副特产,1989,4(9):40.
[12]朴秀吉,金玄吉.高丽红参加工技术[J].吉林农业,2010,22(1):73.

