栽培灯盏花提取物的药效学研究
苏 梅, 杨和金, 崔 涛, 杨宏博, 赵春梅, 杨生元
(云南省药物研究所,云南昆明 650111)
灯 盏 细 辛Erigeron breviscapus(Vant.)Hand.Mazz,又名灯盏花,为菊科植物短亭飞蓬的干燥全草,是云南省民族民间常用中草药,具有活血通络止痛,祛风散寒的功效。临床上用于治疗缺血性心脑血管疾病,特别是对中风性偏瘫、胸痹心痛等症有非常良好的作用[1]。本研究中的灯盏花提取物是应用现代化学技术手段从驯化栽培的灯盏细辛全株植物中提取分离得到的混合物,它主要含有灯盏花乙素、飞蓬苷、总咖啡酸酯和少量灯盏花甲素等成分。研究证明灯盏花乙素为灯盏细辛的主要活性成分之一[2-3];李国辉等用近红外光谱鉴别证明栽培灯盏花和野生灯盏花的主要化学成分灯盏花乙素含量有明显的差别,其范围是:种植灯盏花素0.2% ~0.5%,野生灯盏花素0.085% ~0.15%。栽培灯盏花中灯盏花乙素含量明显高于野生的灯盏花,生药质量优于野生灯盏花[4]。根据原野生植物的药理作用、临床功效和该提取物的药效初筛结果,我们对其治疗缺血性心脑疾病的有效性进行研究,为灯盏细辛的人工栽培和深入研究提供可靠的药效学研究依据。
1 实验仪器与材料
1.1 实验仪器 TM1024全自动生化分析仪,日本东京株式会社;UV-2501紫外分光光度计,日本岛津公司生产;Centrifuge 5810R型冷冻离心机,德国eppendoff公司;BS110型电子分析天平,赛多利斯公司;6951D型心电机,北京普利生集团;MIAS医学图象分析系统,北京航空航天大学图象中心。
1.2 受试药品 栽培灯盏花提取物为黄色粉末(以下简称灯盏花提取物),原材料来自云南省石林县鹿阜镇种植地,提取物批号:20071104,由云南省药物研究所植化室提供。根据预试验结果,20 mg/kg为初始起效剂量,因此正式试验时设60、40和20 mg/kg 3个剂量组,临用前用0.2%CMC-Na配制成所需浓度供动物灌胃给药用。
1.3 对照药品 灯盏花素片(由天然灯盏花提取物制备,临床剂量换算大鼠的用量为12.33 mg/kg),云南省药物所制药厂生产,批号20080616。试验时大鼠用量为60 mg/kg,临用前用0.2%CMC-Na配制成所需的浓度,供动物灌胃给药用。
1.4 试剂 红四氮唑(TTC),Sigma公司出品,批号:20030609;肌酸激酶(CK)试剂盒,批号:20090806,南京建成生物制品研究所;乳酸脱氢酶(LDH)试剂盒,批号:20090806,南京建成生物制品研究所;MDA试剂盒,批号:20090904,南京建成生物工程研究所;SOD试剂盒,批号:20090904,南京建成生物工程研究所;蛋白定量试剂盒,批号:20090904,南京建成生物工程研究所。
1.5 实验动物及饲养条件 SD雄性大鼠,体质量200~250 g;由昆明医学院动物中心提供,许可证号:SCXK(滇)20050008;饲料许可证:SCXK(滇)20050009;动物使用许可证:SCXK(滇)20050001。饲养于本所天然药物筛选研究中心动物实验室,温度:20~26℃(日温差≤4℃);湿度:40% ~70%;换气次数:10~20次/h;气流速度:0.1~0.2 m/s;噪音:≤60 dB;工作照度:150~300 lx;动物照度:15~20 lx;照明:12 h:12 h明暗交替。
2 实验方法
2.1 灯盏花提取物对局灶性脑缺血损伤模型的影响[5-8]
2.1.1 大脑中动脉阻断(Middle cerebral artery occlusion,MCAO)模型的制备和给药方案 110只雄性大鼠,随机分为假手术组(Sham Operation,SHO)、模型组(Model)、灯盏花素片组(Breviscapinun Tablet,BCT)、灯盏花提取物(Extract of CulturalErigeron Breuiscapus,ECEB)(60、40、20 mg/kg)3 个剂量组,假手术组10只动物,各造模组20只。空白组和模型组给等容量的0.2%CMC-Na溶液,其余各组均按剂量给药,连续给药8 d,于末次给药后30 min,腹腔注射35%水合氯醛(350 mg/kg)麻醉,仰卧位固定,沿颈正中线切开皮肤,暴露右侧颈总动脉,分离颈内、外动脉,从颈外动脉游离端插入3#尼龙线(直径0.285 mm),从颈外动脉远心端将尼龙线导入到颈内动脉,插至Willis环大脑中动脉处,以有效阻断大脑中动脉,插入的尼龙线长度距颈总动脉分叉处18~20 mm。然后将颈外动脉游离端连同腔内尼龙线一并结扎,以防出血。逐层缝合皮下筋膜和皮肤,局部滴加抗菌素防止感染。右侧上肢未见明显偏瘫的大鼠从试验中剔除。各组挑选神经功能评分值在8~11分的动物10只。
2.1.2 观察指标
2.1.2.1 神经功能损害程度评定 分别于造模后3、6、12、24 h根据下述表1评分标准,采用盲法对动物进行行为障碍评分,用于评价神经功能的损害程度,总分为16分,分数越高,表明动物神经功能损害程度越严重。
2.1.2.2 对24 h大脑梗死范围的影响 造模24 h后,断头取脑,迅速冰冻,沿冠状面切成2 mm厚的切片,脑片放入1%TTC染液中,避光37℃温孵30 min进行染色,10%甲醛溶液固定一周后,采用数码相机成像系统将数字影象存储于计算机中,并用北京航空航天大学图象中心的MIAS医学图象分析系统测量梗死区和全脑面积,计算脑梗死范围(梗死区面积占全脑面积百分比)。
2.1.2.3 对24 h大脑水含量的影响 将染色后的脑组织置于60℃烘箱中,烤至恒重,称定其干质量,计算脑含水量。脑组织含水量(%)=(1-脑组织干质量/脑组织湿重)×100%。
2.1.2.4 对大脑海马中 MDA、SOD、GSH-Px 的影响 取脑后迅速取出海马,置于冰箱 (-20℃)保存备用。10 d内,加入适量2~3℃生理盐水研磨制成10%的脑组织匀浆,离心取上清液按试剂盒方法测定MDA量和SOD、GSH-Px活力。

表1 MCAO大鼠神经功能损害程度评分标准Tab.1 Scoring standard of neurofunctional injury in MCAO rats
2.2 灯盏花提取物对心肌缺血的影响[9-12]
2.2.1 模型制备和给药方案 110只SD大鼠,雌雄各半,随机分为假手术组(Sham Operation,SHO)、模型组(Model)、灯盏花素片组(Breviscapinun Tablet,BCT)、灯盏花提取物(Extract of CulturalErigeron Breuiscapus,ECEB)(60、40、20 mg/kg)3 个剂量组,假手术组10只动物,各造模组20只。空白组和模型组给等容量的0.2%CMC-Na溶液,其余各组均按剂量给药,连续给药8 d,于末次给药后30 min,腹腔注射35%水合氯醛(350 mg/kg)麻醉,仰卧位固定,行开胸手术暴露心脏,于左心耳与肺动脉圆锥处下方穿线结扎冠状动脉左支,假手术组仅置线头不结扎,心脏快速复位并关闭胸腔。收紧结扎线造成缺血,以收紧结扎线后动物的心电图标准导联ST抬高为模型成功,各组挑选模型成功动物10只。
2.2.2 观察指标
2.2.2.1 对心肌缺血大鼠Ⅱ导心电图ST段的影响
记录结扎前及结扎后 5、30、120、240 min肢体Ⅱ导联心电图,测量ST段的变化值。
2.2.2.2 对心肌缺血大鼠心肌酶学的影响 动物造模24 h测定心电图后,颈动脉插管取血,分离血清按试剂盒方法测定LDH和CK的活性。
2.2.2.3 对大鼠心肌梗死范围的影响 取血后处死动物迅速摘出心脏,置于冰生理盐水中泵出心腔内积血,去掉心房及脂肪组织,吸干水分称取心室重,随后沿冠状切成5片,在2%TTC溶液中避光于37℃ 孵育染色10 min。经染色后,正常心肌组织呈红色,而梗死组织呈白色,将梗塞部位剪下称重,以梗死部分占心室重的百分比为心肌梗死范围的指标。2.3 统计方法 采用统计软件SPSS17.0进行单因素方差分析,实验结果以±s表示。
3 试验结果
3.1 灯盏花提取物对脑缺血的影响
3.1.1 灯盏花提取物对MCAO大鼠神经功能障碍的影响 大鼠MCAO造模后,活动减少,与假手术组比较动物出现明显的神经功能障碍(P<0.001)。灌服灯盏花提取物的大鼠神经功能障碍均有不同程度改善,与模型组动物比较具有显著性差异,6 h时60 mg/kg剂量改善了 27.05%(P<0.01),12 h 时60、40 mg/kg剂量分别改善了39.32%(P<0.01)、23.60(P<0.05),24 h 时 60、40 mg/kg剂量分别改善了43.26%(P< 0.01)、31.73%(P< 0.05),20 mg/kg剂量在24 h神经功能障碍评分具有显著意义,改善率为24.03%(P<0.05)。与相同剂量的灯盏花素片比较,该提取物对MCAO大鼠神经功能障碍的改善作用(P<0.01)强于灯盏花素片(P<0.05),且其起效时间更早。见图1。
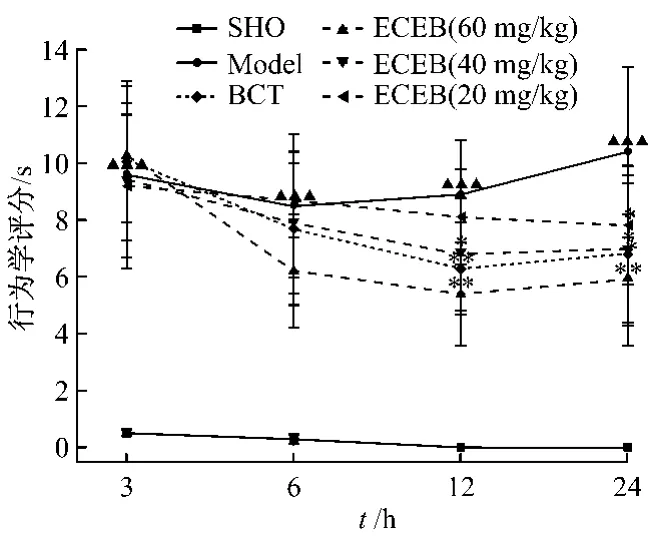
图1 灯盏花提取物对MCAO大鼠神经功能障碍的影响(± s,n=10)Fig.1 The effect of extract from Erigeron Breusicapus on the neurological deficit of MCAO rats(± s,n=10)
3.1.2 灯盏花提取物对MCAO大鼠脑梗死范围的影响 从表2可看出模型组动物的脑梗死范围明显增加,该灯盏花提取物60、40 mg/kg剂量能显著缩小MCAO大鼠的大脑梗死范围,且作用成剂量依赖关系,脑梗死范围分别缩小了42.59%、35.86%。与相同剂量的灯盏花素片比较,该提取物抗脑梗死的作用(P<0.01)优于灯盏花素片(P<0.05)。
表2 灯盏花提取物对MCAO大鼠脑梗死范围的影响(± s,n=10)Tab.2 The effect of extract from Erigeron Breusicapus on cerebral infarction size of MCAO rats(± s,n=10)

表2 灯盏花提取物对MCAO大鼠脑梗死范围的影响(± s,n=10)Tab.2 The effect of extract from Erigeron Breusicapus on cerebral infarction size of MCAO rats(± s,n=10)
注:与假手术组比较,▲P <0.05,▲▲P <0.01,▲▲▲P <0.001;与模型组比较,*P <0.05,**P <0.01。▲P <0.05,▲▲P <0.01,▲▲▲P <0.001,vs SHO group;*P <0.05,**P <0.01,vs model group.
组别 剂量/(mg/kg) 脑梗死范围/% 缩小率/%SHO CMC-Na 20 mL/kg 0.0 ±0.0—ModelCMC-Na 20 mL/kg 21.08 ±7.15▲▲▲ —BCT 60 14.80 ±5.56* 29.79 ECEB 60 12.10 ±5.02** 42.59 40 13.52 ±6.32* 35.86 20 16.56 ±4.57 21.14
3.1.3 灯盏花提取物对MCAO大鼠大脑含水量的影响 与假手术组比较,模型组动物大脑含水量明显增加,出现显著的脑水肿现象。灌服灯盏花提取物60、40 mg/kg剂量的大鼠大脑含水量显著降低,降低率为75.46%、37.5%。结果显示该灯盏花提取物对MCAO大鼠的大脑含水量有显著的抑制作用,其抑制作用(75.46%)显著大于相同剂量的灯盏花素片(40.28%)。见表3。
表3 灯盏花提取物对MCAO大鼠大脑含水量的影响(± s,n=10)Tab.3 The effect of extract from Erigeron Breusicapus on the water content in the brain tissues of MCAO rats(± s,n=10)

表3 灯盏花提取物对MCAO大鼠大脑含水量的影响(± s,n=10)Tab.3 The effect of extract from Erigeron Breusicapus on the water content in the brain tissues of MCAO rats(± s,n=10)
注:与假手术组比较,▲P <0.05,▲▲P <0.01,▲▲▲P <0.001;与模型组比较:*P<0.05,**P<0.01;与同剂量的灯盏花素片(BCT)比较:▼ P <0.05。▲P <0.05,▲▲P <0.01,▲▲▲P <0.001,vs SHO group;*P <0.05,**P <0.01,vs model group;▼ P <0.05,vs BCT group.
组别 剂量/(mg/kg) 脑含水量/% 脑水肿抑制率/%SHO CMC-Na 20 mL/kg 77.36 ±0.44—ModelCMC-Na 20 mL/kg 79.52 ±0.99▲▲▲ —BCT 60 78.65 ±0.51* 40.28 ECEB 60 77.89 ±0.89***▼ 75.46 40 78.71 ±0.55* 37.5 20 78.98 ±0.83 25.0
3.1.4 灯盏花提取物对MCAO大鼠大脑脂质过氧化的影响 模型组动物大脑海马中的SOD(P<0.01)、GSH-PX(P<0.001)水平较正常组明显降低,MDA(P<0.05)水平显著升高;表明大鼠脑缺血损伤后引起明显脑脂质过氧化反应,灌服灯盏花提取物的大鼠大脑海马中MDA的含量显著降低,SOD、GSH-PX的活力显著增加。结果提示该灯盏花提取物具有明显的抗氧化作用,其抗氧化作用强于相同剂量的灯盏花素片。见图2。
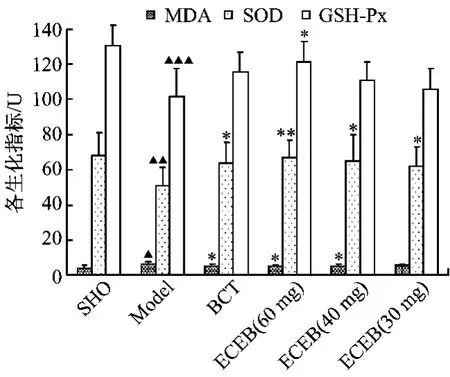
图2 灯盏花提取物对MCAO大鼠大脑MDA、SOD、GSH-Px的影响(± s,n=10)Fig.2 The effect of extract from Erigeron Breusicapus on MDA,SOD and GSH-Px in the brain of MCAO rats(± s,n=10)
3.2 抗心肌缺血的作用
3.2.1 对心肌缺血大鼠心电图J点的影响 大鼠冠状动脉前降支结扎后,各组动物与术前组和假手术比较Ⅱ导心电图ST段都显著抬高,模型组尤为显著。术后5、30、120、240 min各时间点上,与模型组比较灌服灯盏花提取物的大鼠ST段抬高程度均显著低于模型组。见图3。
3.2.2 对大鼠心肌梗塞范围的影响 冠状动脉结扎24 h后,大鼠心肌组织出现明显的缺血梗死区,灌服灯盏花提取物60、40 mg/kg剂量的大鼠心肌梗死范围显著缩小,与模型组动物比较缩小率分别为38.6%、20.7%,提示该提取物对大鼠急性心肌梗死有显著的拮抗作用,其作用(▲▲P<0.001)优于同剂量的灯盏花素片(▲▲P<0.01)。见表4。
3.2.3 对心肌缺血大鼠心肌酶LDH和CK活性的影响 从图4可看出大鼠冠状动脉结扎24 h后,血清中的LDH和CK含量显著增高,与假手术组比较具有显著性差异(▲▲P<0.01)。灌服灯盏花提取物的大鼠血清中的LDH和CK的含量均显著降低,其作用与同剂量的灯盏花素片相当。见图4。
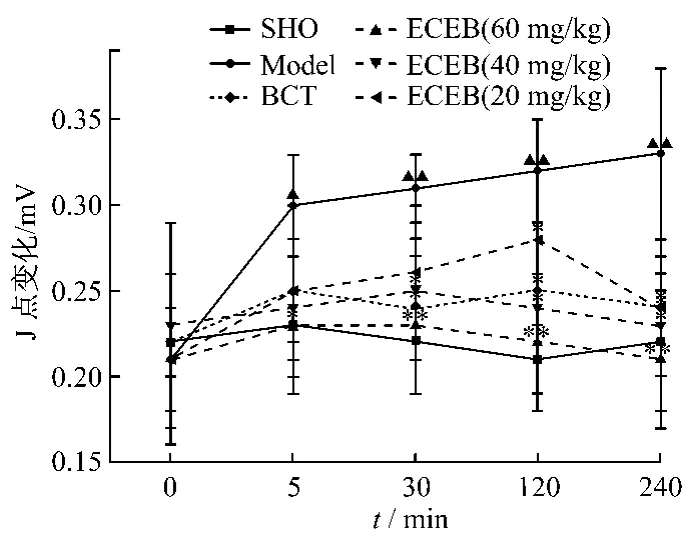
图3 灯盏花提取物对急性心肌缺血大鼠心电图ST段抬高的影响(± s,n=10)Fig.3 The effect of extract from Erigeron Breusicapus on ST-segment elevation of electrocardiogram in myocardial ischemia of rats(± s,n=10)
表4 灯盏花提取物对大鼠心肌梗塞范围的影响(± s,n=10)Tab.4 The effect of extract from Erigeron Breusicapus on myocardial infarction size in rats(± s,n=10)

表4 灯盏花提取物对大鼠心肌梗塞范围的影响(± s,n=10)Tab.4 The effect of extract from Erigeron Breusicapus on myocardial infarction size in rats(± s,n=10)
注:与假手术组比较,▲P <0.05,▲▲P <0.01,▲▲▲P <0.001;与模型组比较,*P <0.05,**P <0.01。▲P <0.05,▲▲P <0.01,▲▲▲P <0.001,vs SHO group;*P <0.05,**P <0.01,vs model group.
组别 剂量(mg/kg) 心肌梗塞范围/% 缩小率/%SHO CMC-Na 20 mL/kg 0—Model CMC-Na 20 mL/kg 33.28 ±5.60▲▲ —BCT 60 25.79 ±2.84** 22.51 ECEB 60 20.43 ±4.62*** 38.6 40 26.38 ±3.58** 20.7 20 29.27 ±5.13 12.1
4 讨论

图4 灯盏花提取物对心肌缺血大鼠LDH和CK-MB活性的影响(± s,n=10)Fig.4 The effect of extract from Erigeron Breusicapus on the activity of LDH and CK-MB in myocardial ischemia of rats(± s,n=10)
灯盏细辛是十分重要的野生天然药物,为目前治疗缺血性心脑血管疾病最为有效的天然药物,有效率达95%以上,且其毒副作用较低、临床治疗安全、适用,被列为国家中药保护品种[13]。近年来由于心脑血管疾病的高发,人们对这种高效低毒药物的需求快速增长,而由于过度的采挖,野生资源在不断的减少,有的地区资源已处于枯竭状态。为缓解供求矛盾,90年代中期人们开始引种驯化栽培灯盏花,云南作为灯盏花的主产地,已建立了多个灯盏花的规模化种植基地,目前有的还建成了GAP基地。本研究中的灯盏花提取物就是应用现代化学技术手段从驯化栽培的灯盏细辛全株植物中提取分离得到的混合物。根据原野生植物的药理作用、临床功效和该提取物的药效初筛结果,我们选择了与人类缺血性心脑疾病相似的动物模型:大鼠MCAO致局灶性脑缺血、大鼠冠状动脉结扎致心肌缺血模型对其治疗心脑血管疾病的有效性进行研究,来验证该提取物的抗脑缺血和心肌缺血的作用。试验结果显示:该提取物能显著改善MCAO大鼠的神经功能障碍、缩小脑梗死范围和抑制脑水肿,明显降低MCAO大鼠大脑中的MDA,增加SOD、GSH-PX的的活力。对冠状动脉结扎大鼠心电图ST段的抬高程度有显著的降低作用,还可显著缩小冠状动脉结扎大鼠的心肌梗死范围和降低血清中CK-MB和LDH的活性。以上结果证明该提取物对实验性大鼠脑缺血和急性心肌梗死损伤具有显著的保护作用,其保护作用优于同等剂量的灯盏花素片。
以上实验结果证明栽培灯盏花提取物具有明确的抗脑缺血、抗心肌缺血的作用。在确保疗效的基础上,人工栽培灯盏花不仅解决了灯盏花野生资源的不足和满足了广大患者对灯盏花素的需求,最关键的是它降低了人类对生态环境的破损强度。因此灯盏花的驯化栽培成功不仅具有医学意义,更具有十分重要的社会环境意义,在今后的深入研究和临床应用中它比野生天然灯盏花更具有可持续发展的优势。
[1]中国药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:138.
[2]雷 婷,王建超,刘光明.灯盏花素在心脑血管疾病中的药理作用研究进展[J].医学综述,2009,15(18):2844-2846.
[3]张 峻,李雪松,张卫东.中药灯盏花化学成分与药理活性研究进展[J].药学实践杂志,2002,20(2):103-107.
[4]李国辉,张录达,杨建文.栽培和野生中药材灯盏花的近红外光谱鉴别模型[J].光谱学与光谱分析,2007,27(10):1959-1961.
[5]徐叔云.药理实验方法学[M].北京:人民卫生出版社,2006:1061.
[6]陈小夏,何 冰.灯盏花素对大鼠脑缺血再灌注损伤的保护作用[J].广东药学院学报,1997,13(2):90-93.
[7]王雪松,阮旭中,刘买利.灯盏花素对缺血再灌注鼠脑损伤的脑保护作用研究[J].中成药,2002,24(4):947-950.
[8]何 蔚,陈 汇,曾繁典.灯盏花素对脑缺血再灌注损伤的保护作用和治疗时间窗[J].中国临床药理学与治疗学,2003,8(3):278-281.
[9]徐叔云.药理实验方法学[M].北京:人民卫生出版社,2006:1065.
[10]张晓丹,刘 婧,张伟兵,等.灯盏花素心血管药理及临床研究进展[J].中国药业,2007,16(21):3-5.
[11]梁 冰,李淑芳,宛 蕾,等.复方灯盏花滴丸对大鼠实验性急性心肌梗死的保护作用[J].中药药理与临床,2007,23(4):38-40.
[12]赖 宇,堵伟锋.灯盏花素对大鼠心肌缺血-再灌注损伤的实验研究[J].淮海医药,2008,26(5):440-441.
[13]朱 媛,杨生超,祖艳群,等.灯盏花栽培技术及有效成分积累研究进展[J].安徽农业科学,2009,37(10):4499-4509.

