甘露聚糖酶与番茄果实硬度的关系
张丙秀 李景富 王傲雪 许向阳
(东北农业大学园艺学院,黑龙江 哈尔滨 150030)
细胞壁成分的解离是果实软化的直接原因(Fischer & Bennett,1991),番茄(Lycopersicon esculentum Mill.)果实细胞壁主要由半纤维素、纤维素、果胶和蛋白组成,占干物质质量的90 %(Redgwell & Fischer,2002),番茄果实半纤维素中的甘露糖多以甘露聚糖的形态存在(Seymour et al.,1990),甘露聚糖酶(Endo-β-1, 4-mannanas)的功能就是水解甘露聚糖之间的β-1, 4共价键(Bewley,1997)。番茄不成熟突变体及一些能正常成熟品种果实中甘露聚糖酶活性很低或没有活性,这些品种果实的软化程度较慢(Bewley et al.,2000;Banik et al,2001),所以该酶可能与果实的软化相关,但还不明确该酶在果实软化中是否起到重要作用。目前,番茄果实中的甘露聚糖酶基因已经被克隆出来,被命名为LeMan4基因(Carrington et al.,2002)。反义 RNA技术是研究基因功能的一种有效途径(宋艳茹和马庆虎,1995),该技术在油菜(Knutzon et al.,1992)、苹果(Dandekar et al.,2004)、西洋梨(Gao et al.,2007)等作物上得到了成功的应用。在蔬菜学领域,研究较深入的就是耐贮运番茄的培育,Hamilton等(1990)将ACC氧化酶的反义RNA导入番茄植株,使成熟果实的乙烯产生受到97 %的抑制,转基因番茄在室温下的贮存时间明显比对照长。反义RNA技术在保鲜贮存方面研究的诱人前景,已成为选育耐贮藏果树新品种有效的途径之一(Petri & Burgos,2005)。鉴于此,本试验构建了LeMan4基因反义表达载体并将其导入番茄基因组,以期获得LeMan4基因表达的缺陷型植株,探讨LeMan4基因在番茄果实软化中的作用,并为选育耐贮番茄新品种提供材料。
1 材料与方法
1.1 材料及试剂
植物材料:番茄品种Micro-Tom,由东北农业大学番茄课题组提供。
菌株及载体:大肠杆菌DH5α、农杆菌EH105及载体pBI121,由东北农业大学番茄课题组提供。
试剂:LA Taq DNA聚合酶、DL 2000marker、各种限制性内切酶(SmaⅠ、SacⅠ及HindⅢ)、RT-PCR试剂盒购于 TaKaRa公司;胶回收试剂盒购自上海华舜公司;pGEM-Teasy Vector,T4DNA连接酶为Promaga公司的产品;MS Salts为Sigma公司产品;Trizol及引物购于上海生工生物工程技术服务有限公司;Southern 杂交采用罗氏的地高辛试剂盒;其他试剂均为国产的分析纯。
1.2 方法
1.2.1 果实硬度的测定 按照不同成熟度分为4个时期采果实测定:G,绿熟期(果实亮白,或转色面积不超过10 %);T,转色期(果实表面10 %~60 %转为淡黄或红色);OR,橙红期(果实表面60 %以上转为全黄或红色);R,红熟期(果实着色为全黄或全红)。
每个处理5个果实,采用手持式果实硬度计(FHM5),沿番茄果实赤道线中部(即果实最大横径处)对着心室腔随机取3点测试硬度,取平均值。
1.2.2 番茄果皮总RNA提取及LeMan4 cDNA的克隆 番茄果皮总RNA提取依照Trizol试剂的说明书进行。
根据Genebank登陆的LeMan4 cDNA序列设计引物,两条引物的5' 端插入限制性内切酶位点,并在酶切位点之外再加上了两个保护碱基,在上游引物的5' 端加上AACA框和起始密码子。上游引物(P1):5' TCCCCCGGGAACAATG CTATGATAGCTTAGAGAGCC,下游引物(P2):5' CGAGCTC CTAATGAATAACTCAATCATCTTAATTTTTG。
以番茄果皮总RNA为模板,P1、P2为PCR 引物进行RT-PCR。cDNA第一链的合成反应条件为30 ℃ 5min,42 ℃ 3 h,95 ℃ 5min灭活逆转录酶;PCR反应条件:94 ℃变性5min,94 ℃变性30 s,55 ℃复性45 s,72 ℃延伸90 s,共30个循环,最后72 ℃保温10min。获得的PCR产物纯化后克隆到pGEM-Teasy上,转化大肠杆菌DH5α,经蓝白斑筛选和质粒酶切初步鉴定后测序,获得克隆载体。
1.2.3 LeMan4反义基因植物表达载体的构建 用 SmaⅠ和 SacⅠ将克隆载体上的目的基因切下,插入载体pBI121的相应克隆位点,构建植物表达载体(图1)。采用菌落PCR法和限制性内切酶酶切法进行鉴定。
1.2.4 反义LeMan4的转化及检测分析 采用冻融法将表达载体导入根癌农杆菌 EHA105(王关林和方宏筠,2002)。叶盘法转化番茄(McCormick et al.,1986)。将番茄种子用70 %乙醇浸泡30 s后,用10 %次氯酸钠消毒15min,接种于无菌苗培养基(MS+蔗糖15g·L-1+琼脂 7 g·L-1),置于(26±2)℃、16h光照培养,待子叶展开时,在无菌条件下切下子叶放在培养基(MS+NAA 1mg·L-1+BAP 1mg·L-1+蔗糖 30 g·L-1+琼脂 8g·L-1)中预培养1d。挑取pBI121-RLeMan4单菌落,接种于5mL含卡那霉素50mg·L-1的YEP液体培养基中,28 ℃、200 r·min-1振荡过夜培养,菌液长至OD600=0.4~0.6时,按1∶10的比例稀释菌液,再进行二次活化,OD600=0.5~0.6时,4 ℃、2000 r·min-1离心 10min,收集细菌细胞,用 2 % MS液体培养基悬浮沉淀至OD600=0.5左右,以该菌液对外植体进行侵染。将预培养后的外植体放入农杆菌菌液中侵染 20min,其间轻轻摇动几次,放入共培养基(MS+NAA 1mg·L-1+BAP 1mg·L-1+蔗糖30 g·L-1+琼脂8g·L-1)中48h后,转移至芽诱导培养基〔MS+头孢噻肟钠500mg·L-1+卡那霉素50mg·L-1+蔗糖 30 g·L-1+琼脂 7 g·L-1+ZT 2mg·L-1(14d后 ZT 1mg·L-1)〕,每隔 14d继代1次,以未侵染的子叶为对照,形成芽的外植体切成小块转移到芽伸长培养基(MS+ZT 1mg·L-1+GA 1mg·L-1+蔗糖 15g·L-1+琼脂7 g·L-1+头孢噻肟钠500mg·L-1+卡那霉素40mg·L-1),每隔10d继代1次,当芽长至2~4cm时切离外植体,转至生根培养基(MS+IBA 1mg·L-1+蔗糖15g·L-1+琼脂8g·L-1+头孢噻肟钠500mg·L-1+卡那霉素40mg·L-1)。植株长到5cm可驯化移栽到土中。
再生番茄植株的基因组 DNA采用 CTAB法提取。根据 NptⅡ序列设计引物:上游引物为5' ACTGGGCACAACAGACAA 3',下游引物为5' CCGTAAAGCACGAGGAA 3',以再生番茄基因组DNA为模板,进行抗性植株的PCR检测,PCR扩增条件:94 ℃预变性5min,94 ℃变性1min,55 ℃退火40 s,72 ℃延伸1min,35个循环,循环结束后72 ℃ 10min,4 ℃ 30min,终止反应。取PCR阳性植株基因组DNA 5~10μg,经Hind Ⅲ单酶切,以标记的NptⅡ探针进行Southern 杂交检测。
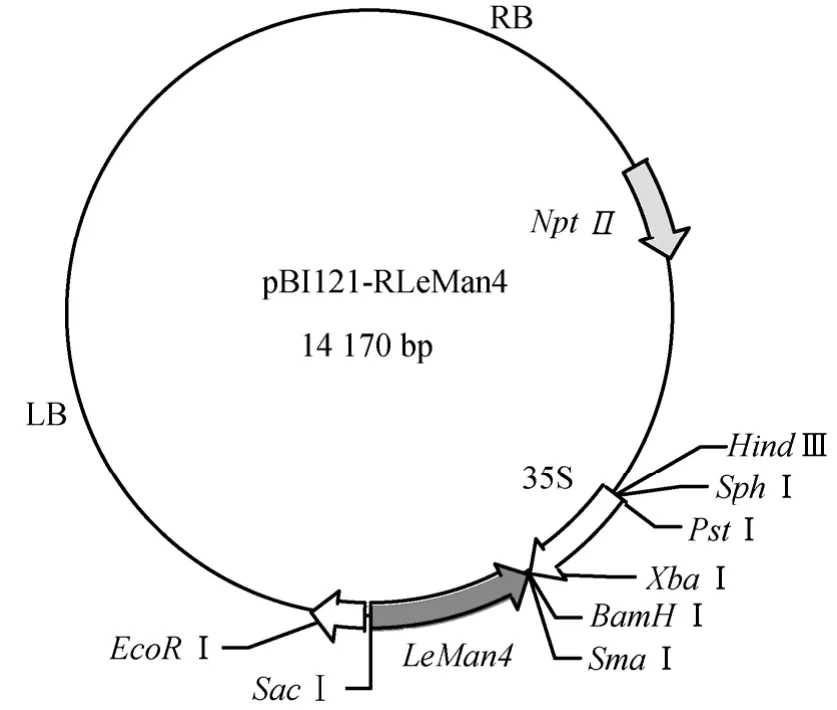
图1 反义表达载体pBI121-RLeMan4
2 结果与分析
2.1 LeMan4 cDNA的克隆、反义LeMan4植物表达载体的构建及农杆菌的转化
提取番茄果皮 RNA并进行逆转录,以逆转录产物为模板,P1和 P2为引物,55 ℃进行PCR扩增,琼脂糖电泳分析表明PCR 产物的长度在1200 bp左右,如图2。PCR 产物回收后与载体T-easy vector连接,酶切鉴定后(图3),交由上海生工生物工程技术服务有限公司测序。测序结果在Genebank上经Blast 比对与番茄果实LeMan4 cDNA序列同源性达100 %,将此克隆命名为 T-LeMan4。分别用限制性内切酶 SacⅠ和 SmaⅠ双酶切 pBI121质粒及T-LeMan4质粒。回收pBI121酶切产物的较大片断及T-LeMan4的小片断,二者4 ℃过夜连接。取连接产物转化大肠杆菌感受态细胞,然后涂布在含有卡那霉素(50mg·L-1)的LB固体培养基上,37 ℃培养过夜后选取菌落用于PCR检测,检测为阳性的菌落的质粒用SacⅠ和SmaⅠ进行双酶切鉴定,如图4。pBI121切下大小为1800 bp左右的GUS片断,质粒切下的片断大小为 1200 bp,证明 LeMan4反义基因已连接到 pBI121上。采用冻融法将重组质粒pBI121-RLeMan4转化制备好的农杆菌EHA105的感受态细胞,经含Km(50mg·L-1)+Rif(50mg·L-1)的YEB 平板筛选,挑取转化菌落,碱裂解法小量提取质粒后,进行限制性内切酶酶切鉴定,如图5。结果证明pBI121-RLeMan4已成功转化农杆菌菌株EHA105。
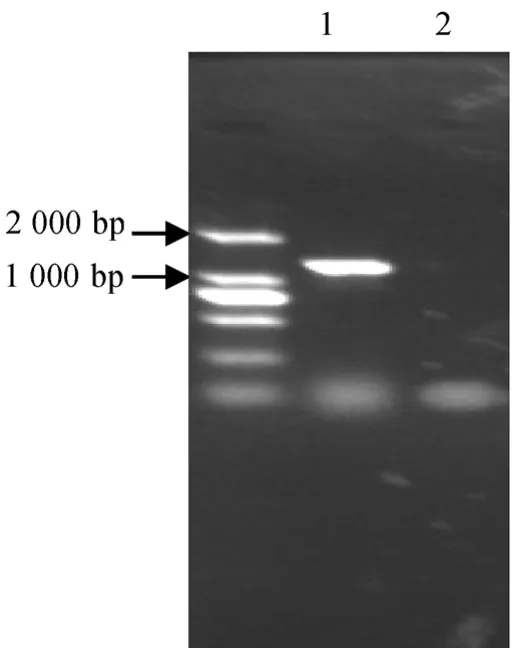
图2 RT-PCR产物电泳结果分析

图3 SacⅠ/SmaⅠ双酶切T-LeMan4
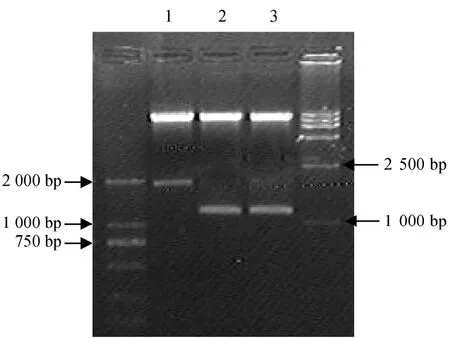
图4 pBI121-RLeMan4双酶切检测
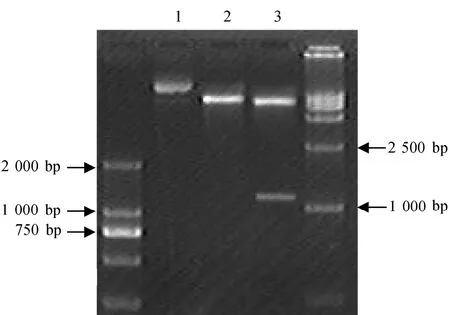
图5 pBI121-RLeMan4转化农杆菌双酶切检测
2.2 番茄的遗传转化
无菌条件下切下无菌苗子叶放于预培养基中培养1d后进行侵染。共培养48h后转移至芽诱导培养基培养,14d后对照变白最后死亡,形成芽的外植体切成小块转移到芽伸长培养基,每隔10d继代1次,当芽长至2~4cm时切离外植体,转至生根培养基。植株长到5cm驯化移栽到土中。植株长至10cm定植到温室。番茄品种Micro-Tom的遗传转化过程见图6,最终得到反义RNA抗性植株20株。
2.3 转基因植株的分子生物学
2.3.1 转基因植株的PCR检测 提取的抗性苗叶片总DNA经0.8 %琼脂糖检测表明质量较好,可以用于PCR扩增。根据NptⅡ序列引物,以质粒为阳性对照,非转基因植株为阴性对照,对获得的再生植株进行PCR检测,扩增片断长度为667 bp。扩增结果如图7。20株抗性植株中有13株表现为阳性。
2.3.2 转基因植株的Southern Blot检测 以质粒pBI121-RLeMan4为模板,利用NptⅡ基因片段设计的引物进行PCR扩增,然后回收PCR产物制备探针。提取 PCR检测为阳性植株的总DNA,经HindⅢ酶切,以标记的NptⅡ探针进行Southern杂交。由图8可见,在杂交后的膜上出现了杂交带,而阴性对照(非转基因植株)无杂交带。由此推断,NptⅡ基因片段已经整合到番茄的基因组中。最终,得到阳性的转基因植株11株。

图6 番茄叶片再生及抗性植株筛选
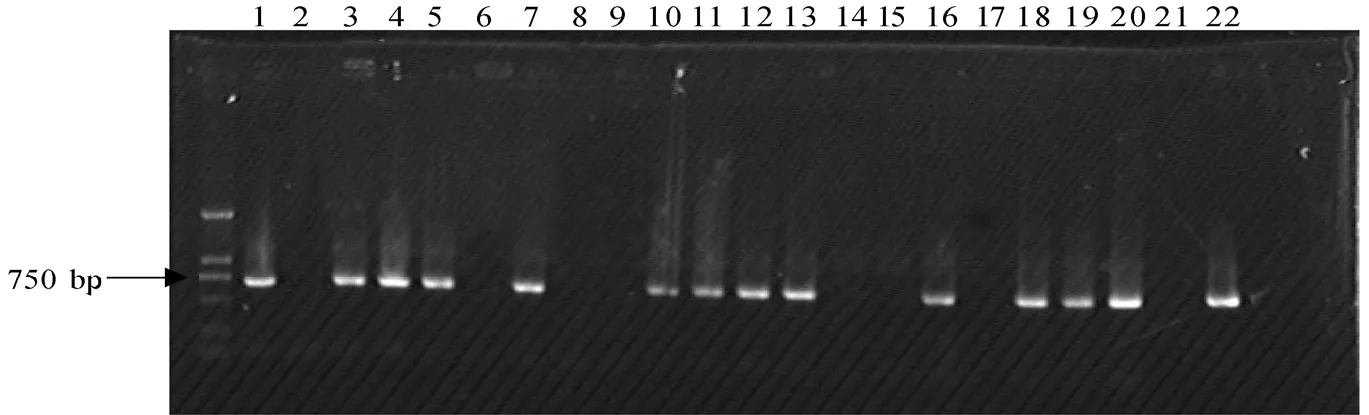
图7 pBI121-RLeMan4转化植株的PCR检测

图8 pBI121-RLeMan4转化番茄的Southern检测
2.4 转基因植株的甘露聚糖酶活性及硬度检测
转基因植株温室定植后,成活7株。从图9可以看出,在绿熟期和转色期,甘露聚糖酶的活性被完全抑制,橙红期后,各转基因果实又检测到甘露聚糖酶活性,但都在非转基因植株的12.2 %以下。在转色期和橙红期,果实硬度比对照高出较多,品系R7在橙红期比对照高出18.2%。红熟期后各转基因植株果实与对照硬度的差距减小。这可能是番茄果实内源甘露聚糖酶基因在橙红期后转录增强的结果。

图9 转基因植株果实甘露聚糖酶活性的变化

图10 转基因植株果实硬度的变化
3 结论与讨论
本试验从Micro-Tom果实得到甘露聚糖酶基因,并构建出反义RNA表达载体pBI121-R LeMan4。采用农杆菌介导法转化番茄,获得PCR阳性植株13株,Southren杂交阳性植株11株,为研究该基因在番茄果实成熟软化中的作用提供了试材。各转基因植株果实的甘露聚糖酶活性被抑制在12.2 %以下,但都能够成熟和软化,只是果实硬度比对照高,这说明甘露聚糖酶活性与果实软化有关,但却不是番茄果实成熟软化的必要因子。
利用反义 RNA技术对基因的表达进行抑制可以产生突变体,从而研究特定基因对细胞发育、分化及功能的影响,该技术在一些作物上得到了成功的应用。本试验通过反义 RNA 技术获得了LeMan4表达缺陷植株,但没有对转基因植株果实的LeMan4的基因表达量进行检测,但其抑制效果已经在生理水平上进行验证。
本试验结果证明甘露聚糖酶活性与果实软化有关,但甘露聚糖只占细胞壁成分的一小部分(Huysamer et al.,1997)。所以,甘露聚糖的降解可能通过间接途径影响了果实软化。例如,甘露聚糖降解所产生的甘露糖或甘露聚糖的寡糖可能用于半纤维素的重新合成(Bewley et al.,2000),这就有可能改变细胞壁中半纤维素、纤维素及果胶的连接方式,影响细胞壁结构的稳定性,使细胞壁更容易被其他水解酶降解。另外,本试验中甘露聚糖酶的活性虽然被抑制在较低水平,但转基因果实仍能成熟,只是硬度的变化受到影响,这说明甘露聚糖酶活性不是番茄果实成熟软化的必要因子,甘露聚糖酶很可能与其他细胞壁降解酶或修饰酶等协同作用,共同参与果实发育(王傲雪 等,2006)。但以上推测还需以获得的转基因果实为试材进行一系列的生理学、蛋白组学验证。
宋艳茹,马庆虎.1995.反义RNA与植物基因表达调控.植物分子生物学——成就与前景.北京:科学出版社:268-278
王关林,方宏筠.2002.植物基因工程.北京:科学出版社:397-400
王傲雪,张丙秀,李景富.2006.β-1,4-甘露聚糖内切酶在番茄发育中的作用.园艺学报,33(5):1157-1161
Banik M,Bourgault R,Bewley J D.2001.Endo-β-mannanase is present in an inactive form in ripening tomato fruits of the curtivar Walter.J Exp Bot,52:105-111.
Bewley J D.1997.Breaking down the walls-a role for endo-β-mannanase in release from seed dormancy?Trends in Plant Sci,2(12):464-469
Bewley J D,Banik M,Bourgault R,Feurtado J A,Toorop P,Hilhorst H W M.2000.Endo-β-mannanase increases in the skin and outer pericarp of tomato fruits during ripening.J Exp Bot,51:529-538
Carrington cm S,Vendrell M,Dominguez-Puigjaner E.2002.Characterisation of an endo-(1,4)-beta-mannanase (LeMAN4)expressed in ripening tomato fruit.Plant Sci,163(3):599-606
Dandekar A M,Teo G,Defilippi B G,Uratsu S L,PasseyA J,Kader A A,Stow J R,Colgan R J,James D J.2004.Effect of down-regulation of ethylene biosynthesis on fruit flavor complex in apple fruit.Transgenic Res,13(4):373 -384
Fischer R L,Bennett A B.1991.Role of cell wall hydrolases in fruit ripening.Annual Review of Plant Physiology and Plantmolecular Biology,42:67-73
Gao M,Matsuta N,Murayama H,Toyomasu T,MitsuhashiW,DandekarA M,Tao R,Nishimura K.2007.Gene expression and ethylene production in transgenic pear(Pyrus communis cv.‘La France’)with sense or antisense cDNA encoding ACC oxidase.Plant Sci,173(1):32-42
Hamilton A J,Lycett G W,Grenson D.1990.Antisense gene that inhibits synthesis of the hormone ethylene in transgenic plants.Nature,346(29):284-287
Huysamer M,Greve C,Labavitch J M.1997.Cell wall metabolism in ripening fruit.Ⅷ.Cell wall composition and synthetic capacity of two regions of the outer pericarp of mature green and red ripe cv.Jackpot tomatoes.Physiol Plant,101:314-322
Knutzon D S,Thompson G A,Radke S E,Johnson W B,Knauf V C,Kridl J C.1992.Modification of Brassiea seed oil by antisense expression of a stearoyl-acyl carrier protein desaturase gene.Proc Natl Acad Sci USA,89:2624-2628
McCormick S,Niedermeyer J,Fry J,Barnason A,Horsch R,Fraley R.1986.Leaf disc transformation of cultivated tomato(L.esculentum)using Agrobacterium tumefa-ciens.Plant Cell Rep,5:81–84.
Petri C,Burgos L.2005.Transformation of fruit trees.Useful breeding tool or continued future prospect? Transgenic Res,14(1):15-26
Redgwell R J,Fischer M.2002.Fruit texture:cell wall metabolism and consumer perception//Knee M.Fruit quality and its biological basis.Sheffield:Sheffield Academic Press:46-87
Seymour G B,Colquhoun I J,Dupont M S,Parsley K R,Sevendran R R.1990.Composition and structural features of cell wall polysaccharides from tomato fruits.Phytochemistry,29:725-731

