结肠腺瘤患者结肠黏膜5-HT表达和炎症的初步研究*
胡 莹 刘玉兰 蔡春晓 杨 静 朱元民
北京大学人民医院消化内科(100044)
结肠肿瘤的发生、发展与肠道炎症密切相关[1]。炎症性肠病(IBD)是结肠癌发生的危险因素,IBD相关和散发性结肠癌的发生可能与菌群诱导的肠道低度炎症相关[2]。结肠癌主要由结肠腺瘤发展而来,腺瘤易复发是其常见的临床特点[3,4],提示腺瘤患者结肠黏膜可能存在基础病变。分布于肠黏膜上皮之间的肠嗜铬(enterochromaffin,EC)细胞分泌的5-羟色胺(5-HT)与肠道炎症密切相关,EC细胞和5-HT在肠道炎症动物模型和IBD中表达增高[5]。5-HT与结肠腺瘤患者炎症的关系尚未阐明。本研究通过检测结肠腺瘤患者正常黏膜炎症相关指标和5-HT表达相关指标,旨在证实腺瘤患者存在慢性炎症并进一步探讨5-HT与腺瘤患者肠道炎症的关系。
材料与方法
一、患者来源
选取2009年3月~2010年1月北京大学人民医院经结肠镜和病理检查确诊的结肠腺瘤患者40例,并除外具有其他结肠急慢性炎性疾病以及其他部位活动性炎症者。其中男27例,女13例;年龄39~74 岁,平均(61.2±10.0)岁;进展期腺瘤 14 例,非进展期腺瘤26例。同时选取同期17例结肠镜检查无异常者作为对照,并且3个月内无急性腹泻史、其他部位无活动性炎症以及无糖尿病、结肠肿瘤家族史、体重指数小于25。其中男11例,女6 例;年龄 23~60 岁,平均(38.9±11.3)岁。所有研究对象均知情同意。
结肠腺瘤患者在结肠镜下取正常黏膜组织(至少距腺瘤5 cm以上),对照组分别取升结肠和降结肠正常黏膜组织。部分组织液氮-80℃保存待测;其余置于4%甲醛溶液固定,制备石蜡包埋标本。
二、主要试剂
即用型鼠抗人嗜铬素A(CgA)抗体、兔抗人CD3多克隆抗体、鼠兔通用型二抗试剂盒(基因有限公司);兔抗人5-HT多克隆抗体(北京中杉金桥生物技术有限公司);总RNA提取试剂盒[天根生化科技(北京)有限公司];逆转录酶(Invitrogen公司);实时定量SYBR®Green Realtime PCR Master Mix(TOYOBO 公司)。
三、研究方法
1.免疫组化法:石蜡切片置于新鲜配制的3%H2O2中,室温10 min,消除内源性过氧化物酶活性。CD3和CgA染色行抗原修复(pH值为9.0的1 mmol/L Tris-EDTA水浴加热修复20 min),5-HT染色无需抗原修复。滴加5%的胎牛血清室温孵育20 min。分别滴加即用型兔抗人CD3多克隆抗体、兔抗人5-HT多克隆抗体、鼠抗人CgA抗体,4℃过夜;滴加二抗室温孵育30 min。DAB显色,苏木精复染,中性树脂封片。以PBS代替一抗作为空白对照。
结果判断:参照Kim等[6]的方法,每张切片选取3个视野,高倍(×400)显微镜下选取100个结肠上皮细胞,计数上皮内淋巴细胞、固有层CD3+T细胞、5-HT阳性EC细胞和CgA阳性EC细胞,取均值。
2.实时荧光定量PCR:参照试剂盒说明书提取总RNA,逆转录为cDNA。各目的基因肿瘤坏死因子-α(TNF-α)、环氧合酶-2(COX-2)、诱生型一氧化氮合酶(iNOS)、色氨酸羟化酶 1(TpH1)PCR 引物由Invitrogen公司合成(见表1)。PCR反应体系为20μl,反应条件:94 ℃ 2 min;94 ℃ 20 s,61 ℃ 20 s,72℃30 s;共 35个循环。采用BIO-RAD公司实时定量PCR仪,Opticon Monitor 3软件分析所得数据,目的基因相对表达量的分析采用2-△CT法。

表1 PCR引物序列和扩增片段长度
四、统计学分析
结 果
一、结肠黏膜炎症指标
腺瘤组患者正常黏膜固有层CD3+T细胞计数较对照组显著增高(P<0.05),上皮内淋巴细胞计数与对照组相比无明显差异(P>0.05)(见表 2、图 1)。腺瘤组患者正常黏膜 TNF-α、COX-2、iNOS mRNA表达显著高于对照组(P<0.05)(见表2)。
二、结肠黏膜神经内分泌相关指标
结肠腺瘤患者正常黏膜5-HT阳性EC细胞计数、CgA阳性EC细胞计数以及TpH1 mRNA表达较对照组显著增高(P<0.05)(见图 1、表 3)。
三、炎症相关因子mRNA表达与TpH1 mRNA表达的相关性
结肠腺瘤患者正常黏膜 TNF-α、COX-2和iNOS mRNA表达均与TpH1 mRNA表达呈正相关(r=0.373,P=0.007;r=0.539,P<0.001;r=0.539,P<0.001)。
表2 腺瘤组和对照组结肠黏膜炎症相关指标比较( )

表2 腺瘤组和对照组结肠黏膜炎症相关指标比较( )
组 别 例数 上皮内淋巴细胞 固有层CD3+T细胞 TNF-α mRNA COX-2 mRNA iNOS mRNA腺瘤组 40 15.13±0.62 57.16±2.33 0.034±0.005 0.089±0.025 0.388±0.090对照组 17 13.56±0.69 40.39±2.15 0.016±0.002 0.028±0.007 0.179±0.031 P值 0.175 0.003 0.001 0.011 0.046
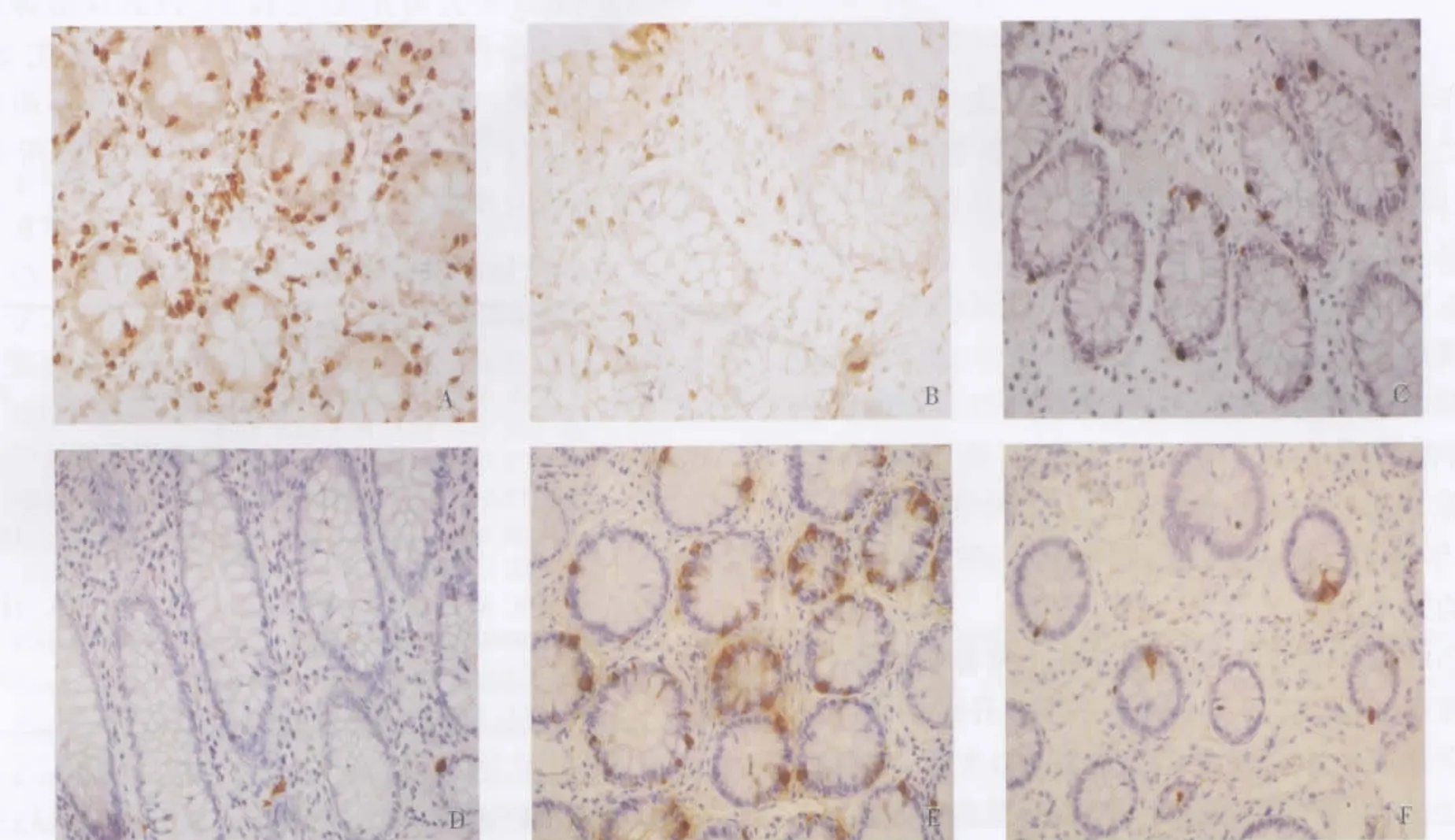
图1 腺瘤组和对照组免疫组化染色图(×400)
表3 腺瘤组和对照组结肠黏膜神经内分泌相关指标比较( )
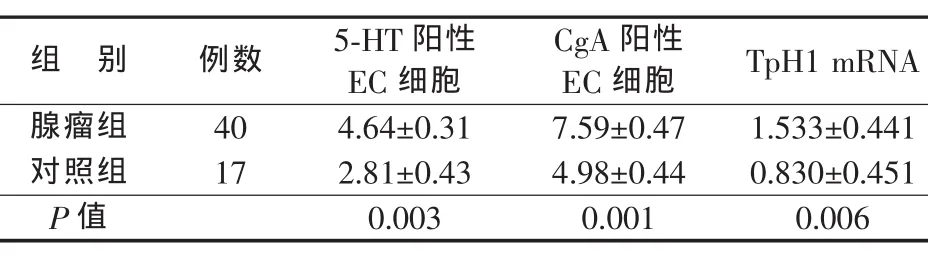
表3 腺瘤组和对照组结肠黏膜神经内分泌相关指标比较( )
组 别 例数 5-HT阳性EC细胞CgA阳性EC细胞 TpH1 mRNA腺瘤组 40 4.64±0.31 7.59±0.47 1.533±0.441对照组 17 2.81±0.43 4.98±0.44 0.830±0.451 P值 0.003 0.001 0.006
讨 论
19世纪,Virchow在肿瘤组织中发现白细胞,首次提出肿瘤可能起源于慢性炎症[7]。约25%的恶性肿瘤与慢性炎症和感染密切相关[8]。结肠肿瘤的发生和发展亦与炎症相关,Uronis等[9]的动物实验表明慢性结肠炎的严重程度与结直肠肿瘤的发生直接相关,且细菌导致的炎症促使腺瘤向腺癌发展。溃疡性结肠炎患者发病10年、20年、30年的结直肠癌发生率分别为2%、8%和18%;且结肠镜或组织学炎症程度越重,结直肠癌的发生风险越高[10]。多项研究[11,12]发现散发性结肠腺瘤患者正常黏膜存在慢性炎症,提示慢性炎症可能是结肠腺瘤的瘤前病变。本研究中,与对照组相比,结肠腺瘤患者正常结肠黏膜固有层CD3+T细胞明显增多,炎症相关因子 TNF-α、COX-2、iNOS mRNA 表达亦明显增高,说明结肠腺瘤患者正常黏膜存在慢性炎症。结肠肿瘤的发生是一个漫长的过程,高脂饮食、肥胖、年龄、感染、肠道菌群紊乱等是其危险因素,且可能与肠道慢性炎症相关,但需进一步研究证实。
肠道暴露于大量食物、微生物、毒物等外源性抗原中,肠道免疫系统、神经内分泌系统的共同调控使肠道处于动态稳态。当肠道黏膜稳态失衡时,即可导致慢性炎症。CgA为神经内分泌细胞公认的标记物[13]。分布于胃肠道的神经内分泌细胞根据其分泌激素的不同分为14种亚型,5-HT的EC细胞是胃肠道分布最广泛、数量最多的神经内分泌细胞[14]。5-HT与IBD、肠道感染、肠易激综合征以及结肠癌发生相关;5-HT可活化免疫细胞释放炎症介质,而CD4+T细胞分泌的产物可促进EC细胞产生5-HT;5-HT释放后,由5-HT再摄取转运体(SERT)转运至肠道上皮细胞之后被降解[5]。Haub等[15]研究表明SERT基因缺失导致5-HT再摄取减少后,小鼠结肠炎加重。TpH1是5-HT合成的限速酶,主要表达于EC细胞。Ghia等[16]的研究发现TpH1基因缺失导致肠道5-HT合成减少,可减轻DSS诱导的小鼠结肠炎,提示5-HT参与肠道炎症过程。Ataee等[17]表明5-HT激动剂促进结肠癌细胞株HT29增殖,而5-HT3和5-HT4受体拮抗剂抑制HT29细胞增殖,且5-HT3和5-HT4受体在结肠癌组织中表达增高。说明5-HT可能参与结肠肿瘤的发生、发展。Nocito等[18]的研究表明TpH1基因敲除小鼠结肠肿瘤生长缓慢。本研究中,腺瘤组患者正常黏膜5-HT阳性EC细胞和CgA阳性EC细胞较对照组增多,TpH1 mRNA表达增高,并与炎症相关因子mRNA表达呈正相关。说明结肠腺瘤患者正常黏膜EC细胞增多,5-HT合成增多,并与腺瘤患者结肠黏膜炎症相关。
Balkwill等[19]提出肿瘤发生的“达尔文微环境”,即肿瘤组织会选择最适合肿瘤发生和发展的炎症类型和程度。免疫细胞、细胞因子以及免疫介质在结肠肿瘤的发生、发展、转移过程中起重要作用[1]。本研究初步提示,结肠腺瘤患者正常黏膜存在炎症,其机制可能与肠道5-HT合成增加相关。说明5-HT作用环节可能作为结肠肿瘤诊断、预防、治疗新的靶点,但需行进一步更深入的研究证实。
2 Rhodes JM,Campbell BJ.Inflammation and colorectal cancer:IBD-associated and sporadic cancer compared.Trends Mol Med,2002,8(1):10-16.
3 Cappell MS.From colonic polyps to colon cancer:pathophysiology,clinicalpresentation,screening and colonoscopic therapy.Minerva GastroenterolDietol,2007,53(4):351-373.
4 Alberts DS,Einspahr JG,Krouse RS,et al.Karyometry of the colonic mucosa.Cancer Epidemiol Biomarkers Prev,2007,16(12):2704-2716.
5 Khan WI,Ghia JE.Gut hormones:emerging role in immune activation and inflammation.Clin Exp Immunol,2010,161(1):19-27.
6 Kim HS, Lim JH, Park H, et al. Increased immunoenterochromaffin cells in intestinal mucosa of postinfectious irritable bowel syndrome patients 3 years after acute Shigella infection--an observation in a small case control study.Yonsei Med J,2010,51(1):45-51.
7 Balkwill F,Mantovani A.Inflammation and cancer:back to Virchow?Lancet,2001,357(9255):539-545.
8 Hussain SP,Harris CC.Inflammation and cancer:an ancient link with novel potentials.Int J Cancer,2007,121(11):2373-2380.
9 Uronis JM,Mühlbauer M,Herfarth HH,et al.Modulation ofthe intestinalmicrobiota alters colitis-associated colorectal cancer susceptibility.PLoS One,2009,4(6):e6026.
10 Lukas M.Inflammatory bowel disease as a risk factor for colorectal cancer.Dig Dis,2010,28(4-5):619-624.
11 朱元民,李菁,刘玉兰.结直肠黏膜光镜下炎症表现及NF-κB、COX-2的表达与结直肠肿瘤发病的相关性研究.中国消化内镜,2007,1(11):34-39.
12 Roncucci L,Mora E,Mariani F,et al.Myeloperoxidasepositive cell infiltration in colorectal carcinogenesis as indicator of colorectal cancer risk.Cancer Epidemiol Biomarkers Prev,2008,17(9):2291-2297.
13 Rindi G,Leiter AB,Kopin AS,et al.The'normal'endocrine cell of the gut:changing concepts and new evidences.Ann N Y Acad Sci,2004,1014:1-12.
14 Lomax AE,Linden DR,Mawe GM,et al.Effects of gastrointestinal inflammation on enteroendocrine cells and enteric neural reflex circuits.Auton Neurosci,2006,126-127:250-257.
15 Haub S,Ritze Y,Bergheim I,et al.Enhancement of intestinal inflammation in mice lacking interleukin 10 by deletion of the serotonin reuptake transporter.Neurogastroenterol Motil,2010,22(7):826-834,e229.
16 Ghia JE,Li N,Wang H,et al.Serotonin has a key role in pathogenesis of experimental colitis.Gastroenterology,2009,137(5):1649-1660.
17 Ataee R,Ajdary S,Rezayat M,et al.Study of 5HT3and HT4receptor expression in HT29 cell line and human colon adenocarcinoma tissues.Arch Iran Med,2010,13(2):120-125.
18 Nocito A,Dahm F,Jochum W,et al.Serotonin regulates macrophage-mediated angiogenesis in a mouse model of colon cancer allografts.Cancer Res,2008,68(13):5152-5158.
19 Balkwill F,Charles KA,Mantovani A.Smoldering and polarized inflammation in the initiation and promotion of malignant disease.Cancer Cell,2005,7(3):211-217.

