瑞芬太尼对颅脑手术控制性降压期间肾素-血管紧张素系统的影响
张亦南 刘德行
遵义医学院附属医院麻醉科,贵州省遵义市 563003
控制性降压广泛应用于颅脑手术,瑞芬太尼虽为镇痛药物但具有降压作用,成为控制性降压新药的研究热点。但其对血流动力学及肾素-血管紧张素系统(renin-angiotensin-aldosteronesystem,RAAS)的影响尚无定论,本研究将其与常用降压药硝普钠对比,观察控制性降压过程中血流动力学的变化以及RAAS系统中重要产物的变化。
1 资料与方法
1.1 一般资料 30例择期颅脑手术患者,ASAⅠ~Ⅱ级,其中男 18例,女 12例,平均年龄(45.0±10.7)岁,体重(51.3±11.4)kg,其中脑动脉瘤 8例,脑胶质瘤12例,脑膜瘤10例。术前无内分泌、心、肺、肝、肾系统疾病,血压控制良好,术中取平卧位。随机分为瑞芬太尼组(R组,n=15),硝普钠组(N组,n=15)。
1.2 方法
1.2.1 麻醉与监测。所有患者不用术前药,入室后依次给予咪达唑仑0.1mg/kg,芬太尼4μ g/kg,丙泊酚2mg/kg,维库溴铵0.1mg/kg,进行静脉诱导,气管插管后吸入纯氧通气,接Datex-Ohmeda7900麻醉机,调整通气频率(10~12次/min),潮气量(7~8 ml/kg),使PetCO2维持在34~39mmHg(1mmHg=0.133kPa)。麻醉维持以丙泊酚3~5mg/(kg◦h),瑞芬太尼(批号:101107,湖北宜昌人富药业有限公司)起始剂量为0.1μ g/(kg◦min),术中根据需要间断应用维库溴铵2~4mg/次,输液量按15ml/(kg◦h),输入生理盐水和6%羟乙基淀粉,术中监测Hct<24%时给予红细胞输注。所有患者均行左桡动脉和右侧锁骨下静脉穿刺置管,用 Mindray Beneview T5监护仪连续监测ECG、PetCO2、SpO2、HR、MAP和CVP。
1.2.2 控制性降压。术中在打开硬脑膜后开始控制性降压,两组丙泊酚用法不变,R组加大瑞芬太尼输注量,N组维持丙泊酚和瑞芬太尼的输注量,加用硝普钠3~8μ g/(kg◦min)维持输注,两组均控制MAP下降30%左右,并保持MAP≥55mmHg。
1.3 观察指标 分别于手术前,达到目标血压5min(T0)、10min(T1)、30min(T2)和停止降压后5min(T3)、10min(T4)、30min(T5)记录 HR 和MAP。并于术前、T1、T5抽取静脉血,用放免法测定血清肾素(PRA)、血管紧张素-Ⅱ(A-Ⅱ)、醛固酮(ALD)浓度(试剂由上海江莱生物科技有限公司提供),记录术中输液量、输血量及尿量。
1.4 统计分析 采用SPSS16.0统计软件进行分析,所有计量资料以均数±标准差()表示,组内采用单因素方差分析,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 控制性降压后RAAS系统激素的变化 与降压前比较,N组的PRA、A-Ⅱ、ALD在 T2和 T5时点均升高(P<0.05),R组仅ALD在T2和T5时点升高(P<0.05);与N组相比较,R组的PRA、A-Ⅱ、ALD在 T2和 T5时点均降低(P<0.05)。见表1。
2.2 控制性降压后血流动力学指标变化 与降压前比较,R组和N组的MAP在T0~T2时段均下降(P<0.05);R组的H R在T0~T3时段均下降(P<0.05),而N组的HR在T0~T4时段均上升(P<0.05);与N组相比较,R组的HR在T0~T3时段均下降(P<0.05)。与降压前和N组相比较,R组的RPP在T0~T3时段均下降(P<0.05)。见表2。
表1 控制性降压后 PRA、A-Ⅱ、ALD的变化()
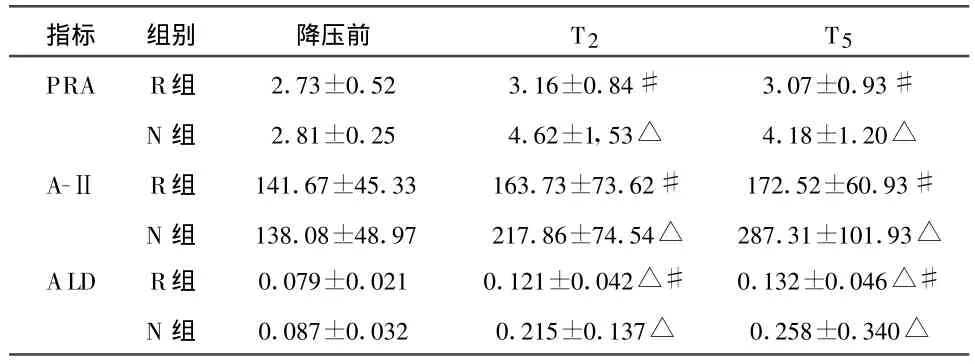
表1 控制性降压后 PRA、A-Ⅱ、ALD的变化()
注:与降压前比,△P<0.05;与N组相比#P<0.05。
指标 组别 降压前 T2 T5 PRA R组 2.73±0.52 3.16±0.84# 3.07±0.93#N 组 2.81±0.25 4.62±1,53△ 4.18±1.20△A-Ⅱ R组 141.67±45.33 163.73±73.62# 172.52±60.93#N 组 138.08±48.97 217.86±74.54△ 287.31±101.93△ALD R组 0.079±0.021 0.121±0.042△# 0.132±0.046△#N 组 0.087±0.032 0.215±0.137△ 0.258±0.340△
表2 控制性降压后血流动力学指标变化()
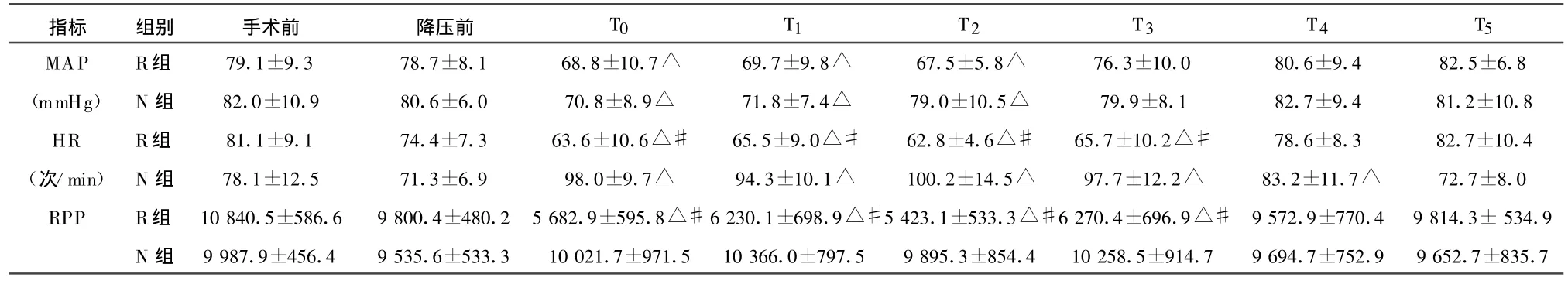
表2 控制性降压后血流动力学指标变化()
注:与降压前比,△P<0.05;与N组相比#P<0.05。
指标 组别 手术前 降压前 T0 T1 T2 T3 T4 T5 MAP R组 79.1±9.3 78.7±8.1 68.8±10.7△ 69.7±9.8△ 67.5±5.8△ 76.3±10.0 80.6±9.4 82.5±6.8(mmHg) N 组 82.0±10.9 80.6±6.0 70.8±8.9△ 71.8±7.4△ 79.0±10.5△ 79.9±8.1 82.7±9.4 81.2±10.8 HR R组 81.1±9.1 74.4±7.3 63.6±10.6△# 65.5±9.0△# 62.8±4.6△# 65.7±10.2△# 78.6±8.3 82.7±10.4(次/min) N 组 78.1±12.5 71.3±6.9 98.0±9.7△ 94.3±10.1△ 100.2±14.5△ 97.7±12.2△ 83.2±11.7△ 72.7±8.0 RPP R组 10 840.5±586.6 9 800.4±480.2 5 682.9±595.8△#6 230.1±698.9△#5 423.1±533.3△#6 270.4±696.9△# 9 572.9±770.4 9 814.3±534.9 N 组 9 987.9±456.4 9 535.6±533.3 10 021.7±971.5 10 366.0±797.5 9 895.3±854.4 10 258.5±914.7 9 694.7±752.9 9 652.7±835.7
3 讨论
为了尽可能减少出血、改善术野环境、降低动脉瘤破裂等并发症的发生率,控制性降压已被广泛应用于神经外科手术中。其中术前创伤、情绪紧张以及麻醉和手术本身的刺激则可促使机体发生强烈的应激反应[1],激活体内交感-肾上腺髓质系统、下丘脑以及RAAS系统,相互作用调控多个器官[2,3],这一过程将导致心率、血压等循环系统参数剧烈波动,诱发心、脑、肾等重要脏器发生意外事件。因此平稳降压、减少刺激、抑制应激反应则成为控制性降压重要的关注点。
瑞芬太尼为一起效快、恢复迅速、可控性强的新型超短效μ受体激动剂,因其镇痛作用强,能有效抑制麻醉与手术引起的应激反应[4~6],成为减少手术应激反应的研究热点。在手术应激状态下肾素(PRA)分泌强增加,激活 RAAS系统,促使血管紧张素-Ⅱ(A-Ⅱ)和醛固酮(ALD)分泌增加,二者相互作用,A-Ⅱ是ALD强有力的刺激剂,而ALD又可增加A-Ⅱ与其受体的亲和力,并提高A-Ⅱ的生理效应[7]。而A-Ⅱ又作用于交感神经末梢血管紧张素受体,使其释放大量去甲肾上腺素(NE)[3],产生缩血管效应,促使交感兴奋、全身微动脉收缩、心率血压升高。本研究将瑞芬太尼用于控制性降压,结果显示与降压前相比较,N组的PRA、A-Ⅱ和ALD均有所升高,而R组的各值除ALD外无明显改变,组间相比较R组较N组各值均明显降低。提示瑞芬太尼在降压的同时又可降低RAAS激活后释放主要产物,这与瑞芬太尼具有抑制中枢神经系统和自主神经的作用[8],减少体内儿茶酚胺类物质释放相关;同时它具有的高效镇痛作用,又从抑制疼痛角度减轻了机体的应激反应。
RAAS系统激活后释放的产物中对循环系统影响最大的是A-Ⅱ,它可直接刺激血管平滑肌收缩,增加外周阻力,其升压作用较肾上腺素强40倍。从实验的血流动力学结果分析来看,瑞芬太尼和硝普钠均可在一定时间内使血压降至所需水平,对抗由A-Ⅱ分泌增多导致的血压升高,但硝普钠的降压机理只是单纯扩张外周血管,没有对应激反应的抑制作用,因此N组在降压的过程中,出现反射性心率增快、PRR升高。PRR是反映心肌氧耗的重要指标,其数值增大则表明心肌耗氧量增加,致使心血管意外发生率增高,对于合并有心血管疾病的患者而言较为不利。
实验结果还显示,N组患者在停用硝普钠后血压未发生反弹,这与既往应用硝普钠进行降压后会导致血压反弹、升高的研究结果不同,考虑可能与术中两组患者均应用丙泊酚和瑞芬太尼维持麻醉有关,有研究表明,二者配合在药效学以及在消除伤害性刺激方面有协同作用[9]。
综上所述,瑞芬太尼用于神经外科手术进行控制性降压效果确定,并能有效降低应激反应,对由此激活的RAAS系统也有一定抑制作用。能够在术中保证平稳降压,减少神经-内分泌系统的变化。但对于瑞芬太尼作为控制性降压的剂量与给药方法还需进一步研究,以达到更合理的使用。
[1] Ramsay M,Tom F.Recent advances:psychiatry〔J〕.BWJ,1995,311:167.
[2] DiBona GF.Nervous kidney:interaction between renal sympathetic nerves and the renin-angiotensin system in the control of renal function〔J〕.Hypertension,2000,36(16):1083-1088.
[3] Paul M,Poyan Mehr A,Kreutz R.Physiology of local renin-angiotensin systems〔J〕.Physiol Rev,2006,86(3):747-803.
[4] Davis PJ,Cladis FP.T he use of ultra-short-acting opioids in paediatric anaesthesia:the role of remifentanil〔 J〕.Clin Pharmacokinet,2005,44(8):787-796.
[5] Inomata S.Clinical usefulness of remifentanil〔J〕.Masui,2007,56(11):1296-1305.
[6] Steinlechner B,Dworschak M,Birkenberg B,et al.Low-dose remifentanil to suppress haemodynamic responses to noxious stimuli in cardiac surgery:a dose-finding study〔J〕.Br J Anaesth,2007,98(5):598-603.
[7] Casey ML,MacDonald PC.Extraadrenal formation of a mineralocorticosteroid:deoxycor-ticosterone and deoxycorticosterone sulfate biosy nthesis and metabolism〔J〕.Endocr Rev,1982,3:396-403.
[8] Degoute CS,Ray MJ,M anchon M,et al.Remifentanil and controlled hypotension:comparison with nitroprusside o r esmolol during tympanoplasty〔J〕.Can J Anaesth,2001,48(1):20.
[9] Mertens MJ,Olofsen E,Engbers FH,et al.Propofol reduces perioperative remifentanil requirements in a synergistic manner:response surface modeling of perioperative remifentanilpropofol interactions〔J〕.Anesthesiology,2003,99(2):347.

