TBT对青春期雌性SD大鼠卵巢结构及内分泌的影响
熊万军 苏小霞
重庆三峡医药高等专科学校,重庆市万州区 404020
三丁基锡(tributyltin)是有机锡类化合物的一种,为一种具有类似于雄激素的内分泌干扰物[1]。三丁基锡主要是作为木材防腐剂、聚氯乙烯塑料制品的热稳定剂、工业用冷凝水的灭菌剂和作为杀虫剂添加到涂料中涂于船体表面[2]。由于工业生产中的广泛应用,从各种工业废水及涂料中释放入水体的TBT则会对环境造成严重污染。不仅毒害水生生物破坏生态环境,而且不可忽视的是它们可在食用水生生物机体内富集,被人食用后对人体造成危害[3]。自从发现有机锡化合物对海洋的污染以来,有机锡被认为是迄今为止由人为因素而导致大量进入海洋环境中的毒性最大的化学品之一。有研究表明,三丁基锡可使海洋动物性成熟和繁殖推迟,贝类和腹足纲动物性畸变[4];对人的肾、肝、胆、呼吸系统、肠胃系统、生殖系统、神经系统、免疫系统均有不同程度的毒性作用[5],并具有很强的细胞毒性,其中对细胞凋亡的干扰,作为十分重要和典型的细胞毒性的体现,已成为一个研究热点。目前三丁基锡类的相关研究主要集中在其对海洋生物的生殖发育影响,对哺乳动物尤其是对青春期哺乳动物的影响研究涉及很少。本研究选择氯化三丁基锡(tributyltin chloride,TBT)为研究对象,通过体内实验探索TBT对青春期雌性SD大鼠卵巢及内分泌的影响机制。
1 材料与方法
1.1 实验动物 健康21日龄雌SD大鼠60只,体重40~50g。
1.2 主要试剂、仪器 TBT纯度≥98%(南通虹鼎国际化工公司);睾酮(T)放射免疫测定试剂盒(天津市协和医药科技有限公司);雌二醇(E2)放射免疫测定试剂盒,DAB试剂盒(北京中杉金桥生物有限公司),SP-9000免疫组化染色试剂盒(美国ZYMED公司);食用玉米油(四川嘉里粮油工业有限公司);SN-695A型放射免疫分析仪(上海日环技术开发公司产品),石蜡切片机为德国Leica公司的产品,电子天平为上海精天电子仪器有限公司的产品。
1.3 动物分组及染毒方法 21日龄雌性SD大鼠60只,经2d适应性饲养后,将大鼠随机分为溶剂对照组、0.5mg/kg染毒组、2.5mg/kg染毒组、5.0mg/kg染毒组、7.5mg/kg染毒组和 10.0mg/kg染毒组。每组有大鼠10只,各组都与玉米油配成相应的溶液,按0.4%体重灌胃,对照组用同样体积的玉米油灌胃。每天均在上午9:00~10:00进行灌胃,染毒期为30d。实验过程中各组大鼠均饲以普通饲料,自由饮水,每天称重1次。
1.4 样本的处理及指标的观察
1.4.1 激素的测定:在染毒30d结束后第2天准备采集标本,先称量每只大鼠的体重,在麻醉状态下进行眼眶动脉采血,将血样放入37℃水浴箱中水浴30min,然后以2 500r/min离心10min后,取上层血清放入-20℃冰柜中待用。应用放射免疫法测定大鼠血清T、E2的浓度。
1.4.2 卵巢组织的采集:将采血的大鼠断头处死,取出卵巢,用电子天平称重后,将卵巢用生理盐水清洗后,经4%多聚甲醛固定,常规脱水、石蜡包埋,切片,作HE染色观察组织结构改变。
2 结果
2.1 卵巢脏器系数的测定 染毒30d后,各剂量组与对照组的脏器系数变化见表1,不同剂量组卵巢脏器系数的变化规律见图1。
表1 不同剂量组卵巢脏器系数的变化( ±s)

表1 不同剂量组卵巢脏器系数的变化( ±s)
注:*与对照组相比,P<0.05;#与0.5mg/kg、2.5mg/kg组相比,P<0.05。
不同剂量组对照组 0.5mg/kg 2.5mg/kg* 5.0mg/kg 7.5mg/kg# 10.0mg/kg卵巢脏器系数 0.022±0.001 0.023±0.002 0.028±0.002 0.032±0.003 0.042±0.001 0.034±0.001

图1 不同剂量组脏器系数的变化
由此可见,随着TBT染毒剂量的增加,卵巢脏器系数有逐渐增加的趋势(图 1),7.5mg/kg、10.0mg/kg卵巢脏器系数明显高于对照组和0.5mg/kg、2.5mg/kg组(P <0.05),在 10.0mg/kg组剂量组中卵巢脏器系数却又出现回落现象。
2.2 血清激素的测定 染毒30d后,各剂量组和对照组血清T、E2的浓度变化见表2,不同剂量组T、E2的变化规律见图2、图3。
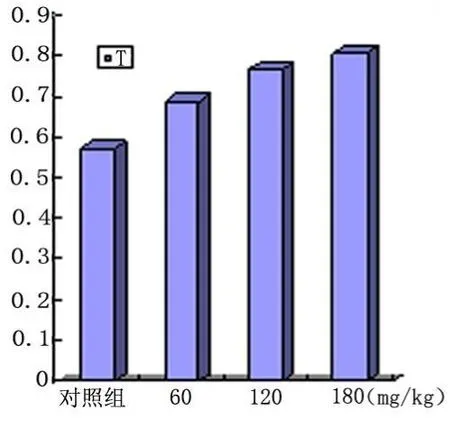
图2 不同剂量组T浓度变化
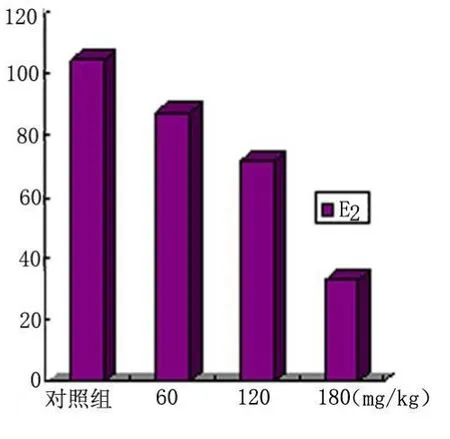
图3 不同剂量组E2 浓度变化
表2 不同剂量组的血清T和E2浓度比较()

表2 不同剂量组的血清T和E2浓度比较()
注:*与对照组相比,P<0.05;#与0.5mg/kg组相比P<0.05。
项目不同剂量组对照组 0.5mg/kg 2.5 mg/kg 5.0mg/kg 7.5 mg/kg 10mg/kg T(pmol/L) 13.811±1.206 9.897±0.859* 8.248±0.485* 7.326±0.285 6.246±0.751 5.701±1.101*E2(mu/ml) 0.575±0.081 0.439±0.063* 0.310±0.071 0.270±0.235 0.118±0.021* 0.052±0.014#
以上分析显示,随着 TBT染毒剂量的增加,血清T的浓度逐渐增高,7.5mg/kg、10.0mg/kg组血清T的浓度高于对照组和0.5mg/kg、2.5mg/kg组(P<0.05),而血清E2的浓度随着染毒剂量的增加而降低,7.5mg/kg、10.0mg/kg组低于对照组和0.5mg/kg、2.5mg/kg组(P<0.05)。T的浓度与TBT剂量呈正相关(r=0.873,P<0.05),E2的浓度与TBT的剂量成负相关(r=0.902,P<0.05),且具有统计学意义(P<0.05)。
2.3 卵巢组织学改变 对照组大鼠卵巢可见多个不同发育时期的卵泡,原始卵泡、生长卵泡及成熟卵泡的数量及形态正常,颗粒细胞多层,排列整齐,染色质致密,卵泡膜细胞1~2层(图 4)。0.5mg/kg、2.5mg/kg组开始出现闭锁卵泡增多,生长卵泡的数量减少,卵泡内颗粒细胞层减少,排列疏松,卵泡膜-间质细胞增生。5.0mg/kg组上述情况加重,黄体增生,细胞排列呈条状,部分血管破裂(图 5)。7.5mg/kg、10.0mg/kg组中,黄体增生更明显,部分黄体细胞出现空泡样变化,卵泡数量减少明显,卵母细胞消失,卵泡膜细胞明显增生(图6、7)。
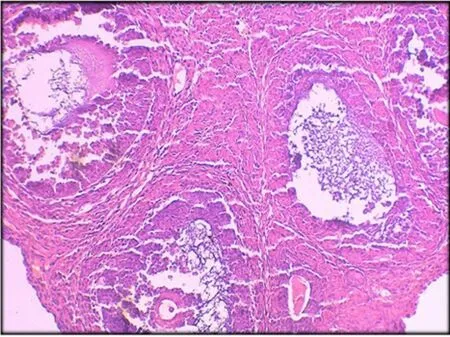
图4 正常卵巢组织HE×200
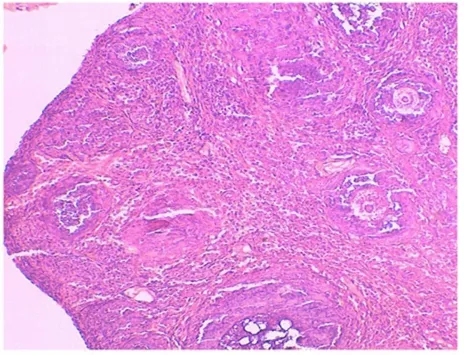
图5 染毒剂量5.0mg/kg 组,卵巢组织 HE×200
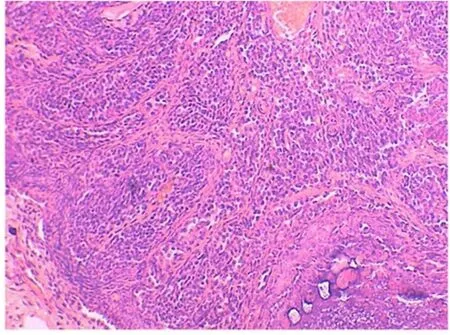
图6 染毒剂量7.5mg/kg 组,卵巢组织 HE×200

图7 染毒剂量10mg/kg组, 卵巢组织 HE×200
3 讨论
卵巢中激素合成中氧化、羟化和脱氢酶活动过程都在细胞浆的粗内质网进行。卵巢组织一般直接吸取血液中的胆固醇作为合成性激素的基质。本实验显示TBT实验组血清睾酮的浓度随着染毒剂量的增加而增加,而血清雌二醇的浓度随染毒剂量的增加而减少,均呈现出明显的剂量效应关系,而HE染色显示随着染毒剂量的增加,卵巢功能结构改变比较明显,闭锁卵泡增多,卵泡的颗粒层减少,黄体出现空泡样改变。按照常规,因为卵泡数量的减少,结构功能的严重破坏,黄体的功能结构的破坏,血清睾酮的改变应该与雌二醇的改变是同行的,但结构显示确呈相反样的改变,这说明了TBT抑制 T转化为雌酮及雌二醇的功能,并且随着染毒剂量的增大,这种抑制进一步加重。Ema等[6]研究显示有机锡化合物抑制猪睾丸中睾酮合成过程中17β-HSD酶的活性。TBT使睾酮分解代谢过程的酶,如5α还原酶,P450芳香化酶的活性减弱[7]。另外,体外培养实验证实,睾酮诱导或促进卵泡颗粒细胞凋亡,雌二醇则反之[8]。由此可以推测血清睾酮与雌二醇的改变趋势可能是由于 TBT干扰了这些关键酶的代谢所致。
本研究显示,随着染毒剂量的增加,卵巢脏器系数存在增加的趋势,7.5mg/kg组的脏器系数明显高于对照组。脏器系数可直接反映脏器是否有增生、充血、水肿或萎缩。实验组脏器系数的增加可能是TBT作用使卵巢的增生或者是水肿所致,在10.0mg/kg剂量组中,脏器系数出现回落趋势,可是是因为发生萎缩变性所致。膜细胞合成的雄激素透过基膜进入颗粒细胞,在芳香化酶系的作用下雄激素转变为雌激素。当芳香化酶的活性降低时,雄激素的转化受到影响,含有雄激素的类固醇不能顺利排出,从而影响到卵母细胞发育的微环境,导致了卵细胞凋亡,卵巢功能的降低,重量的减轻。
综上所述,TBT能够导致大鼠卵巢的分泌和生殖功能的障碍,且存在着明显的剂量效应关系。影响的机制可能是TBT首先抑制了芳香化酶的活性,使卵巢分泌的雄激素不能转化为雌激素,从而使雄激素的浓度过高,雌激素的浓度过低,干扰了大鼠的内分泌功能,导致了卵泡的发育障碍,促进了卵泡的凋亡,从而影响了卵巢的形态和功能。
[1] Huggett RJ,Unger M A,Seligman PF.The marine biocide tributyltin:assessing and managing the environmental risks〔J〕.Environ Sci Technol,1992,26(2):232-237.
[2] Roach H,King B,King K.T he Effects of T ributy ltin on the Marine Environment〔C〕.2004.Alaska Ocean Science Bowl High school competition.
[3] Chau YK,Maguire RJ,Brown M,et al.Occurrence of organotincompounds in Canadian aquatic environment five years after the regulation of antifouling uses of tributy ltin〔J〕.Water Qual Res J Canda,1997,32(3):453-521.
[4] 江桂斌,刘稷燕,周群芳,等.我国部分内陆水域有机锡污染现状初探〔J〕.环境科学学报,2000,20(5):636-638.
[5] U.S.Environmental Protection Agency.Office of Pesticide Programs〔J〕.T ributyltin suppo rt document,1985.
[6] Ema M,Harazono A,et al.Effect of the day of administration on the developmental toxicity of tributyrhin chlo ride in rats〔J〕.A rch Enviion Contam T oxicol,1997,33:90-96.
[7] Ohhim S,Watanabe M,Matsui H.Metabolism of tributyltin an tripheny ltin by rat,hamster and human hepatic microsomes〔J〕.A rch Toxicol,2003,77:138-144.
[8] Yam anoshita O,Kurasaki M,Saito T,et al.Diverse effect of tributy ltin on apoptosis in PC12 cells〔J〕.Biochem Biophy s Res Commun,2000,272:557-562.

