黄芪多糖对TNF-α诱导心脏微血管内皮细胞黏附分子基因转录及p38MAPK信号通路的影响
刘 蓓 朱海燕 高永红 徐 冰 朱陵群 陈立新
(1北京中医药大学东直门医院中医内科学教育部重点实验室,北京市东城区海运仓5号,100700;2北京师范大学中药资源与资源药物研究所;3北京中医药大学)
机体在正常情况下,中性粒细胞与血管内皮细胞几乎不产生黏附作用,在前炎症因子刺激后,两者黏附增加,从而对血管内皮造成严重伤害。黄芪多糖是中药黄芪的主要活性物质,前期研究发现,黄芪多糖具有良好的免疫调节作用,并且对心肌缺血再灌注损伤引发的炎症级联反应具有一定的抑制作用[1]。本研究从基因转录水平观察黄芪多糖干预TNF-α诱导的HCEMC中P-选择素、E-选择素转录的影响,同时观察p38MAPK信号通路的变化,进一步探讨黄芪多糖干预内皮细胞炎症黏附作用的可能机制。
1 材料和方法
1.1 材料
1.1.1 细胞 原代人心脏微血管内皮细胞(Scien-Cell),从人心肌组织中分离后立即冻存,用抗Ⅷ因子、抗CD31(P-CAM)抗体(免疫荧光法)和DiI-Ac-LDL摄取检测,均符合内皮细胞特性。
1.1.2 主要药品及试剂 黄芪多糖(天津赛诺制药有限公司,批号:Z20040086)、多聚赖氨酸(Sigma)、95%乙醇(北京试剂公司);内皮细胞培养基(Scien-Cell);0.01mol/L磷酸盐缓冲液(pH7.2~7.4)、虎红(Solarbio);TNF- α(10μg,Peprotech)、SV Total RNA分离纯化试剂盒、反转录试剂盒(Promega)、PCR Master Mix(ABI)。
1.1.3 主要仪器 CO2恒温细胞培养箱(Sanyo);Mx3000P荧光定量PCR仪(Stratagene);倒置相差显微镜(Olympus IMT-2);超净工作台(CJT-E-11北京昌平长城空气净化工程公司);电热恒温水箱(HH.W21.420)。
1.2 实验方法
1.2.1 人心脏微血管内皮细胞的培养 将细胞冻存管从液氮中取出立即于37℃恒温水浴箱中融化,注入预先用20mg/L多聚赖氨酸包被的75cm培养瓶中,使用内皮细胞培养基进行培养,放置于37℃、5%的CO2培养箱中,2~3天传代1次,实验使用第5代细胞。
1.2.2 实验分组及给药方法 观察细胞培养至80%融合,每组给予相应药物,继续培养24h。实验分组:1)正常对照组:细胞不加任何干预;2)TNF-α组:加入终浓度为10μg/L的TNF-α;3)APS低剂量组:APS(25μg/mL)预孵育1h,加入终浓度为10μg/L的TNF-α;4)APS高剂量组:APS(100μg/mL)预孵育1h,加入终浓度为 10μg/L的 TNF-α;5)SB203580组:SB203580(10μg/L)预孵育1h后吸弃液体,加入终浓度为10μg/L的TNF-α。
1.2.3 总RNA提取 细胞总RNA提取严格按照SV Total RNA分离纯化试剂盒操作步骤进行。提取的总RNA用核酸蛋白分析仪测 OD260、OD280,计算总RNA纯度,OD260/OD280比值在1.7~2.0之间。
1.2.4 实时荧光定量PCR检测
1.2.4.1 逆转录反应 按照反转录试剂盒操作说明配制反转录体系:MgCl24μL,10×反转录 buffer 2μL,RNase Inhibitor 0.5μL,0ligdT-Adaptor Primer 1μL,dNTP Mixture 2μL,AMV Reverse Transcriptase 0.6μL。RNA 模板9.9μL(含1μg),总体积:20μL。反应条件:42℃ 30min,然后95℃ 5min。合成的cDNA以无RNA酶水稀释5倍,置-20℃备用。
1.2.4.2 实时荧光定量PCR NCBI查人P-选择素、E-选择素、p38MAPK、β-actin引物序列,以设计软件Premier5.0自动设计,β-actin为内参。引物合成由北京奥科鼎盛生物科技有限公司完成。P-选择素:Forward 5'-TTC AGGACA ATGGACAGCAGT-3',Reverse 5'-GTC CCA CCC ATT ATC AGA CCT-3 ',扩增片段长度306bp;E-选择素:Forward 5'-GCA CAT CTC AGG GAC AAT GGA-3 ',Reverse5 '-TTG GAC TCA GTG GGA GCT TCA-3 ',扩 增 片 段 长 度238bp;p38MAPK:Forward 5'-GCC GAA GAT GAA CTT TGC GA-3 ',Reverse5 '-GTG GTG GCA CAA AGC TGA TG-3',扩增片段长度 260bp;β -actin:Forward5 '-TCC TCC CTG GAG AAG AGC TA-3 ',Reverse 5'-TCA GGA GGA GCA ATG ATC TTG-3',扩增片段长度302bp。
反应体系:PCR master mix 12.5μL,上游引物1μL(10μmol/L),下游引物 1μL(10umol/L),cDNA5μL,RNAse Free Water 5.5μL,总体积:25μL。实时定量PCR仪反应条件:95℃10min预变性,95℃变性30s,55℃退火30s,72℃延伸30s,40次循环。反应结束后确认Real Time PCR的扩增曲线与融解曲线。根据计算机生成CT值,应用2-△△CT法求出初始cDNA的相对量。
1.2.5 统计学方法计量资料采用¯x±s表示,各组之间比较采用单因素方差分析。
2 结果
结果显示,与正常对照组比较,TNF-α组P-选择素、E-选择素、p38MAPK基因表达明显增加(P<0.01);与 TNF-α组比较,黄芪多糖各剂量组、SB203580组P-选择素、E-选择素、p38MAPK基因表达均显著降低(P<0.01)。(见表1)
3 讨论
TNF-α是由巨噬细胞产生的一种细胞炎性因子,能够促发炎症反应,并加重心肌缺血再灌注损伤。冠心病不稳定心绞痛和心肌梗死患者血清中TNF-α的浓度都有明显升高[2-3]。研究认为,炎症组织释放TNF-α激活血管内皮细胞,随后发生的基因表达被认为是心肌缺血再灌注损伤的关键环节[4-5]。多项研究发现细胞黏附分子中的选择素家族与心肌缺血再灌注损伤关系密切,通过降低血管内皮细胞黏附分子的表达,干预细胞的黏附能力,能够对缺血心肌起到保护作用。
黄芪性甘温,归脾、肺二经,具有补气升阳,益气固表,利水消肿,托疮生肌等功效。现代研究发现,黄芪能够通过抑制NO生成、激活抗氧化酶和抑制心肌细胞凋亡,以及抑制某些炎症因子的生成等作用,保护缺血心肌再灌注损伤[6]。中性粒细胞与血管内皮细胞黏附分子发生的相互作用与心肌缺血再灌注损伤有紧密联系[7-8]。机体在心肌缺血再灌注和炎症反应的条件下,中性粒细胞与血管内皮细胞黏附增加,继而损伤血管内皮。本实验运用TNF-α刺激心脏微血管内皮细胞,并观察其中黏附分子的基因转录变化与黄芪多糖的关系。实验结果显示黄芪多糖能够降低炎症因子TNF-α刺激作用下心脏微血管内皮细胞P-选择素、E-选择素的基因转录,提示黄芪多糖有可能部分阻断细胞黏附分子的表达,从而对心脏缺血再灌注起保护作用。
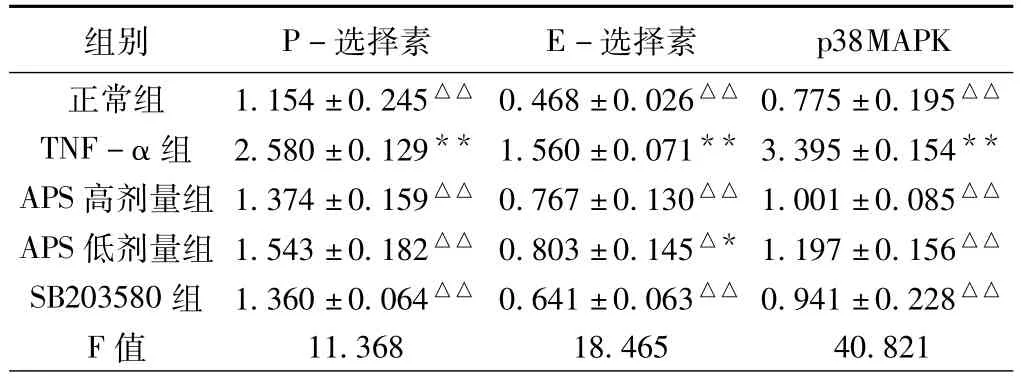
表1 黄芪多糖对TNF-α介导人心脏微血管内皮细胞P-选择素、E-选择素及p38MAPK mRNA表达的影响(¯x±s,n=9)
我们前期的研究中已发现,黄芪多糖能够减少人微血管内皮细胞缺血再损伤模型核因子-κB(NF-κB)的基因表达,进而抑制再灌注损伤中部分黏附分子的表达[9]。而p38MAPK是机体内另一条重要的炎症信号通路,参与了机体的多种炎症反应,与心、脑、肾的缺血再灌注损伤有密切关系[10-11],并且与NF-κB信号通路存在复杂的交叉对话关系[12]。Shimizu等[13]对心肌梗死大鼠模型的研究发现,心肌缺血能够激活p38MAPK通路,继而伴随的是NF-κB基因的表达增加,认为p38MAPK与NF-κB信号转导机制与心肌缺血密切相关,阻断p38MAPK信号通路能够明显减轻心肌缺血再灌注损伤[14-15]。通过本研究我们发现,黄芪多糖和p38MAPK抑制剂SB203580能够明显改善由TNF-α诱导的人微血管内皮细胞损伤,并能减少在前炎症因子TNF-α刺激作用下人微血管内皮细胞p38MAPK基因表达。结合既往研究结果我们推测,黄芪多糖除了能抑制NF-κB信号通路,还能干预p38MAPK信号通路,从而通过多条途径抑制炎症反应,发挥抗心肌再灌注损伤的作用。鉴于信号通路的复杂性,黄芪多糖的具体干预位点还不明确,这一结果有可能是黄芪多糖通过抑制p38MAPK信号通路,直接下调黏附分子的表达;也可能是影响NF-κB通路后,间接下调黏附分子;或者两种可能同时存在。具体机制有待更进一步深入研究,同时需要从蛋白表达方面进行验证。
[1]张灼,陈立新,宋崇顺,等.黄芪多糖对大鼠心肌缺血-再灌注损伤后的保护作用.中国中医药信息杂志,2007,14(2):33-34.
[2]杨平,抗永伦,温先勇,等.冠心病患者炎症标志物检测的临床意义.医学理论与实践,2007,20(1):9-12.
[3]Mizia-Stec K,Gasior Z,Zahorska-Markiewicz B,et al.Serum tumour necrosis factor-alpha,interleukin-2 and interleukin-10 activation in stable angina and acute coronary syndromes.Coron Artery Dis,2003,14(6):431-438.
[4]Michael Buerke,Diethard Pruefer,Dennis Sankat,et al.Effects of Aprotinin on Gene Expression and Protein Synthesis After Ischemia and Reperfusion in Rats.Circulation,2007,116:I 121-126.
[5]Jones SP,Trocha SD,Stranqe MB,et al.Leukocyte and endothelial cell adhesion molecules in a chronic murine model of myocardial reperfusion injury.Am J Physiol Heart Circ Physiol,2000,279(5):H2196-2201.
[6]刘静,郭颖.黄芪注射液对大鼠心肌缺血再灌注损伤保护作用.锦州医学院学报,2006,27(3):34-36.
[7]A.Ramachandran,S.Jha,D.J.Lefer,et al.Pathophysiology of Myocardial Reperfusion Injury:The Role of Genetically Engineered Mouse Models.Veterinary Pathology,2008,45(5):698-706.
[8]Jeong Ryul Lee,Jae Jin Han,Jeong Wook Seo,et al.Correlation between ICAM-1 and functional recovery of piglet myocardium with leukocyte-depleted reperfusion.Surg,2000,70:1531-1535.
[9]朱海燕,陈立新,朱陵群.黄芪多糖对缺氧再复氧后人心脏微血管内皮细胞ICAM-1、VCAM-1表达的影响.辽宁中医杂志,2008,35(2):293-295.
[10]孙立倩,景晓彬,崔建忠.SB203580对IR鼠模型脑组织中神经元凋亡的影响.山东医药,2009,49(2):34-36.
[11]Moolman JA,Hartley S,Van Wyk J,et al.Inhibition of myocardial apoptosis by ischemic and beta-adrenergic preconditioning is dependent on p38MAPK.Cardiovasc Drug Ther,2006,20(1):13-25.
[12]Li J,Lang MJ,Mao XB,et al.Antiapoptosis and mitochondrial effect of pioglitazone preconditioning in the ischemic/reperfused heart of rat.Cardiovasc Drugs Ther,2008,22(4):283-291.
[13]Shimizu N,Yoshiyama M,Omura T.Activation of mitogen-activated protein kinases and activator protein-1 in myocardial infarction in rats.Cardiovasc Res,1998 ,38(1):116-124.
[14]Gorog DA,Jabr RI,Tanno M,et al.MAPK-2 modulates p38MAPK localization and small heat shock protein phosphorylation but does not mediate the injury associated with p38MAPK activation during myocardial ischemia.Cell Stress Chaperones,2009,14(5):477-489.
[15]Lochner A,Marais E,Genade S,et al.Protection of the ischemic heart:investi-gations into the phenomenon of ischemic precondition.Cardiovasc JAfr,2009,20(1):43-51.

