抗HIV-1 P24单克隆抗体纯化方法的研究
王从印,张红中,史希媛,苏彦辉,王惠芬
(河北医科大学生物医学工程中心生物室,河北石家庄 050017)
抗HIV-1 P24单克隆抗体纯化方法的研究
王从印,张红中,史希媛,苏彦辉,王惠芬
(河北医科大学生物医学工程中心生物室,河北石家庄 050017)
目的建立从小鼠腹水中纯化抗人重组HIV-1 P24单克隆抗体的方法。方法含抗P24单克隆抗体的腹水经离心、过滤及缓冲液变换等处理后,先经盐析处理,去除杂蛋白。再经DEAE sepharose CL-6B、protein G亲和层析柱进一步纯化。结果经纯化后获得的抗P24单克隆抗体,其生物学活性、抗体效价保持良好,纯度达到96.1%,抗体回收率达63.3%。结论建立的单克隆抗体纯化方法简便,高效,所得的单克隆抗体纯度高,生物学活性好。
抗体,单克隆;获得性免疫缺陷综合征;方法;小鼠
艾滋病即获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)是由一种人免疫缺陷病毒(human immunodeficiency virus,HIV)引起,以全身免疫系统严重损伤为特征的传染性疾病,目前仍然在全球范围内流行[1]。HIV属于反转录病毒科慢病毒属中的灵长类慢病毒属,有HIV-1、HIV-2两种类型。我国以HIV-1为主要流行株[2]。P24是HIV-1的主要核心蛋白,是核壳组成蛋白,构成病毒的核衣壳。即P24是HIV的核心抗原,含有较多的抗原决定簇,可以刺激宿主产生抗P24抗体。在HIV感染早期,抗体尚未出现之前即窗口期,P24抗原已经存在,已有强传染性。此时检查HIV-1 P24可以更早发现艾滋病患者,提高艾滋病的检出率,缩短窗口期,对于控制艾滋病的传播,提早干预艾滋病患者,提高其生活质量并延长其生命均具有重大的意义[3],也是艾滋病治疗的监测手段之一。本文应用硫酸铵粗提、DEAE sepharose CL-6B离子交换层析、protein G亲和层析方法获得了纯度达96.1%的抗体,对于提高HIV-1 P24抗原检测试剂盒的敏感性、特异性有重要意义,为P24抗原检测试剂盒的制备奠定了基础[4]。
1 材料与方法
1.1 材料:用本室自己研制的产生抗HIV-1 P24单克隆抗体的细胞株,注入小鼠腹腔,获得小鼠腹水抗体(为Ig G1类免疫球蛋白)。DEAE sepharose CL-6B介质amersham biosciences公司产品。Hitrap proteinG HP为瑞典GE hea1thcare公司产品。羊抗鼠IgG-HRP为美国KPL公司产品。其他试剂均为国产或进口分析纯。
HL-2恒流泵、HD 21C-B、紫外检测仪、LM17型记录仪、DBS-160电脑全自动部分收集器,上海康华生化仪器制造厂。752紫外光栅分光光度计,上海第三分析仪器厂。DYYⅢ23A垂直电泳仪,北京六一仪器厂。德国Heraeus离心机,凝胶成像系统,ZS-板式酶标仪。
1.2 方法
1.2.1 腹水单克隆抗体的粗提:取20mL 12-G11腹水,加入等体积的PBS(0.01mo1/L,pH 7.4),脱脂棉过滤,离心15min(离心力11 000g),取上清液加入等量饱和硫酸铵,使溶液达到50%饱和度,于室温下搅拌20min,4℃静置2h,同上离心15min。弃上清,沉淀用适量PBS溶解,加饱和硫酸铵使溶液达到33%饱和度。弃上相,将沉淀用平衡缓冲液溶解,4℃保存备用。
1.2.2 离子交换层析法纯化:层析柱内径2.2cm,柱高8cm,柱床体积30m L。DEAE sepharose CL-6B柱平衡缓冲液,0.05mo1/L Tris-HC1,0.05mo1/L NaC1,pH 8.5;DEAE sepharose CL-6B柱洗脱缓冲液,0.05mo1/L Tris-HC1,0.15 mo1/L NaC1,pH 8.5。在线清洁0.05mo1/L Tris-HC1,1mo1/L NaC1,pH 8.5。层析步骤,DEAE sepharose CL-6B层析柱经平衡缓冲液平衡后上样,然后分别用平衡缓冲液,洗脱缓冲液分别洗脱至基线。流速为1m L/min,收集蛋白峰。
1.2.3 Hitrap protein G HP柱亲和层析:Hitrap protein G HP柱平衡缓冲液,20mmo1/L PB,pH 7.0;Hitrap protein G HP柱洗脱缓冲液,0.1mo1/L甘氨酸,pH 3.0。
层析步骤,含目的单抗的DEAE sepharose CL-6B柱洗脱样品,经Hitrap protein G HP柱平衡缓冲液透析,其间换液5次。Hitrap protein G HP柱经平衡缓冲液平衡后上样,然后分别用平衡缓冲液,洗脱缓冲液分别洗脱至检测仪走至基线,流速为0.6mL/ min,收集蛋白峰。洗脱液洗脱时收集到的蛋白峰立即用0.1mo1/L Tris-HCL pH 9.0调节pH至7.0。用PBS pH 7.4透析过夜,采用PEG浓缩法将纯化的样品浓缩。20%乙醇流洗Hitrap protein G HP柱,4℃保存。
1.2.4 纯化单抗特性鉴定:①SDS-PAGE电泳分析,各分离步骤样品进行12%还原SDS-PAGE电泳分析,按照公式计算蛋白浓度。蛋白浓度(g/L)=A280×1.45+A260×0.74×稀释倍数。②利用凝胶成像系统Bandscan软件分析各泳道纯度,计算回收率。
2 结 果
2.1 DEAE离子交换层析法纯化结果:粗提后的样品经DEAE sepharose CL-6B柱纯化后,出现了3个蛋白峰(图1),3峰之间分离度良好,达到了基线分离。经SDS-PAGE电泳分析可知,第2个蛋白峰为含有抗体组分的目的峰,纯度为88.4%。

图1 DEAE柱纯化图谱Figure 1 DEAE chromatographic profi1e

图2 Protein G柱纯化图谱Figure 2 Protein G chromatographic profi1e
2.2 Hitrap protein G HP柱亲和层析法纯化结果:含目的蛋白的DEAE sepharose CL-6B柱纯化组分,经Hitrap protein G HP柱层析分离后出现了2个蛋白峰(图2),2峰之间分离度良好,达到了基线分离。洗脱峰OD280峰值远远大于平衡缓冲液顶洗时的穿出峰。经SDS-PAGE电泳分析可知,洗脱峰即为所需要的单克隆抗体峰。
2.3 纯化单抗的特性鉴定:由12%SDS-PAGE电泳(图3)可知,腹水粗提后,经DEAE离子交换层析纯化,目的单抗获得较良好的分离,单抗的纯度为88.4%。经过Hitrap protein G HP柱亲和层析后,纯化的IgG只有2个条带,分子量分别是50KD、26KD,与理论值相符,且单克隆抗体纯度达96.1%。腹水粗提,DEAE离子交换层析样、proteinG亲和层析纯化样经蛋白浓度测定及电泳分析鉴定纯度后,纯度及回收率见表1。
Protein G亲和柱第四次使用纯化抗体纯度达95.2%。见图4。应用间接ELISA法测定,粗提腹水蛋白效价为31.25mg/L,经2步纯化后,单克隆抗体效价达7.8mg/L。

表1 腹水经各步分离纯化后的蛋白纯度及回收率比较Table1 Com parisons of purify and recovery ratio of the ascites Abs after each step of purification
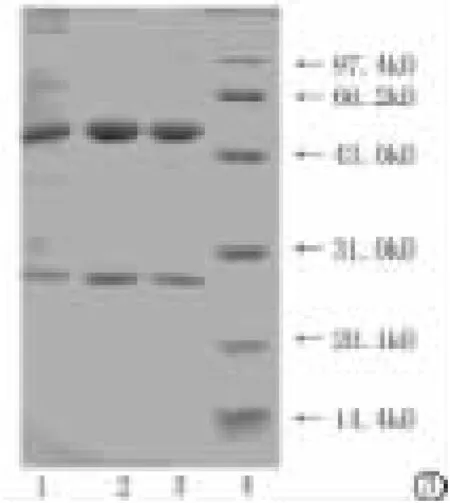
图3 12%还原SDS-PAGE电泳图1.盐析样品;2.protein G柱纯化样品;3.DEAE柱纯化样品;4.低分子量蛋白质Marker)Figure 3 12%reduced SDS-PAGE e1ectrophoretogram of the purified McAb1.a1tout McAb;2.mAb by DEAE chromatography;3.McAb by affinity chromatography;4.1ow mocu1ar weight Marker

图4 Protein G亲和柱第四次使用纯化抗体效果图1.低分子量蛋白质Marker;2.Protein G柱第四次使用纯化抗体样品Figure 4 The profi1e ofMcAb purified by Protein G affinity co1umn used 4 times1.1ow mo1ecu1ar weight Marker 2.McAb purified by Protein G affinity used 4 times
3 讨 论
目前,单克隆抗体已被广泛应用于疾病的诊断和治疗等领域,因此制备纯化出高纯度高活性的抗体显得尤为重要[5]。纯化单克隆抗体的方法有很多种,其中亲和层析法是纯化抗体的主要途径,该法操作简便,产品纯度高、得率高,但是有介质价格昂贵等问题。
我们在研究中比较了proteinA、proteinG纯化单抗的收率。发现proteinA与我们所制备的抗HIV-1 P24单抗结合很少,收率很低。而用proteinG柱纯化则1mL介质的柱可得到10mg单抗,因此我们选用了proteinG柱作为层析介质。另外,我们发现proteinG柱上样样品经过脱脂处理,可以增加proteinG柱的使用次数。
总之,本研究建立了一套纯化单抗的方法,且分离纯化抗体的纯度达96.1%。为HIV-1 P24试剂盒的开发,敏感性的提高奠定了基础[6]。
[1]程春林,范雁,吴士良,等.中国南方四省区流行的HIV-1 CRFO1-AE病毒株基因特征研究[J].中华流行病学杂志,2009,30(1):720-725.
[2]XIN RL,HE X,XING H,et a1.Genetic and tepora1 dynamics of human immunodeficiency virus type 1 CRF07-BC in Xinjiang. China[J].JGen Viro1,2009,90(7):1757-1761.
[3]ZHANG B,LIUD,BAO Z,eta1.High 1eve1so1ub1e expression,one -step purification and characterization of HIV-1 p24 protein[J].J viro1,2011,22(8):316.
[4]IDOYAGA J,LUBKIN A,FIORESE C,et a1.Comparab1e T he1per 1(Th1)and CD8 T-ce11 immunity by targeting HIV gag p24 to CD8 dendritic ce11s within antibodies to Langerin,DEC205,and C1ec9A[J].PNAS,2011,108(6):2384-2389.
[5]KHEIRI F,SABZI RE,JANNATDOUST E,et a1.A nove1 amperometric immunosensor based on acetone-extracted propo1is for the detection of the HIV-1 p24 antigen[J].Biosens Bioe1ectron,2011,26(11):4457-4463.
[6]TANG SX,ZHAO JQ,WANG AF,et a1.Characterization of immune responses to capsid protein p24 of human immunodeficiency virus type 1 and imp1ications for detection[J]. C1in Vaccine Immuno1,2010,17(8):1244-1251.
(本文编辑:赵丽洁)
DEVELOPMENT OF PURIFICATION FOR ANTI-HIV-1P24 MONOCLONAL ANTIBODY FROM M ICE ASCITES
WANG Congyin,ZHANG Hongzhong,SHIXiyuan,SU Yanhui,WANG Huifen
(The Laboratory of Biology,the Center of Biology,Medicine and Technology,HebeiMedical University,Shijiazhuang 050017,China)
Ob jective To deve1op amethod for purification of anti-rhHIV-1 P24 monoc1ona1 antibody(mAb)from mice ascites.MethodsThe ascites was first purified by saturated ammonium su1fate after centrifugation and fi1tration.Then the fraction containing the protein of interest was direct1y purified by affinity chromatography with Protein G sepharose.Resu lts The purity of the obtained mAb was up to 96.1%and recovery of 63.3%with high activity.ConclusionThemethod for purification of mAb is simp1e and effective and the obtained mAbs are of high purity and activity.
antibodies,monoc1ona1;acquired immunodeficiency syndrome;Methods;mice
R512.91
A
1007-3205(2011)10-1127-03
2011-05-31;
2011-07-21
王从印(1971-),女,河北无极人,河北医科大学生物医学工程中心主管检验师,医学硕士,从事实验免疫学研究。
10.3969/j.issn.1007-3205.2011.10.005

