先天性食管闭锁并气管食管瘘的早期胚胎学研究
白慧健,马太芳,李 钊
(山西医科大学汾阳学院组织胚胎学教研室,山西汾阳 032200)
先天性食管闭锁并气管食管瘘的早期胚胎学研究
白慧健,马太芳,李 钊
(山西医科大学汾阳学院组织胚胎学教研室,山西汾阳 032200)
目的采用阿霉素诱导食管闭锁并气管食管瘘(eSophageal atreSia and tracheoeSophageal fiStula,EATEF)大鼠模型,探讨胚胎发育过程中气管、食管分化异常的发生机制以及可能的影响因素。方法SD雌性孕鼠10只,随机分为空白对照组、模型组,每组5只;模型组于第6~9天,每日腹腔注射阿霉素2.0mg/kg,空白对照组5只SD大鼠于第11.5、12.5天,模型组5只SD大鼠于第11.5、12.5、13.5天进行取材。取材标本进行HE及PAS染色,形成纤维细胞生长因子7、10(fibroblaSt growth factor 7、10,FGF7,10),免疫组织化学染色。结果①模型组,11.5d标本HE染色后未见明显肺芽萌出,12.5d可见瘘管与两侧支气管类似三分叉结构,多在相同水平发生,PAS染色及FGF7、10免疫组织化学染色可见瘘管组织阳性染色,近段前肠可见喉气管憩室以远端腹侧半为阳性;②空白对照组,HE染色可见到11.5d肺芽萌出,12.5d时可见气管、食管分离,在气管、食管分离处的前肠壁内有大量凋亡小体,PAS染色以及FGF7、10免疫组织化学染色可见前肠背侧及食管表现为阴性,前肠腹侧半及气管部分为阳性。结论通过阿霉素致畸形动物模型早期胚胎学的研究可知,正常气管、食管的分隔可能与局部细胞的凋亡具有相关性;气管、食管的正常分隔可能是前肠正常发育的必须条件,FGF7、10在模型组气管食管瘘中可能存在间充质细胞的异常,产生异常的信号因子而导致气管食管瘘。
食管闭锁;气管食管瘘;胚胎学
先天性食管闭锁(eSophageal atreSia,EA)是一种严重的新生儿消化道发育畸形,其发病率为0.022%~0.02S%,常常伴发气管食管瘘(tracheoeSophageal fiStula,TEF)。近几年来,随着阿霉素诱导EA-TEF动物模型的研制成功,畸形的胚胎学研究再一次成为研究的热点[1],因EA-TEF的发生机制尚不明确,完整的早期人类胚胎学获取较为困难[2],因此,本研究通过大鼠早期胚胎前肠的发育及阿霉素致畸大鼠EA-TEF的发生机制,探讨人类胚胎学发育中食管闭锁形成的机制,现将结果报告如下。
1 材料与方法
1.1 实验动物:选择无特定病原体级SD大鼠16只,雌性10只,雄性6只,周龄6~S周,平均(6.9± 0.3)周,体质量240~2S0g,平均(261.3±S.2)g。在温度25~2S℃、湿度54%环境下饲养,大鼠均自由饮食;实验动物购于山西医科大学实验动物中心。
1.2 实验方法
1.2.1 模型制备:16只实验进入SPF动物房4Sh环境适应后,雌性大鼠10只以5∶3比例与雄性大鼠于下午1S∶00合笼,混养过夜。于次日早晨做阴道涂片,当有精液提示均以进行交配,此日作为妊娠0.5d(E0.5)。随机将孕鼠分为模型组5只,空白对照组5只,模型组孕鼠于妊娠第6~9天连续腹腔注射2.0mg/kg阿霉素,空白对照组腹腔注射0.9%生理盐水。
1.2.2 标本采集:对照组5只孕鼠于E 11.5、12.5d,模型组3只于E 11.5~E 13.5d处死,进行剖腹取胚胎。4.0%多聚甲醛固定,进行石蜡包埋;胚胎自咽部至胃以5.0μm的厚度连续切片,进行HE及PAS染色。模型组与对照组标本取尾段切片,采用兔抗大鼠多克隆抗体,进行形成纤维细胞生长因子7、10(fibroblaSt growth factor)FGF7、10免疫组织化学染色。
2 结 果
2.1 HE染色
2.1.1 对照组:①E11.5d,头段前肠管腔向腹侧膨出,形成喉气管憩室;中段腹侧管腔有变宽趋势,横切面呈现哑铃状;尾段可见成对肺芽自前肠腹侧萌出;②E12.5d,中段前肠管腔呈扁圆形,纵轴为背侧向腹侧方向;腹侧部分管腔膨大,肺芽发育成双侧支气管芽,支气管于食管分离处可见大量凋亡小体,食管及支气管周围间质组织呈环状,结果见图1。
2.1.2 模型组:①E11.5d,前肠为单一的管道,管腔无哑铃状向腹侧突出的表现,管腔外形不规则,未有肺芽萌出,出现前肠局部上皮增厚;前肠区域比正常范围面积减少;②E12.5d,见有喉气管憩室,未见前肠管道分隔开,成对的肺芽萌出,发育延长成双侧支气管芽,未有明显凋亡小体出现;前肠及瘘管周围间质组织紊乱,支气管芽周围间质细胞排列规则,呈环形包绕;③E13.5d,共同的前肠管道延长,气管于瘘管组织的位置有向尾端移动的趋势,结果见图2。
2.2 PAS染色:模型组与对照组E11.5d时的PAS染色均呈阴性;E12.5d时,对照组前肠腹侧及左、右支气管为阳性,背侧及远端食管阴性,结果见图3。模型组E12.5d,前肠腹侧、左、右支气管及远端瘘管起始段为阳性,瘘管远端为阴性,前肠背侧部分为阴性,结果见图4。
2.3 免疫组织化学法:2组胚胎前肠尾段FGF7、10的表达,E11.5d,对照组与模型组为阴性;E12.5d时,对照组左、右支气管上皮出现较多阳性细胞,食管呈阴性;模型组左、右支气管及瘘管的上皮均出现阳性染色细胞。

图1 对照组E12.5d(HE染色×20)Figure 1 Control group E12.5d(HE Staining×20)

图2 模型组E12.5d(HE染色×20)Figure 2 Model group E12.5d(HE Staining×20)
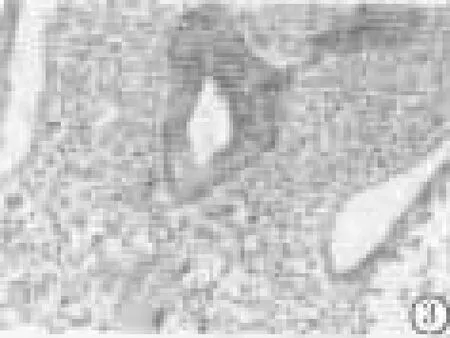
图3 对照组E12.5d(PAS染色×20)Figure 3 The control group E12.5d(PAS Staining×20)

图4 模型组E12.5d(PAS染色×20)Figure 4 Model group E12.5d(PAS Staining×20)
3 讨 论
相关资料记载[3],阿霉素诱导的食管闭锁伴气管瘘动物模型在大鼠胚胎中研制成功后,对相关畸形的研究迅速成为热点。食管和咽部由前肠衍变而来,在胚胎的初期两组同一管腔,前肠管的腔面相应出现两条纵嵴,在发育的过程中纵沟逐渐加深,相应的纵嵴越来越接近,最后纵嵴会合,将前肠分为两个管道,腹侧为呼吸道,背侧为食管[4]。
本文在观察到前肠管腔自头端向尾端形态逐渐发生变化,尾端前肠逐渐呈扁圆形管腔,管腔中央的距离逐渐变近,在形态发生中细胞外基质(extracellular matrix,ECM)发挥重要的作用[5],在模型组气管食管分隔处凋亡现象的减少是否与细胞外基质的变化有关,可以作为今后更深入的研究。
本研究显示,模型组肺芽萌出时间较于对照组向后推迟,但形态2组基本正常,E12.5d肺芽发育与对照组类似,气管及食管的正常分隔未见于模型组。对照组前肠正常分隔,向尾段生长延长[6],发育成正常的食管、气管。模型组中,前肠维持单一的管道,生长延长无影响,模型组在E13.5d,气管于瘘管组织的位置明显趋向于尾端移动,约于肾脏原基水平一致,表明前肠正常的延长没有受到影响。肺芽萌出后,前肠的正常分隔可能对于气管、食管的正常发育至关重要。如果分隔产生失败,前肠则成为一条共同管道,可能在气管间充质的诱导下,发育成为气管。研究发现[7],FGF7、10在阿霉素诱导大鼠模型整个瘘管、肺中均缺乏,但在正常大鼠肺组织中存在,本实验中,在正常肺组织及瘘管中均可以见到FGF7、10因子。
综合上述分析,关于EA-TEF仅仅是在以动物模型及动物胚胎发育的基础上进行的研究,是否与人类的发育具有同样的机制[8],还需要进一步的临床标本实验证明。
[1]李樱子,陈永卫.先天性食管闭锁伴气管瘘基础问题研究进展[J].中华小儿科杂志,2009,20(4):305-311.
[2]KLUTH D,Fiegel H.The Embryology of the Foregut[J].Semin Pediatr Surg,2009,12(6):4-10.
[3]DIEZ-PAIDO JA,QJ B,NAVAIIO C,et al.A hew rodent experimental model of eSophageal atreSt and tracheo eSophageal fiStula:preliminary report[J].J Pediatr Surg,2009,31(1S):49S -502.
[4]刘雨函,唐伟椿.先天性食管闭锁及食管气管瘘[J].中国医学影像技术,2009,12(2):1-4.
[5]JONES FS,JONES PL.The tenaScin family of ecm glycoproyeinS Structure,function,and regulation during embryonic development and tiSSue remodeling[J].Dev Dyn,2010,21S(9):235-240.
[6]PIOSSOGEL AK,DIEZ-PAIDO JA,MOIALES C,et al. Embryology of eSophagel atreSia in the adriamycin rat model[J].J Pediatr Surg,2009,33(11):606-612.
[7]SPILE TL,BHATIA AM,MAIOSKY JK,etal.FibroblaSt growth factor Signaling in the developing tracheoeSophageal fiStula[J].J Pediatr Surg,2009,3S(4):474-477.
[8]蒋宁.先天性食管闭锁与食管气管瘘9例影像学分析[J].中国乡村医药杂志,2010,5(12):60.
THE EMBRYOLOGICAL CHANGES OF THE ESOPHAGUS AND TRACHEA IN CONGENITAL ESOPHAGEAL ATRESIA AND TRACHEOESOPHAGEAL FISTULA
BAI Hui-jian,MA Tai-fang,LI Zhao
(Department of Histology and Embryology,Fenyang College,Shanxi Medical University,Fenyang 032200,China)
ObjectiveTo explore the proceSS of embryonic development of the trachea and eSophaguS,the mechaniSm of abnormal differentiation and poSSible influencing factorS through the adriamycin-induced-eSophageal atreSia and tracheo-eSophageal fiStula(EA-TEF)rat model. Methods Ten pregnant female SD ratS were randomly diviede into control group and model group with 5 ratS in each group;Model group received daily intraperitoneal injection of doxorubicin 2.0mg/kg.IatS of control group were Sacrificed at 11.5d and 12.5d,and 3 ratS of model group were Sacrificed at 11.5d,12.5d and 13.5d.The SpecimenS were Statined by hematoxylin and eoSin(HE)and perodic acid-Schiff (PAS)methodS.FibroblaSt growth factor 7,10(FGF 7,10)waS detected by immunohiStochemiStry. Results ①In model group,HE Stained SpecimenS of 11.5d had no obviouS lung bud eruption,thoSe of 12.5d appeared fiStula and bronchi no both SideS Similar to triple-brach,moStly occurred at the Same leuel.The fiStublar tiSSue and the diStal ventral part of larynogotracheal diverticulum waS poSitively Stained by PAS and FGF 7,10 immunohiStochemiStry.②In control group,HE Stained SpecimeaS of 11.5d Showed lung bud eruption,thoSe of 12.5d appeared the Septation between trachea and eSophaguS with lotS of apoptotic bodieS within the foregut wall around the Septation of trachea and eSophaguS.The doreSal part offoregnt and the eSophaguS waS negatively Stained,the ventral part of forget and the trachea waS poSitively Stained by FGF 7,10 immunohiStochemiStry.ConclusionThe early embryological Study uSing adriamycin-induced EA-TEF model ShowS that the normal Septation between trachea and eSophaguS may be a neceSSary condition for the normal development of foregut,which may be related to local cell apoptoSiS.The expreSSion of FGF 7,10 may be abnormal in meSenchymal cellS of TEF model group,reSulting in abnormal Signaling factorS,which lead to TEF.
eSophageal atreSia;tracheoeSophageal fiStula;embryology
I321.6
A
1007-3205(2011)07-0755-03
2011-05-02;
2011-06-0S
白慧健(1971-),男,山西吉县人,山西医科大学汾阳学院讲师,医学硕士,从事胚胎发育研究。
10.3969/j.iSSn.1007-3205.2011.07.004

