中华眼镜蛇毒活性组分诱导内皮细胞凋亡的机制
刘新艳,余清声,王桂平,余红娥,朱 柳,袁 牧,楼晓华,腾脉坤
(1.广州医学院药物研究中心,广东 广州 510182;2.广州医学院 护理学院,广东 广州 510182;3.广东药学院 中山校区,广东 中山 528458;4.中国科学技术大学 生命科学院,安徽 合肥 230026)
血管生成(angiogenesis)是指从已存在的血管周围发展出新的毛细血管的过程,被认为与肿瘤的发生、发展和转移密切相关[1]。内皮细胞是构成血管的主要成分,抑制内皮细胞凋亡,促进内皮细胞存活被认为是血管生成过程中的基本机制,越来越多有关血管生成抑制剂的研究证据表明,血管内皮细胞的凋亡可以促使肿瘤血管的退化,抑制肿瘤的生长与转移[2]。本课题组从中华眼镜蛇毒中分离提纯出一种相对分子质量(Mr)约为8000,等电点为7.5的单一活性组分,命名为中华眼镜蛇毒活性组分(China cobra venom active factor,CCVAF)。前期研究已经证实CCVAF能够选择性抑制内皮细胞增殖[3],抑制肺癌细胞诱导的内皮细胞迁移[4],诱导内皮细胞凋亡[5]以及同时具有在体外抑制血管生成的作用[6],为进一步探讨其产生这种作用的机制,本文研究了CCVAF作用后牛肺主动脉血管内皮细胞(bovine arteria pulmonalis vascular endothelial cells,BAVEC)Bcl-2、caspase3 等相关蛋白的表达,探讨了CCVAF诱发内皮细胞凋亡及抑制血管生成的可能机制。
1 材料和方法
1.1 CCVAF的制备及活性鉴定
中华眼镜蛇毒原毒通过CM-Sepharose、Protein-PakTM SP柱后得到单一组分CCVAF,CCVAF的纯度应用SDS-PAGE测定,在浓缩电压为80 V,分离电压为120 V的条件下,经5%的浓缩胶,15%的分离胶,用考马斯亮蓝染色,证实其为单一条带,Mr为8000。pH试纸法测定等电点7.5,溶血实验结果表明没加卵磷脂和加卵磷脂都不存在溶血活性,表明CCVAF不存在直接和间接溶血活性(此部分实验由中国科技大学生命科学院完成)。急性毒性实验证实其 LD50是 2.9 μg/g[5]。
1.2 主要试剂
细胞培养基RPMI 1640、胰蛋白酶(美国Gibco公司);胎牛血清(BCA)(杭州四季青生物工程材料有限公司);Bcl-2-FITC抗体(美国 BD公司);caspase3活性检测试剂盒(美国Chemicon公司);BCA蛋白质定量试剂盒(美国Pierce公司)。
1.3 主要仪器
二氧化碳培养箱(美国Quene公司);SM-3型自动酶标仪(北京圣健东方医疗仪器厂);Ultrospec 2100紫外/可见分光光度计(英国Biochrom公司);Sigma3k30低温超速离心机(美国Sigma公司);Becton,Dickinson FACS Vantage流式细胞仪(美国BD公司)
1.4 BAVEC的原代培养及鉴定
出生1 d内、未哺乳的新生牛(广州奶牛研究所)放血处死后打开胸腔,无菌条件下剪开心包膜,迅速取出肺主动脉,放入冰D-hanks缓冲液(含青霉素、链霉素)4℃保存,4 h内采用血管内消化法[7]进行原代培养,相差显微镜观察细胞的形态,免疫组化鉴定第Ⅷ因子表达。0.25%胰蛋白酶+0.02%EDTA消化传代,取2~3代生长良好的细胞供实验用。
1.5 流式细胞仪检测CCVAF作用后BAVEC Bcl-2蛋白的表达水平
取生长良好的 BAVEC,0.25%胰蛋白酶 +0.02%EDTA消化成细胞悬液,调整为1×105细胞/mL,种植于75 cm2培养瓶内,待细胞生长至80%左右铺满瓶底,弃瓶内原培养液,实验组加入以培养基RPMI 1640配制的不同浓度的CCVAF 18 mL(终浓度为 1.25,2.5,5,10 mg/L),对照组加入等体积的培养基,37℃孵育4 h后,收集细胞,每样本大约为5×106细胞/mL,进行流式细胞仪分析:每管加入1×106个细胞,加入固定液 100 μL,室温暗处孵育15 min,1000 r/min离心5 min,弃上清,加入破膜剂100 μL 及 FITC 标记细胞内抗体(Bcl-2-FITC)5 μL和相应的阴性对照(MouseIgG1-FITC),4℃冰箱内孵育20 min,1000 r/min离心5 min,弃上清,磷酸盐缓冲液(PBS)0.5 mL重悬细胞,过300目尼龙网成单细胞悬液,上流式细胞仪检测。重复2次。
1.6 caspase 3活性的检测
1.25,2.5,5,10 mg/L CCVAF 分别作用于生长良好的BAVEC 4 h(37℃),对照组不用药物处理,只给予等体积的培养基,消化成细胞悬液,计数细胞。每管取1×106个细胞,1500 r/min离心10 min。冷的1×细胞裂解液200 μL重悬细胞,冰上孵育10 min,30000 r/min离心5 min。将上清转移到新的试管中,置于冰上,采用BCA蛋白定量试剂盒分析每样品的蛋白浓度,向测试管内加入对照品或测量样本 0.1 mL,加入工作液 2.0 mL,盖紧,37℃孵育30 min,测定在562 nm波长的吸光度(A)值,测得的A值减去空白对照品的A值,以BSA对照品浓度为横坐标,作标准曲线,确定样本的蛋白浓度。确定蛋白浓度后,终浓度一致的情况下,往各样本加入抑制剂,37℃培养箱中孵育2 h后,酶标仪检测405 nm波长的A值。上述实验重复2次,取2次实验的平均A值,进行统计分析。
1.7 统计分析
2 结果
2.1 原代培养BAVEC的鉴定
2 h后细胞开始贴壁,48~72 h后细胞铺满单层,相差显微镜下观察细胞呈典型的毛玻璃、铺路石样排列(见图1A),免疫组化法检测细胞第Ⅷ因子表达,结果细胞胞质呈棕褐色着色,证明是血管内皮细胞(见图1B)。

图1 BAVEC的鉴定Fig.1 Identification of BAVEC
2.2 CCVAF对细胞内Bcl-2蛋白表达的影响
经CCVAF作用后,流式细胞仪测定发现各浓度组与对照组一样,均未见阳性峰出现在M1,说明抗凋亡蛋白Bcl-2表达并未受到药物的影响,提示CCVAF可能不经此途径调节细胞的凋亡(图2)。

图2 流式细胞仪测定BAVEC Bcl-2蛋白的表达Fig.2 The expression of Bcl-2 protein in BAVEC(flow cytometer)
2.3 比色法测定capase3活性
BCA蛋白定量标准曲线方程为:Y=0.001 X+0.068(r=0.952,P < 0.01),确定终浓度为 900 mg/L。由表1可见,capase3活性在1.25 mg/L组即出现升高,随浓度的增加而升高,呈剂量依赖性(r=0.929,P <0.05),各浓度组与对照组相比差异有统计学意义(P<0.05)。各浓度组加入capase3活性抑制剂(Ac-DEVD-CHO)后,capase3活性明显降低,但与对照组比较差异仍有统计学意义(P<0.05),说明CCVAF能够上调capase3的活性。
3 讨论
蛇毒是一类天然混合毒素,含有多种活性成分,具有影响神经、血液等系统、直接抑制肿瘤细胞增殖、对抗肿瘤生长等作用[8]。最近有报道指出,蛇毒中同样含有血管生成抑制剂,作用于内皮细胞,影响肿瘤的血管生成,而且抗血管生成作用同样可以通过诱导内皮细胞凋亡来实现[9]。但发现的这些物质无论是去整合素还是基质金属蛋白酶均来自蝰科蛇毒,眼镜蛇毒中是否同样存在抑制血管生成的活性物质未见报道。我们前期研究证实从中华眼镜蛇毒中提取的CCVAF可以影响内皮细胞的增殖、黏附、迁移、重塑等血管生成的关键步骤和VEGF、bFGF等血管生成的重要促进因子的表达,诱导破坏血管生成、抑制肿瘤生长机制之一的内皮细胞凋亡[3-6],因此,这些实验结果揭示CCVAF可能通过诱导内皮细胞凋亡来实现其潜在的、重要的抑制血管生成功能。
表1 CCVAF及caspase3活性抑制剂处理后BAVEC caspase3的活性(n=6,)Tab.1 caspase3 activity of BAVEC after CCVAF and inhibitor of caspase3 activity(Ac-DEVD-CHO)(n=6,)
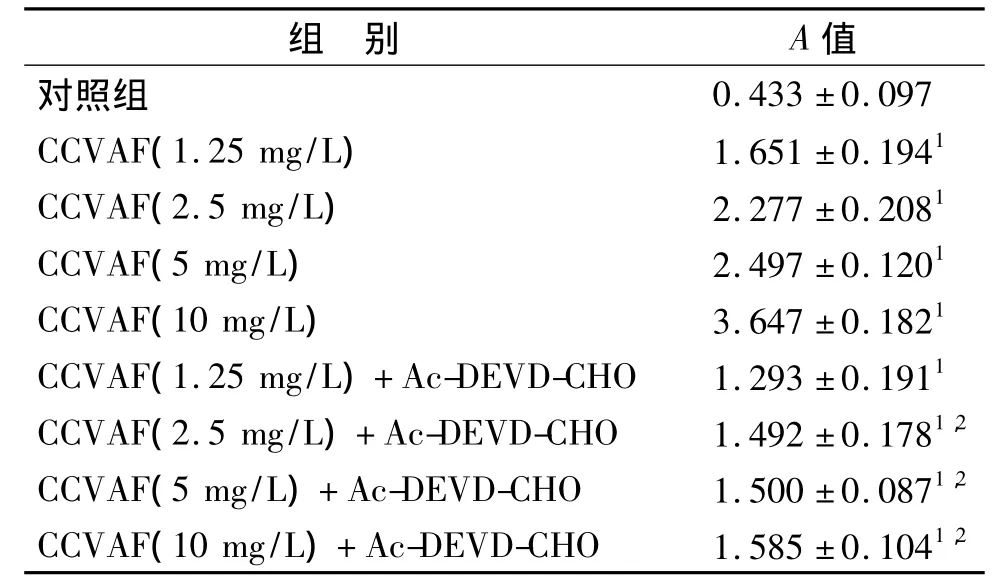
表1 CCVAF及caspase3活性抑制剂处理后BAVEC caspase3的活性(n=6,)Tab.1 caspase3 activity of BAVEC after CCVAF and inhibitor of caspase3 activity(Ac-DEVD-CHO)(n=6,)
与对照组相比:1P<0.05;与同浓度但未加抑制剂Ac-DEVDCHO组相比:2P<0.051P <0.05 vs control group;2P <0.05 vs the same concentration but no inhibitor(Ac-DEVD-CHO)group
组 别 A值对照组0.433 ±0.097 CCVAF(1.25 mg/L) 1.651 ±0.1941 CCVAF(2.5 mg/L) 2.277 ±0.2081 CCVAF(5 mg/L) 2.497 ±0.1201 CCVAF(10 mg/L) 3.647 ±0.1821 CCVAF(1.25 mg/L)+Ac-DEVD-CHO 1.293 ±0.1911 CCVAF(2.5 mg/L)+Ac-DEVD-CHO 1.492 ±0.1781,2 CCVAF(5 mg/L)+Ac-DEVD-CHO 1.500 ±0.0871,2 CCVAF(10 mg/L)+Ac-DEVD-CHO 1.585 ±0.1041,2
近年来哺乳动物细胞凋亡机制的研究取得了较大进展,细胞凋亡的两条主要生物学通路逐渐明确:一是从死亡受体TNFR家族起始的凋亡通路,主要通过膜连接的死亡受体来激活caspase级联反应,执行凋亡;二是线粒体位于中心地位的凋亡通路,起点是细胞色素C由线粒体释放至细胞质,引发caspase级联反应,导致凋亡[10]。两条通路的中心环节都是caspase的级联反应,caspase3是这一级联反应的中心环节。Bcl-2家族既能通过家族的抑凋亡成员阻止细胞色素C的释放抵抗凋亡,又能通过促凋亡成员Bax诱导细胞色素C的释放促进凋亡,还能影响caspase活化蛋白(如 Apaf1等)的作用[10]。因此caspase蛋白水解酶、Bcl-2蛋白家族是其中关键的两个调控点。在蛇毒类血管生成抑制剂研究中,Wu等[11]检测到去整合素Rhodostomin引起内皮细胞凋亡的过程,caspase3活性升高,蛇毒基质金属蛋白酶gaminelysin[12]也造成了同样的结果,且 Bcl-2/Bax比例降低。本研究选用这两项指标来反映CCVAF是否通过此途径引发内皮细胞的凋亡,进一步揭示CCVAF抑制内皮细胞增殖的作用机制。流式细胞仪检测CCVAF作用后内皮细胞抗凋亡蛋白Bcl-2的表达与对照组相比,并无显著变化,表明其引发的内皮细胞凋亡与下调Bcl-2表达可能无关。而采用比色法进行CCVAF处理后内皮细胞caspase3活性的测定,结果caspase3的活性呈浓度依赖性的升高,加入caspase3抑制剂后,其活性虽有一定程度的降低,但与对照组相比差异仍有统计学意义(P<0.05),提示CCVAF可能通过激活caspase3而诱发了一系列的级连反应,最终导致内皮细胞发生凋亡,这就给我们以后的研究一个启示:在细胞凋亡的两条主要通路中,Bcl-2主要影响线粒体所在的凋亡通路,既然实验结果Bcl-2表达没有出现显著变化,那可能就是通过另一条通路即从死亡受体TNFR家族起始,来激活caspase级联反应,执行凋亡。而具体的途径更需要以后进一步的实验证实。
[1]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[2]Dimmeler S,Zeiher A M.Endothelial cell apoptosis in angiogenesis and vessel regression[J].Circulation Res,2000,87(6):434-439.
[3]刘新艳,余清声,余红娥,等.中华眼镜蛇毒活性组分选择性抑制内皮细胞增殖[J].中国药理学通报,2006,22(2):184-188.
[4]余红娥,余清声,刘新艳,等.中华眼镜蛇毒组分抑制肺癌细胞H1299的血管生长因子VEGF和bFGF[J].中国临床药理学与治疗学,2005,10(9):970-973.
[5]刘新艳,余清声,余红娥,等.中华眼镜蛇毒活性组分诱导内皮细胞凋亡[J].中国药理学通报,2008,24(6):822-826.
[6]刘晓颖,余清声,覃 媛,等.中华眼镜蛇毒组分F的体外抗血管生成活性研究[J].中国生化药物杂志,2005,26(5):273-275.
[7]李立新.血管内皮细胞培养法[M]//徐叔云,卞如濂,陈 修.药理实验方法学.3版.北京:人民卫生出版社,2002:576-579.
[8]张及禄,文慧民,孙德军.蝮蛇毒小分子多肽的分离、纯化及其抗肿瘤作用研究[J].中国生化药物杂志,2009,30(4):217-225.
[9]Brown M C,Staniszewska I,Del Valle L,et al.Angiostatic activity of obtustatin as alpha1beta1 integrin inhibitor in experimental melanoma growth[J].Int J Cancer,2008,123:2195-2203.
[10]Spender L C,Inman G J.Targeting the BCL-2 family in malignancies of germinal centre origin[J].Expert Opin Ther Targets,2009,13:1459-1472.
[11]Wu W B,Peng H C,Huang T F.Disintegrin causes proteolysis of beta-catenin and apoptosis of endothelial cells:involvement of cellcell and cell-ECM interactions in regulating cell viability[J].Exp Cell Res,2003,286:115-127.
[12]Wu W B,Huang T F.Activation of MMP-2,cleavage of matrix proteins,and adherens junctions during a snake venom metalloproteinase-induced endothelial cell apoptosis[J].Exp Cell Res,2003,288:143-157.

