木糖对多年生黑麦草愈伤组织生长的影响
毛 萍,蒋 彬,马欣荣,邓霄禹,乔定君,杨 宏
(1.中国科学院成都生物研究所生态恢复重点实验室,四川 成都 610041; 2.中国科学院研究生院,北京 100049; 3.成都大学生物产业学院,四川 成都 610106)
随着生物技术的发展,转基因技术已成为牧草和作物遗传改良的有效途径[1];而随着转基因技术的发展、转基因作物种植面积的扩大和转基因产品商品化程度的加深,“转基因”以及其衍生物的生物安全性引起了政界、商界、产业界、学术界和民众的广泛关注和深入讨论。其中,转基因植物投放大田中,因选择标记基因的存在而产生的安全性问题是争论中的焦点[2-3]。目前,已经有超过50种标记基因用于科研和商业,而传统的选择标记基因,如抗生素和除草剂等抗性筛选基因[4],在很多国家和地区受到质疑,认为它们的存在会对人类健康、食品安全和生态环境带来威胁。因此,选择合适的、安全的、有效的标记基因,是摆在转基因科研人员眼下的难题,也是必须要解决的技术问题之一[5-6]。糖类代谢酶标记基因显示出了巨大的应用潜力。它们的编码产物是某种糖类的分解代谢酶,转化细胞能利用选择剂糖类作为主要碳源,可在选择培养基上生长扩增,而非转化细胞因不能利用选择剂糖类,处于饥饿状态,生长受到抑制但不被杀死,被称为正选择系统(positive selection system)[7]。由于非转化细胞不被杀死,从而避免了死亡细胞所释放的有毒代谢物对转化细胞的不利影响,并且选择剂无毒副作用也有利于转化细胞的再生,所以一般正选择系统都可以取得较高的转化率[8]。
木糖异构酶(xylose isomerase,xylA)基因编码木糖异构酶,大部分植物细胞不能以木糖作为碳源,但能以D-木酮糖作为主要碳源。木糖异构酶能催化D-木糖转化为D-木酮糖, 然后再经过磷酸戊糖途径分解代谢,为细胞生长所利用。在以D-木糖为筛选剂的培养基上, 转化细胞能将D-木糖转化为D-木酮糖而获得优势生长,非转化细胞因缺乏碳源而被抑制生长。早在1998年,Haldrup等[9]用D-木糖为唯一碳源的培养基筛选转化的马铃薯(Solanumtuberosum)、烟草(Nicotianatabacum)和西红柿(Lycopersiconesculentum)等植物细胞,成功地获得了转基因植株,且在马铃薯和西红柿的转化中,获得了比用npt II基因作为筛选标记基因时高几倍的转化效率。郭新梅等[10]也认为,以木糖作为筛选剂, 可以减小潜在的生物安全隐患。该研究小组利用木糖异构酶基因作为筛选标记,在含有不同浓度木糖的培养基上筛选出玉米(Zeamays)再生植株。韦正乙[11]从大肠杆菌(Escherichiacoli)基因组中克隆了木糖异构酶基因xylA,遂利用xylA为筛选标记,建立了百脉根(Lotuscorniculatus)转基因技术体系,其转化效率为45.5%,与除草剂筛选转化体系的效率(46.7%)相当,但转化周期提前10 d以上。赵辉等[12]在对香蕉(Musanana)进行甘露糖和木糖敏感性研究过程中发现,香蕉对D-木糖特别敏感,D-木糖可以作为香蕉有效的正筛选剂。天然D-木糖以多糖的形态存在于植物中,有的细菌能利用D-木糖为碳源进行发酵,动物能够完全或部分地利用木糖,木糖异构酶已在食品工业中达到了商品化的程度,所以在植株转化中利用xylA基因作为选择标记是十分安全的[13]。
多年生黑麦草(Loliumperenne)原产于亚洲和北非的温带地区,因具有抗寒、耐践踏、再生能力强、成坪快等优点而被广泛应用于世界各地的温带地区[14]。由于不同植物对木糖具不同的敏感性,目前多年生黑麦草转基因的木糖筛选体系在国内外没有任何报道。并且有关木糖对植物生长影响的研究,亦鲜有报道。为了在多年生黑麦草遗传转化中有效地利用木糖筛选系统,本研究以多年生黑麦草成熟种子诱导出的愈伤组织为外植体,研究以木糖为碳源对其愈伤组织培养的影响,有望为利用木糖异构酶基因作为筛选标记基因的多年生黑麦草遗传转化提供依据,为进一步建立稳定、有效、安全的筛选体系打下基础。
1 材料与方法
1.1材料 多年生黑麦草种子,品种“匹克”,购自百绿国际草业有限公司。
无机盐,有机盐,维生素类,氨基酸,蔗糖,麦芽糖,木糖购自成都科龙试剂公司;琼脂粉为日本进口分装;植物凝胶(phytagel,gelrite),购自SIGMA公司;6-苄氨基嘌呤(BA)、二氯苯氧乙酸(2,4-D)、吲哚乙酸(IAA)、萘乙酸(NAA)均由荷兰Duchefa公司生产;其他化学试剂均为进口分装或国产分析纯产品。
1.2愈伤组织诱导、培养和处理 愈伤组织诱导和继代的基本培养基是MS培养基[15]。愈伤组织诱导培养基(callus induction medium,IM)组分为MS+7 mg/L 2,4-D (2,4-二氯苯氧乙酸)+2.4 g/L植物凝胶+30 g/L麦芽糖;愈伤组织继代培养基(callus sub-cultivation medium,SM)组分为MS+3 mg/L 2,4-D+2.4 g/L植物凝胶+糖(不同质量浓度蔗糖、木糖或蔗糖+木糖),pH值5.8。在24~26℃下暗培养。蔗糖、木糖和蔗糖+木糖质量浓度及相应的培养基编号见表1。
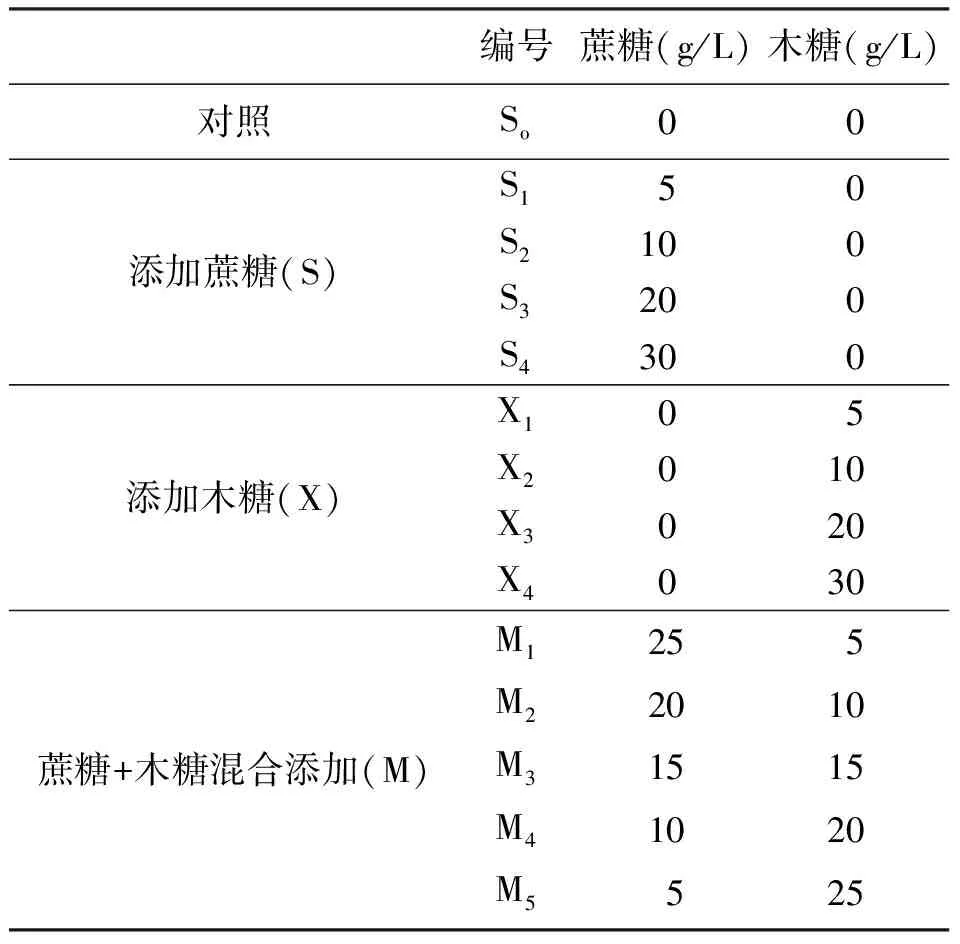
表1 不同糖质量浓度处理
选取外观均一、饱满的成熟种子,70%乙醇处理2 min后,加入含活性氯3%~4%的次氯酸钠水溶液(加入少量Triton X-100)灭菌15~20 min,再用无菌水清洗5~6次。超净台剥取胚接种到愈伤组织诱导培养基(IM)上,诱导培养3周。选取生长状态良好、颜色淡黄、大小一致的愈伤组织,转接到含30 g/L麦芽糖的继代培养基中培养4周。选取生长良好的愈伤组织,剥离成直径约4 mm大小,分别转接到含不同糖浓度的继代培养基(SM)中,于24~26℃黑暗条件下培养5周[15]。愈伤组织数为30个/皿,每处理5皿,共150个愈伤组织。观察愈伤组织的生长情况,并统计接入前后愈伤组织的质量变化情况。
1.3统计分析 采用SPSS V 16.0统计分析软件,进行DUNCAN 测验(P<0.05)。
2 结果与分析
2.1相同浓度的蔗糖和木糖对愈伤组织生长的影响 分别以蔗糖5 g/L(编号S1)、10 g/L(S2)、20 g/L(S3)、30 g/L(S4)和木糖5 g/L(编号X1)、10 g/L(X2)、20 g/L(X3)、30 g/L(X4)以及蔗糖+木糖混合糖作为SM培养基中的碳源,添加到培养基中(表1),培养5周后观察并统计生长量,结果见图1、2。
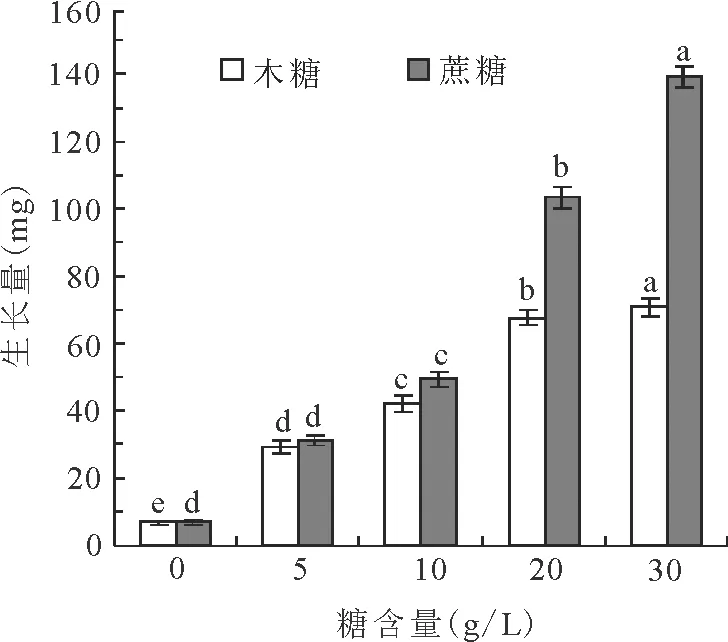
图1 含蔗糖或木糖的培养基中愈伤组织的生长情况
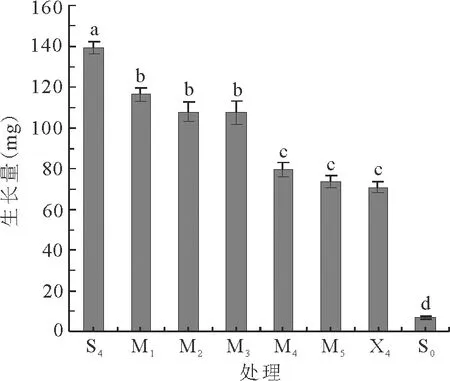
图2 蔗糖与木糖不同配比下愈伤组织的生长状态
比较蔗糖和木糖对多年生黑麦草愈伤组织生长的影响,结果显示,在添加单糖(0~30 g/L)的继代培养基中,随着糖质量浓度的增加,愈伤组织生长量呈上升趋势,添加蔗糖的培养基中愈伤组织的生长状况显著(P<0.05)优于添加木糖的培养基的(图1)。添加蔗糖的S1、S2、S3、S4愈伤组织平均生长量(mg/个)分别比添加木糖的X1、X2、X3、X4增加2.190、7.377、35.956、68.370 mg。方差分析表明,质量浓度为20和30 g/L时差异极显著(P<0.01)(图1)。
在添加蔗糖的培养条件下, 0、5、10、20和30 g/L质量浓度之间愈伤组织生长量差异显著(P<0.05)。在添加木糖的培养条件下,20和30 g/L质量浓度之间愈伤组织生长量差异不显著(P>0.05),其他质量浓度间差异显著(P<0.05)。
上述结果表明,黑麦草愈伤组织在同等条件下,分解和利用木糖的能力要远低于利用蔗糖作为碳源的能力,显示多年生黑麦草不能有效利用木糖作为碳源。但是与对照相比,生长量均高于对照。并且对照组在基本MS培养基中,亦有一定程度地生长。
2.2蔗糖/木糖不同比例对愈伤组织生长的影响 以总糖含量为30 g/L作为培养基中添加糖分的质量浓度,分析蔗糖+木糖不同比例对愈伤组织生长的影响,结果见图2。随着木糖质量浓度增加、蔗糖降低,愈伤组织生长量下降。S4(30 g/L蔗糖)培养条件下愈伤组织生长量最大;M1(25 g/L蔗糖+5 g/L木糖)、M2(20 g/L蔗糖+10 g/L木糖)、M3(15 g/L蔗糖+15 g/L木糖)生长量较S4低,但明显高于M4(10 g/L蔗糖+20 g/L木糖)、M5(5 g/L蔗糖+25 g/L木糖)和X4(30 g/L木糖)。S4与M1、M2和M3相比,差异显著(P<0.05);而M1、M2和M3较之M4、M5和X4,差异也显著(P<0.05)。
M5和X4培养条件下愈伤组织生长量为最小,平均生物量积累分别为73.50和70.66 mg/个,且二者之间差异不显著(P>0.05)。
上述研究结果表明,木糖能显著限制多年生黑麦草愈伤组织生长。因此,在维持细胞正常的渗透压下,可以在培养基中加入5 g/L蔗糖+25 g/L木糖或者30 g/L木糖作为木糖筛选体系中的筛选压。
3 讨论与结论
大部分植物细胞不能以木糖作为碳源,但能以D-木酮糖作为主要碳源。木糖经过木糖异构酶催化,能将D-木糖转化为D-木酮糖,然后再经过磷酸戊糖途径分解代谢,为细胞生长所利用。大部分植物不含木糖异构酶基因。黑麦草是否能利用木糖作为碳源,迄今未见报道。本研究表明,木糖对黑麦草愈伤组织生长有显著影响。愈伤组织生长量随糖浓度增加呈增加趋势,且在含蔗糖培养基中愈伤组织的生长显著优于含木糖的培养基。在混合培养中(糖总量30 g/L),随着蔗糖含量减少、木糖含量增加,愈伤组织生长量下降,表明木糖能显著抑制多年生黑麦草愈伤组织的生长。推测多年生黑麦草愈伤组织不能有效分解D-木糖为自己所用而导致缺乏碳源,生长受到较大程度地限制。
然而,在含木糖培养基中愈伤组织能有一定程度的生长,并且生长明显高于对照。通常在组织培养中,加30~40 g/L的蔗糖或麦芽糖或葡萄糖等,不仅为植物生长提供碳源,同时对维持植物细胞正常的渗透压起着重要作用。因此,推测可能是一定浓度的糖,对于维持细胞的渗透压起着重要作用,因此生长优于对照,并且以30 g/L生长最好。
观察发现,对照亦有一定地生长。由于MS基本培养基中含有植物生长所需要的大量元素、微量元素、铁盐、维生素等,能维持愈伤组织的基本生长,因此没有加糖的对照,亦能保持活性并缓慢生长。
在总糖量为30 g/L时, MS+5 g/L蔗糖+25 g/L木糖和只含有30 g/L木糖的培养基中,愈伤组织生长量最低。因此,在以多年生黑麦草愈伤组织为外植体的木糖筛选体系中,在维持细胞正常的渗透压条件下推荐使用5 g/L蔗糖+25 g/L木糖或者只含有30 g/L的木糖作为选择压。该结果与在玉米中的研究结果相似[10]。由于在木糖培养基中愈伤组织有一定地生长,推测可能在选择中会产生一定量的假阳性。有关木糖对愈伤组织分化和植株生长的影响有待进一步研究。
目前,以糖类为正向筛选标记基因的遗传转化体系已经应用到多种植物转基因工作中,其中研究较多的为甘露糖阳性选择系统[17-20]。糖类筛选系统优于抗生素和除草剂等负向筛选系统,因其不产生细胞毒性,也不会产生由于选择剂的使用而对环境造成污染和破坏的不良后果,可作为绿色安全的筛选基因。本研究表明,木糖作为安全的选择标记,具有潜在的应用价值。因此,异构酶在植物遗传转化中有良好的应用前景。但是,目前利用木糖异构酶基因的木糖阳性选择系统在在植物转基因的运用中,有关报道较少,相关研究尚需深入进行。
综上所述,本研究结果为进一步建立木糖为选择剂的黑麦草遗传转化系统提供了依据。
[1] 张磊,吴金霞,董芳,等.抗逆转ABP 9基因黑麦草和高羊茅植株的鉴定[J].草业科学,2010,27(7):72-77.
[2] 钱方,高志芳,滕木子,等.转基因作物的安全标记基因[J].河南农业科学,2007(7):17-20.
[3] 杨英军,周鹏.转基因植物中的标记基因研究新进展[J].遗传,2005,27(3):499-504.
[4] 刘立侠,李桂民,路云侠,等.中国牧草生物技术的研究现状和展望(英文)[J].草地学报,2009,17(3):389-401.
[5] Sundar I K,Sakthivel N.Advances in selectable marker genes for plant transformation[J].Journal of Plant Physiology,2008,165:1698-1716.
[6] Ramessar K,Peremarti A,Gómez-Galera S,etal.Biosafety and risk assessment framework for selectable marker genes in transgenic crop plants:A case of the science not supporting the politics[J].Transgenic Reseach,2007,16:261-280.
[7] Bojsen K,Donaldson I,Haldrup A,etal.Mannose or xylose based positive selection:United States,5767378[P].1998-06-16.
[8] Joersbo M,Okkels F T.A novel principle for selection of transgenic plant cells:Positive selection[J].Plant Cell Reports,1996,16:219-221.
[9] Haldrup A,Petersen S G,Okkels F T.The xylose isomerase gene from Thermoanaerobacterium thermosulfurogenes allows effective selection of transgenic plant cells using D-xylose as the selection agent[J].Plant Molecular Biology, 1998,37(2):287-296.
[10] 郭新梅, 张晓东, 梁荣奇,等.以木糖异构酶基因为筛选标记的玉米遗传转化[J].植物生理与分子生物学学报,2007,33(6):547-552.
[11] 韦正乙.利用安全筛选标记转化系统获得抗逆转基因百脉根[A].中国遗传学会第八次代表大会暨学术讨论会论文摘要汇编(2004-2008)[C].重庆:中国遗传学会第八次代表大会暨学术讨论会,2008:53-54.
[12] 赵辉,范武波,朱芸,等.香蕉对甘露糖和木糖的敏感性研究[J].果树学报,2010,27(2):233-237.
[13] Pawan K J,Lingaraj S,Dolendro Singh N,etal.Strategies to deal with the concern about marker genes in transgenic plants:Some environment friendly approaches[J].Current Science,2002,83(2):128-136.
[14] 于玉红,王亮,黄晓露,等.6个多年生黑麦草品种的交播性状比较[J].草业科学,2009,26(8):172-176.
[15] Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco cultures[J].Plant Physiology,1962,15:473-497.
[16] 赵小强,马晖玲,林栋,等.草地早熟禾新格莱德胚性愈伤组织原生质体培养及植株再生的研究[J].草业学报,2010,19(2):55-60.
[17] 王彩芬,付永彩.甘露糖阳性选择系统在水稻遗传转化中的应用研究进展[J].中国稻米,2008(4):22-24.
[18] 彭世清,陈守才.甘露糖阳性选择系统的建立及在番茄转化中的应用[J].农业生物技术学报,2005,13(2):141-144.
[19] 姚明镜,李和平,廖玉才.甘露糖对小麦不同外植体愈伤诱导及生长的影响[J].麦类作物学报,2007,27(1):7-11.
[20] 吴杨,傅华英,赵书环,等.甘露糖对甘蔗外植体再生的影响[J].福建农林大学学报,2008,37(3):225-229.

