入侵杂草曼陀罗对作物化感机理的初步研究
程月琴,王红卫,段景勉,冯 菲,张 冰,何敏杰
(1.河南农业大学化学生态研究所,河南郑州450002;2.河南农业大学生命科学院,河南郑州450002)
曼陀罗(Datura stramonium L.)属于茄科曼陀罗属,原产墨西哥,现已入侵到中国多个省市[1,2],主要为害棉花、豆类、薯类、蔬菜等.经综合评价,徐海根等[3]把曼陀罗列入中国100种主要外来入侵物种名录.化感作用既是许多外来植物成功入侵的重要机制,也是这些入侵植物危害作物和生态环境的生理基础.曼陀罗根、茎和叶的水浸提液对蔬菜和作物的种子萌发、幼苗生长有显著的化感抑制作用[4],尤以曼陀罗叶水浸提液的影响最为强烈[5],但其作用机理尚不清楚.本研究拟从曼陀罗叶浸提液对油菜、辣椒和苋菜幼苗超氧化物歧化酶(SOD)、过氧化物酶(POD)活性、丙二醛(MDA)含量和根系活力的影响探讨其化感作用的机理.研究结果可对种植作物的选择、栽培管理和入侵杂草的综合治理提供一定的参考.
1 材料与方法
1.1 试验材料
曼陀罗(Datura stramonium L.)新鲜植株,油菜(Brassica campestris L.)、辣椒(Capsicum annuum L.)、苋菜(Amaranthus tricolor L.)种子.曼陀罗植株采于河南省郑州市北郊和森林公园,辣椒、苋菜和油菜种子购自河南省农业科学院.
1.2 试验方法
1.2.1 曼陀罗叶水浸提液的制取与配制 选取盛花期生长良好的曼陀罗植株叶片,把叶片分割成2 cm2的小块,称重后按0.4 g∶1 mL的比例加入蒸馏水,在26~28℃下浸泡24 h.4层纱布过滤后即获得0.4 g·mL-1曼陀罗叶水浸提母液,将此母液置于4℃的冰箱内冷藏,试验时取母液稀释成适宜质量浓度.
1.2.2 材料的处理和培养 选取饱满、大小一致的辣椒、苋菜和油菜种子各300粒,经0.02 mol·L-1KMnO4消毒漂洗后均匀散播于铺有2层滤纸的培养皿中,加入适量无菌水,置于28℃温箱中催芽萌发.
种子萌发后,采用培养皿滤纸法进行幼苗培养.每培养皿放入20粒萌发一致的种子,于25℃下光照培养.当幼苗生长到一定大小时,分别用适宜质量浓度浸提液处理.
1.2.3 曼陀罗叶水浸提液对作物幼苗MDA含量和SOD,POD活性的影响 为了探讨曼陀罗叶浸提液对作物膜脂及抗氧化保护酶系的影响,首先要确定合适的处理浓度及处理时间.曼陀罗浸提液对油菜幼苗生长的影响研究显示,0.2和 0.4 g·mL-1曼陀罗叶水浸提液对油菜幼苗茎的生长具有极强的抑制作用[4],若要在浸提液处理后有足够量的幼苗用于酶活性测定,须将曼陀罗叶浸提液浓度进一步稀释.经多次预备实验最终确定浸提液处 理 质 量 浓 度 分 别 为 0.01,0.03,0.05 和0.1 g·mL-1.
为找到检测酶活性和丙二醛浓度的适宜时间,在用0.05 g·mL-1曼陀罗浸提液处理幼苗后每天测定SOD,POD活性和MDA含量,根据检测结果确定浸提液处理植物幼苗的时间.SOD和POD活性,以及MDA浓度的测定方法均参照王学奎[6]的方法并加以改进.
1.2.4 曼陀罗叶水浸提液对作物幼苗根系活力的影响 经预备实验确定曼陀罗叶浸提液处理时间为 7 d,质量浓度为 0.05,0.08,0.2 g·mL-1,以蒸馏水作对照,重复3次.根系活力测定参照王学奎[6]的方法.
1.3 数据处理与分析
采用Excel制备图表,应用SPSS V13.0进行方差分析和显著性检验.
2 结果与分析
2.1 曼陀罗叶浸提液不同处理时间对油菜幼苗MDA浓度与SOD,POD活性的影响
0.05 g·mL-1曼陀罗叶浸提液对油菜SOD和POD活性的影响在第2天最为显著(图1-A,图1-B),而对MDA浓度的影响在第4天最显著(图1-C).因此在浸提液处理2 d时检测幼苗体内酶活性比较合适,而MDA浓度的检测则在4 d时比较适宜.苋菜和辣椒酶活性、MDA含量的检测时间参照油菜.
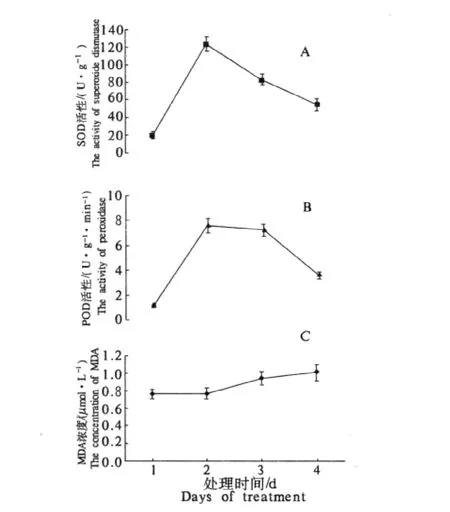
图1 曼陀罗叶浸提液处理后油菜幼苗SOD(A),POD(B)和MDA(C)含量变化Fig.1 Change of the content of superoxide dismutase(A),peroxidase(B)and malondialdehyde(C)after treatment with the aqueous extract from Datura stramonium leaf
2.2 曼陀罗叶浸提液对作物幼苗SOD,POD活性和MDA含量的影响
低质量浓度曼陀罗浸提液对作物幼苗SOD活性有一定的促进作用,高质量浓度则抑制SOD活性(图2).在0.01 和 0.03 g·mL-1曼陀罗浸提液处理时,油菜、辣椒和苋菜幼苗的SOD活性都高于对照,其中只有苋菜的活性提高达显著水平(P<0.05),分别为对照的 129.6% 和 146.7%.当质量浓度达到0.10 g·mL-1时,曼陀罗浸提液使3种受试植物幼苗SOD活性都显著低于对照(P<0.05),分别为对照的82%,84%和64%.

图2 曼陀罗浸提液对作物SOD活性的影响Fig.2 Effects of aqueous extracts from Datura stramonium on the activity of superoxide dismutase in three plant species

图3 曼陀罗浸提液对作物POD活性的影响Fig.3 Effects of aqueous extracts from Datura stramonium on the activity of peroxidase in three plant species
曼陀罗浸提液对作物POD活性的影响有的为促进,有的为抑制(图3).曼陀罗浸提液抑制了油菜幼苗POD活性,且随着处理液质量浓度的升高,抑制作用增强,与对照相比,抑制作用均达显著水平(P<0.05).与之相反,曼陀罗浸提液则促进了辣椒幼苗POD活性,且随着质量浓度的升高,促进作用增强,当质量浓度达到0.1 g·mL-1时,辣椒植株POD活性为对照的127.2%(P<0.05).和上述2种情况不同,低质量浓度(0.01 ~0.05 g·mL-1)曼陀罗浸提液促进了苋菜幼苗POD活性,分别为对照的 207.1%,235.7% 和 214.3%,影响达到显著水平(P<0.05),但当曼陀罗浸提液质量浓度升高到0.1 g·mL-1时,这种促进作用消失,苋菜幼苗POD活性回复到对照水平.
曼陀罗浸提液处理提高了3种作物幼苗MDA的含量(图4).与对照相比,低质量浓度(0.01~0.05 g·mL-1)曼陀罗浸提液处理下,油菜和苋菜植株内MDA含量虽有所增加,但都不显著,只有辣椒幼苗MDA含量在0.03和0.05 g·mL-1浸提液处理时显著高于对照(P<0.05),分别为对照的246.9%和 477.2%.而高质量浓度(0.1 g·mL-1)曼陀罗浸提液处理使得油菜、辣椒和苋菜幼苗MDA含量显著升高,分别为对照的 121.2%,487.8%和 130.2%(P <0.05).
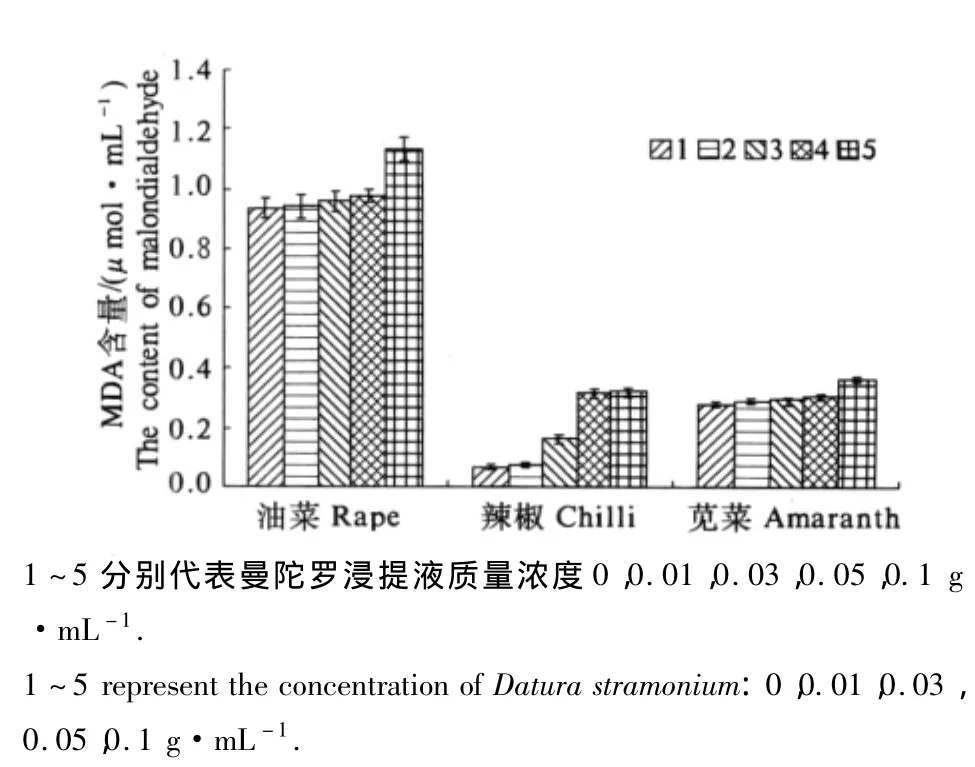
图4 曼陀罗浸提液对作物幼苗MDA含量的影响Fig.4 Effects of aqueous extracts from Datura stramonium on the content of malondialdehyde in three plant species
2.3 曼陀罗浸提液对作物幼苗根系活力的影响
曼陀罗浸提液对作物幼苗根系活力的影响因物种的不同而有很大的差异.无论是低浓度还是高浓度,曼陀罗浸提液都极显著地降低了油菜幼苗根系的活力(P < 0.01),0.05,0.08,0.2 g·mL-1质量浓度的曼陀罗浸提液处理下,油菜根系活力分别只有对照的 20.4%,6.2%和 8.2%(图 5).与上述情况不同,低质量浓度(0.05 g·mL-1)的曼陀罗叶浸提液处理则显著地提高了苋菜和辣椒根系的活力,其活力分别为对照的267.2%和144.0%.随着处理质量浓度的升高,根系活力降低,在较高质量浓度(0.2 g·mL-1)曼陀罗浸提液处理下,苋菜根系活力只有对照的54.3%(P<0.05),而辣椒幼苗的根系活力仍高于对照,为其117.9%.上述结果表明,油菜幼苗根系对曼陀罗叶浸提液最敏感,其活力受到浸提液的显著抑制,其次是苋菜,受影响较小的为辣椒.
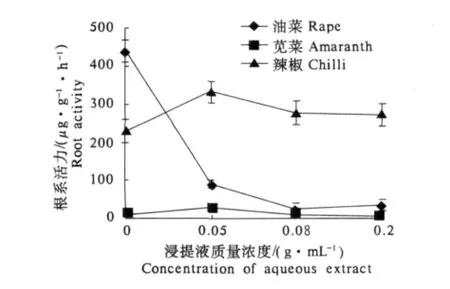
图5 曼陀罗叶水浸提液对油菜、苋菜和辣椒幼苗根系活力的影响Fig.5 Effects of aqueous extracts from Datura stramonium on root activity of Brassica campestris,Amaranthus tricolor and Capsicum annuum
3 讨论
3.1 化感作用下的膜脂过氧化和保护酶活性的变化
植物在逆境条件下的膜脂过氧化反应和保护酶系统包括超氧化物歧化酶、过氧化物酶、过氧化氢酶(CAT)和抗坏血酸氧化酶(APX)等的活性变化已广泛用于植物对逆境反应机理的研究.1975年FRIDOVICH[7]提出生物自由基伤害学说,认为植物体内自由基大量产生会引发膜脂过氧化作用,造成细胞膜系统破坏,严重时导致植物细胞死亡.植物细胞中存在着能清除活性氧自由基的保护酶系,如SOD,POD,CAT等,它们的协调作用能有效地清除OH-,H2O2等自由基,防御着膜脂过氧化,从而使细胞膜免受其伤害.
在化感物质的作用下,不同受体植物的SOD和POD活性表现出了不同的变化趋势.羟基苯甲酸、香草酸和香豆酸能促进花生幼苗SOD和POD的活性,并且随化感物质浓度的升高强度增加[8],而黄顶菊茎叶浸提液却抑制了白菜和水稻幼苗SOD和POD的活性,且随处理液浓度的升高抑制作用增强[9].更多的研究则表明,低浓度化感物质可提高SOD活性,高浓度则抑制SOD活性,如使用低浓度黄瓜地上部分水浸提液处理时,番茄幼苗叶片SOD活性升高,而当处理液浓度提高时,SOD活性受到抑制[10].在低浓度反枝苋水浸提液处理下,黄瓜根尖中SOD活性升高,但随着处理液浓度升高,根尖SOD活性持续下降[11].本研究也得出类似的结论,0.01 g·mL-1曼陀罗水浸提液使油菜、辣椒和苋菜幼苗体内SOD活性表现出增高,尤其是苋菜,其SOD活性是对照的1.3倍.当质量浓度增加到0.1 g·mL-1时,表现出对油菜、辣椒和苋菜幼苗SOD活性的显著抑制作用.至于曼陀罗浸提液化感作用下作物幼苗体内POD活性变化,存在3种情况:抑制、促进和低促高平.油菜幼苗POD活性受到曼陀罗浸提液的显著抑制,而辣椒则表现为显著促进,苋菜幼苗POD则表现为低促高平,即低质量浓度下幼苗POD升高,高质量浓度下则回复到对照水平.本研究结果表明,不同植物体内SOD和POD活性对同一植物浸提液的敏感程度不同,变化的趋势也可能截然相反,所以在探讨化感机理时应考虑到物种的差异.
丙二醛含量高低也可作为植物在逆境胁迫下活性氧伤害程度大小的指标,同时,MDA本身也是一种有害物质,它能强烈地与细胞内各种成分发生反应,引起酶和膜的严重损伤,膜电阻及膜的流动性降低,最终导致膜结构及生理完整性的破坏[12].大多数的研究表明,化感作用下,受体植物体内的MDA含量都有所增加,区别在于增加的幅度大小不同[8,10,13,14].草木犀、披碱草和羊草幼苗在低浓度冷蒿水浸提液处理下,MDA含量虽有增加,但都不显著.当冷蒿茎叶水浸提液浓度增加到一定程度时,3种牧草幼苗膜脂过氧化显著增加[13].黄顶菊茎叶浸提液作用下的白菜和反枝苋水浸提液处理下的黄瓜幼苗表现出了相同的情况[9,11].低质量浓度曼陀罗浸提液处理下,油菜和苋菜植株内MDA含量虽有所增加,但都不显著.而当质量浓度达到0.1 g·mL-1时,油菜、辣椒和苋菜 MDA含量都比对照显著提高.因此,在生产实践中为了减小化感危害,应考虑提高作物膜脂抗氧化的能力,如选择抗性品种等.
3.2 化感作用下的根系活力变化
绝大多数的化感研究表明植物根系活力易受化感物质的抑制作用.例如,在低浓度下,银胶菊叶片水浸提液乙酸乙酯相对苘麻和稗根系活力有一定程度的抑制作用[15].一系列浓度的黄顶菊茎叶水浸提液处理白菜植株,其根系活力极显著低于对照[9].低质量浓度冷蒿茎叶水浸提液对草木犀、披碱草、冰草和羊草根系活力没有明显影响,当浓度增加到较高水平时,对4种牧草根系活力抑制作用呈极显著水平[13].本研究也显示,0.05,0.08,0.2 g·mL-1质量浓度的曼陀罗浸提液同样极显著地抑制了油菜根系活力,其根系活力分别仅有对照的20.4%,6.2%和8.2%(图5).和上述结果不同,也有个别物种根系活力不受试验浓度化感物质的影响,如在黄顶菊浸提液3种浓度处理下水稻根系活力与对照基本相同[9].本研究则出现了另一种结果,低质量浓度曼陀罗叶片浸提液(0.05 g·mL-1)显著促进了苋菜和辣椒植株根系活力,随着处理浓度的提高,根系活力下降,质量浓度达到0.2 g·mL-1时苋菜根系活力反而受到了显著抑制(图5).这可能是因为低质量浓度曼陀罗浸提液弱胁迫刺激了苋菜幼苗的抗性,根系活力提高,当质量浓度达到一定程度时,胁迫加强,对植株根系造成了伤害,反而使其活力下降.
曼陀罗浸提液处理下,3种栽培植物根系活力与幼苗根长变化相一致.0.2 g·mL-1曼陀罗叶浸提液处理下,油菜根系活力受抑制最严重,其活力仅有对照的8.2%,与之相对应,幼苗根长同样受抑制最显著,根长只有对照的24%[5].相同质量浓度浸提液处理,苋菜根系活力也受到了抑制,但程度弱于油菜,其根系活力为对照的54.3%,苋菜幼苗根长的受抑程度也弱于油菜,根长为对照的29%[5].辣椒幼苗根系活力在实验浓度处理下比对照反而稍微的升高,其幼苗根长的减少也最小,为对照的77%.
[1] 徐海根,强 胜.中国外来入侵物种编目[M].北京:中国环境科学出版社,2004.
[2] 田朝阳,李景照,徐景文,等.河南外来入侵植物及防除研究[J].河南农业科学,2005(1):31-34.
[3] 徐海根,王建民,强 胜,等.外来物种入侵——生物安全遗传资源[M].北京:科学出版社,2004.
[4] 王红卫,程月琴,余 慧.曼陀罗浸提液对蔬菜种子萌发和幼苗生长的影响[J].安徽农业科学,2008,36(35):15318-15320.
[5] 王红卫,程月琴,袁小巨,等.曼陀罗植株不同部位浸提液化感作用的比较研究[J].中国农学通报,2009,25(13):99-102.
[6] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[7] FRIDOVICH I.Superoxide dismutases[J].Annual Review of Biochemistry,1975,44:147-159.
[8] 李培栋,王兴祥,李奕林,等.连作花生土壤中酚酸类物质的检测及其对花生的化感作用[J].生态学报,2010,30(2):2128-2134.
[9] 张风娟,徐兴友,陈凤敏,等.黄顶菊茎叶浸提液对白菜和水稻幼苗化感作用的初步研究[J].西北植物学报,2008,28(8):1669-1674.
[10]刘建新,胡浩斌,王 鑫.黄瓜地上部分水浸提液对番茄的化感抑制效应[J].中国生态农业学报,2009,17(2):312-317.
[11]刘 爽,张 红,马丹炜,等.反枝苋水浸提液与挥发油对黄瓜根尖的影响[J].西北植物学报,2010,30(3):569-574.
[12] SCANDALIOS J G.Oxygen stress and superoxide dismutase[J].Plant Physiology,1993,101:7-12.
[13]张汝民,王玉芝,侯 平,等.几种牧草幼苗对冷蒿茎叶水浸提液化感作用的生理响应[J].生态学报,2010,30(8):2197-2204.
[14]赵清贺,吴 军,苏金乐,等.氯化钙和蔗糖对低温处理下香樟膜脂过氧化和保护酶系统变化的影响[J].河南农业大学学报,2009,43(3),264-268.
[15]陈业兵,王金信,彭学岗,等.银胶菊叶对苘麻和稗的化感作用[J].植物保护学报,2009,36(1):77-81.
——以渤海S油田为例

