帕金森病的脑部葡萄糖代谢特征分析
史新冲陈玲张祥松易畅王晓燕陈志丰
·论 著·
帕金森病的脑部葡萄糖代谢特征分析
史新冲*陈玲△张祥松*易畅*王晓燕*陈志丰*
目的 观察帕金森病(Parkinson’s disease,PD)的18F-脱氧葡萄糖(18F-labeled 2-deoxyglucose,18FFDG)正电子发射断层成像(positron emission tomography,PET/CT)显像特征,并分析利用其代谢变化特点进行辅助诊断的方法。 方法 收集经临床确诊的PD患者15例,对其分别进行18F-FDG PET/CT显像;利用SPM分析软件分析PD患者组的代谢模式,并统计各位患者各自的代谢改变特点。健康对照组10名,分析方法同患者组。结果 与对照组相比,PD组表现为豆状核、脑干、小脑的相对高代谢,以及额叶运动前区及顶叶的相对低代谢 (P<0.01)。对个体数据分析发现:15例患者中13位表现为小脑相对高代谢,8例表现为脑干相对高代谢,8例表现为壳核相对高代谢,10例表现为苍白球相对高代谢,以上区域均为观察到相对低代谢表现 (P<0.01);同时12例表现为顶叶相对低代谢改变,11例表现为运动前区相对低代谢改变 (P<0.01),上述两个区域均未观察到相对高代谢改变。结论 与正常人群相比,帕金森患者脑部代谢改变主要表现为小脑、纹状体区代谢相对增高,同时伴有顶叶和运动前区代谢相对减低。
帕金森病 代谢网络 PET/CT 18F-FDG SPM
帕金森病(Parkinson’s Disease,PD)是一种常见的脑退行性病变,在临床上,主要以静息性震颤、肢体僵硬和运动迟缓为主要症状。但以上症状并不具有特异性,多系统萎缩、核上性麻痹等疾病均可有相似表现。临床医生通常需对病人进行长期随访以做出最终诊断。随着脑深部电刺激 (deep brain stimulation,DBS)等手术治疗方法的疗效被逐渐认可[1],晚期PD患者或者药物治疗效果不理想的PD患者有了新的治疗途径,但正确的诊断是手术治疗的前提。在先进的PET影像技术的基础上,针对多巴胺神经递质系统的受体显像剂逐渐问世,包括多巴胺运转蛋白显像剂、多巴胺受体显像剂等,它们为PD的准确诊断和鉴别诊断提供了新的方法[2]。但这些新型显像剂的化学合成方法仍不够成熟,在国内的应用非常有限。而18F-FDG作为最成熟的PET显像剂,为帕金森病患者大脑代谢改变等方面的研究提供了非常有价值的信息,但其在个体诊断中的应用价值仍有待进一步探索[3]。本研究利用临床确诊的PD患者15例,对其18F-FDG PET显像结果进行分析,以探讨18F-FDG PET显像在PD诊断中的应用。
1 资料与方法
1.1 研究对象 收集经临床确诊的PD患者15例 (男8例,女7例),年龄42~84岁,平均61±23岁,标准差为11.02;病程0.5~10年,平均4.9年,标准差为3.55;临床诊断严格按照英国帕金森协会脑库诊断标准 (UK PD Brain Bank criteria)进行[4]。健康对照组共10名(男4名,女6名),年龄47~77岁,平均(64.1±17.1)岁,标准差为8.70。根据受试者既往史,相应临床检查和影像学检查排除脑部疾病。本研究同时利用了我中心健康人群脑代谢数据库,其中共有58名健康人群脑代谢数据(男34名,女24名),年龄40~85岁,平均65岁;数据库入选条件同本研究中的健康对照组。
1.2 PET/CT显像 显像设备为 Philips Gemini GXL 16型PET/CT扫描仪。15例帕金森患者显像前禁食至少6 h,禁用抗帕金森类药物至少12 h。所有受试者注射显像剂前30 min于安静、无强光刺激的房间平卧。18F-FDG注射剂量为0.14 mCi/Kg,注射后45 min进行显像,以3D方式采集10 min,经LOR-Ramla算法重建为2 mm×2 mm×2 mm的图像。
1.3 图像处理与分析 18F-FDG显像分析:应用SPM5分析软件,将所有受试者脑数据用12参数的线性仿射变换和非线性迭代法,对应到标准脑空间坐标上[5];用 8 mm×8 mm×8 mm的高斯算子进行平滑,以去除图像噪声。经过以上预处理后,利用SPM分析软件对帕金森组和健康对照组(对照组1)进行组间分析,分析采用双样本t检验,检验水平为P<0.01(T=2.50),检验结果利用mroMRI软件叠加到标准脑MRI T1加权图像上,以得到帕金森病相关的脑代谢模式图。

图1 PD患者组的脑代谢改变模式图。其中红色表示代谢明显增高的区域;蓝色表示代谢明显减低的区域。检验水平为P<0.01,T=2.50
为研究18F-FDG PET显像在个体患者诊断中的应用,我们从健康人群数据库中为每位患者挑选年龄差不超过5岁的10位健康对照者(对照组2),然后将其与该患者数据进行双样本T检验,检验水平为P<0.01(T=2.82)。为了验证处理结果的可靠性,我们同时对健康对照组中的10位对照者数据(对照组1)进行上述处理。以上检验结果均利用mroMRI软件叠加到标准脑MRI T1加权图像上,以确定代谢变化的具体位置和范围。在P<0.01的检验水平下,代谢减低的部位用蓝色表示,代谢增高的部位用红色标记,然后统计15位PD患者和10位健康对照者(对照组1)额叶相关运动区、顶叶、脑干、纹状体、丘脑和小脑的代谢改变情况。
2 结果
2.1 组间分析结果 与健康对照组相比,PD组表现为明显的小脑、脑干和基底节区相对高代谢,以及额叶相关运动区、顶叶的相对低代谢(见图1)。
2.2 个体数据分析结果 10例健康对照者均未观察到明显的代谢异常区域。而15例PD患者中,13例表现为小脑相对高代谢改变,另2例未见明显异常;8例表现为脑干相对高代谢改变,另7例未见明显异常;8例表现为壳核相对高代谢改变,另7例未见明显异常;10例表现为苍白球区相对高代谢改变,另5例未见明显异常;5例表现为丘脑相对高代谢改变,2例表现为相对低代谢改变,另8例未见明显异常;5例表现为尾状核相对低代谢改变,另10例未见明显异常;12例表现为顶叶相对低代谢改变,另3例未见明显异常;11例表现为运动前区相对低代谢代表,另4例未见明显异常;3例表现为辅助运动前相对低代谢改变,另12例未见明显异常。(具体数据见表1)
3 讨论
PD的临床表现具有多样性[6],临床上有时与帕金森综合症、帕金森叠加综合症难以鉴别。利用SPM分析技术和SSM分析技术发现:PD患者的脑代谢有着特定的改变模式[3],表现为豆状核、丘脑、脑干和小脑高代谢,以及顶叶、额叶相关运动皮层的低代谢,这种特定的脑代谢模式的可重复性及稳定性已经得到证实[7-8]。但该网络目前仅广泛应用于病情评估、疗效评价和发病机制研究等方面,在个体病情诊断和鉴别诊断方面的应用尚有争议。本研究在我中心健康人群数据库的基础上,为每位患者挑选性别匹配、年龄差别小于5岁的健康对照组,以此分析每位患者的脑代谢变化。
在本研究中,我们观察到12位患者均表现为不同范围的顶叶相对低代谢表现,占所有患者的80%;有11位患者表现为运动前区的相对低代谢表现,占所有患者的73.3%;双侧改变大致对称。这一结果提示上述两个区域的低代谢在PD患者中是普遍存在的。定量分析结果也表明:PD患者上述区域的血流量和局部葡萄糖代谢率均出现了明显的下降[9-10];在伴有认知能力下降的患者和痴呆患者,其顶叶的代谢降低尤为明显[11-13]。但除了 PD外,进行性核上性麻痹(progressive supranuclear palsy,PSP)、多系统萎缩 (multiple system atrophy,MSA)和皮层基底节病变(corticobasal degeneration,CBGD)也均有上述区域代谢减低的报导[14],但皮层基底节病变有明显的不对称性特点 ,皮层代谢减低也表现为明显的不对称性[15],与本研究所观察到得双侧大致对称改变有所不同。
David Eidelberg等[16-17]通过对 PD患者进行研究,揭示了PD患者内部苍白球的放电频率与同侧内部苍白球18F-FDG摄取的相关性,并进一步发现了与内部苍白球放电频率相关的局部代谢网络:表现为壳核、苍白球、丘脑和脑干的高代谢。但定量分析的结果却同时存在着豆状核和丘脑代谢增高和无明显变化的报道[18-19],因此该部位代谢是否存在变化尚存在争议。而SPM所得到的上述区域的高代谢也多被认为是由于对数据的预处理所造成的[20-21]。
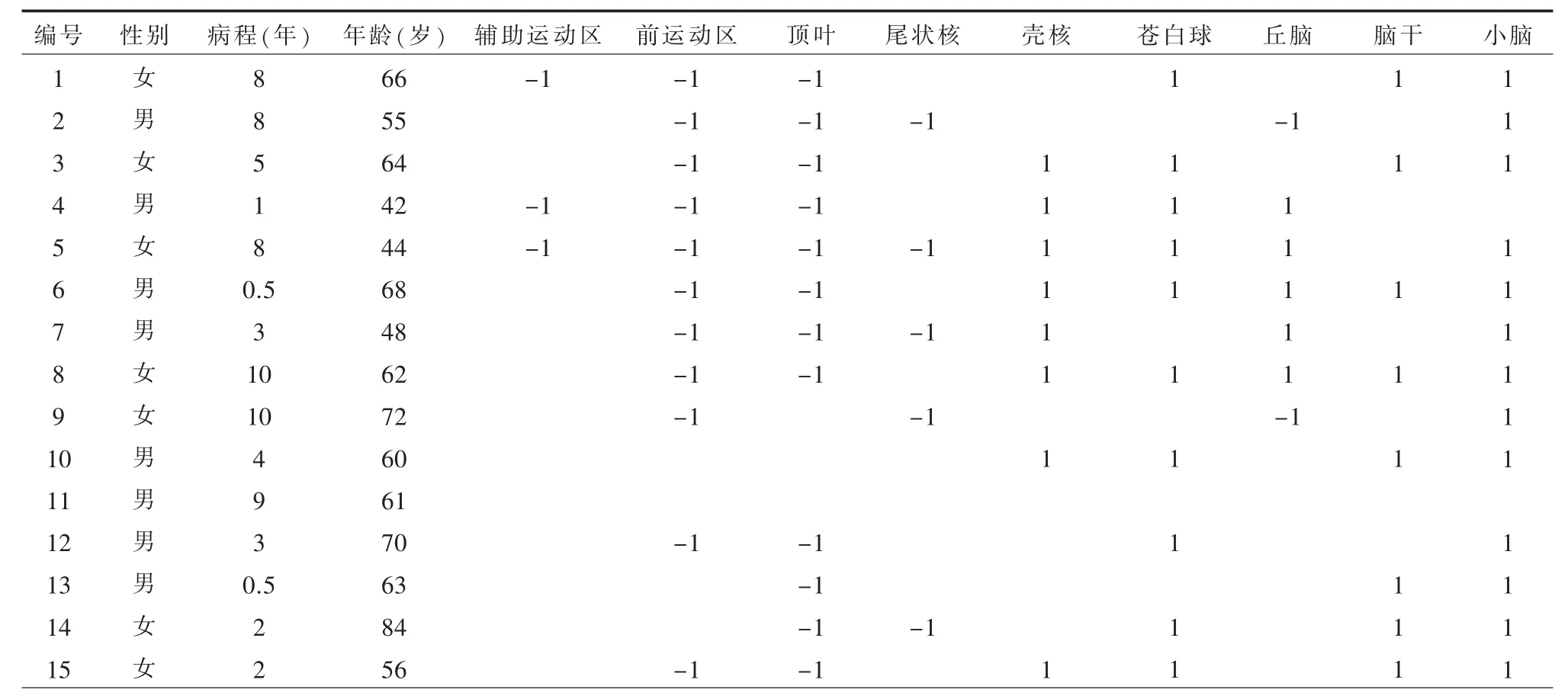
表1 15位患者的脑代谢改变统计表
在本研究中,8例患者表现为壳核的相对高代谢表现,占所有患者的53.3%;8例患者表现为脑干的相对高代谢表现,占所有患者的53.3%;10例患者表现为苍白球区的相对高代谢表现,占所有患者的66.7%。以上区域均未观察到相对低代谢改变,这一结果与国外利用SPM和SSM技术对PD的研究是相一致的,也与豆状核和脑干并未病变受损这一病理事实相吻合。临床上,与原发性PD最难以鉴别的纹状体黑质变性(Striatonigral degeneration,SND)则主要表现为壳核和苍白球病变,并在SPM处理结果上出现相应部位明显的代谢相对减低[22-23],因此易于和原发性PD鉴别。
虽然小脑在13例显像中观察到明显的相对高代谢,未观察到代谢减低的表现。但与基底节情况一样,定量分析的结果并不支持小脑代谢有明显变化的结论[18,24]。并且在对核上性麻痹、皮层基底节病变等疾病的研究中也发现了小脑的相对高代谢[25],但小脑的低代谢表现对于判断小脑病变非常有帮助,例如小脑-脑桥-橄榄型多系统萎缩(olivopontocerebellar atrophy,OPCA)病变通常会累及到小脑,可以观察到该部位明显的低代谢改变[23],易于和PD鉴别。
在本研究中,我们在国内首次运用大样本健康人群数据库,对个体PD患者进行脑代谢特征分析,探讨个体患者的脑代谢改变特点。分析结果表明,PD患者脑代谢改变以小脑、脑干和纹状体相对高代谢,同时伴有顶叶、运动前区相对低代谢改变为特征。利用SPM分析技术检测该变化特征对帕金森病的诊断和鉴别诊断具有一定的参考价值。
[1]Altug F,Acar F,Acar G,et al.The influence of subthalamic nucleus deep brain stimulation on physical,emotional,cognitive functions and daily living activities in patients with Parkinson's disease[J].Turk Neurosurg,2011,21(2):140-146.
[2]Nicola Pavese,David JB.Imaging neurodegeneration in Parkinson's disease[J].Biochimica et Biophysica Acta,2009,1792(7):722-729.
[3]Eidelberg D,Moeller JR,Dhawan V,et al.The metabolic topography of parkinsonism[J].J Cereb Blood Flow Metab,1994,14(5):783-801.
[4]Hughes AJ,Daniel SE,Kilford L,et al.Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinico-pathological study of 100 cases[J].J Neurol Neurosurg Psychiatry,1992,55(5):181-184.
[5] 张祥松,宋明.Wilson病脑局部葡萄糖代谢变化的18F-FDG PET研究[J].中华核医学杂志,2008,28(5):333-335.
[6]Langston JW.The Parkinson's complex:parkinsonism is just the tip of the iceberg[J].Ann.Neurol,2006,59(4):591-596.
[7]Ma Y.Abnormal metabolic network activity in Parkinson’s disease:test-retest reproducibility[J].J.Cereb.Blood Flow Metab,2007,27(3):597-605.
[8]Moeller JR,Nakamura T,Mentis MJ,et al.Reproducibility of regional metabolic covariance patterns:comparison of four populations[J].J Nucl Med,1999,40(8):1264-1269.
[9]Eberling JL,Richardson BC,Reed BR,et al.Cortical glucose metabolism in Parkinson’s disease without dementia[J].Neurobiol Aging,1994,15(3):329-335.
[10]Kikuchi A,Takeda A,Kimpara T,Nakagawa M,et al.Hypoperfusion in the supplementary motor area,dorsolateral prefrontal cortex and insular cortex in Parkinson’s disease[J].J Neurol Sci,2001,193(1):29-36.
[11]Peppard RF, Martin WR, Carr GD, et al.Cerebral glucose metabolism in Parkinson’s disease with and without dementia[J].Arch Neurol,1992,49(12):1262-1268.
[12]Sasaki M,Ichiya Y,Hosokawa S,et al.Regional cerebral glucose metabolism in patients with Parkinson’s disease with or without dementia[J].Ann Nucl Med,1992,6(4):241-246.
[13]Firbank MJ, Colloby SJ, Burn DJ, et al.Regional cerebral blood flow in Parkinson’s disease with and without dementia[J].Neuroimage,2003,20(2):1309-1319.
[14]David Eidelberg.Metabolic brain networks in neurodegenerative disorders:a functional imaging approach[J].Trends Neurosci,2009,32(10):548-57.
[15]Przedborski S,Giladi N,Takikawa S,et al.Metabolic topography of the hemiparkinsonism-hemiatrophy syndrome[J].Neurology,1994,44(9):1622-1628.
[16]David Eidelberg,James R.Moeller,Ken Kazumata.Metabolic correlates of pallidal neuronal activity in Parkinson’s disease[J].Brain,1997,120(Pt8):1315-1324.
[17]Feigin A,Fukuda M,Dhawan V.Metabolic correlates of levodopa response in Parkinson’s disease[J]. NEUROLOGY,2001,57(11):2083-2088.
[18]Berding G,Odin P,Brooks DJ,et al.Resting regional cerebral glucose metabolism in advanced Parkinson’s disease studied in the off and on conditions with[(18)F]FDG-PET[J].Mov Disord,2001,16(6):1014-1022.
[19]Mohr E,Mann UM,Miletich RS,et al.Neuropsychological and glucose metabolic profiles in asymmetric Parkinson's disease[J].Can J Neurol Sci,1992,19(2):163-169.
[20]Borghammer P,Cumming P,Aanerud J,et al.Subcortical elevation of metabolism in Parkinson’s disease-acritical reappraisal in the context of global mean normalization[J].Neuroimage,2009b,47(4):1514-1521.
[21]Per B,Mallar C.Cortical hypometabolism and hypoperfusion in Parkinson’s disease is extensive:probably even at early disease stages[J].Brain Struct Funct,2010,214(4):303-317.
[22]Otsuka M,Ichiya Y,Kuwabara Y,et al.Glucose metabolism inthe cortical and subcortical brain structures in multiple system atrophy and Parkinson’s disease:a positron emission tomographic study[J].J Neurol Sci,1996,144(1-2):77-83.
[23]Perani D,Bressi S,Testa D,et al.Clinical metabolic correlations in multiple system atrophy:a fludeoxyglucose F18 positron emission tomographic study[J].Arch Neurol,1995,52(2):179-185.
[24]Borghammer P,Cumming P,Aanerud J,et al.Artefactual subcortical hyperperfusion in PET studies normalized to global mean:lessons from Parkinson’s disease[J].Neuroimage,2009c,45(2):249-257.
[25]Thomas E,Christine E.The application of network mapping in differential diagnosis of parkinsonian disorders[J].Clinical Neuroscience Research,2007,6(6):359-366.
(责任编辑:李 立)
R742.5
A
2010-09-01)
* 中山大学附属第一医院核医学科(广州510080)
△ 中山大学附属第一医院神经科

