多巴胺D1受体激动剂SKF38393对剥夺血清条件下PC12细胞的保护作用☆
王雪汪海涛任艳囡郑文华
·论 著·
多巴胺D1受体激动剂SKF38393对剥夺血清条件下PC12细胞的保护作用☆
王雪*汪海涛*任艳囡*郑文华*
目的 研究多巴胺D1受体激动剂SKF38393对剥夺血清所致PC12细胞损伤的神经保护作用及其与磷脂酰肌醇-3激酶/蛋白激酶B(phosphatidylinositol 3-kinases/protein kinase B,PI3K/Akt)、细胞外调节蛋白激酶(extracellular signal-regulated kinases,ERK)信号通路的关系。方法 将PC12细胞分为血清剥夺模型组、血清剥夺后加不同剂量SKF38393处理组(1 μmoL、3 μmoL、10 μmoL、30 μmoL和100 μmoL)及1%胎牛血清对照组,比较各组PC12细胞活性;PC12细胞分别加入不同剂量(同上)SKF38393处理40 min,以及以10 μmoL SKF38393处理不同时间(5~80 min),然后检测PC12细胞的Akt473及ERK1/2的磷酸化水平;PC12细胞分别加入PI3K/Akt信号通路抑制剂LY294002(50 μmoL)、ERK信号通路抑制剂PD98059(50 μmoL)或PD169316(10 μmoL),后再行SKF38393干预,比较各组PC12细胞活性。结果 与剥夺血清组比较,10 μmoL SKF38393即可显著增加PC12细胞的活性[(0.58±0.02)vs(0.37±0.01)],并且随着其剂量(30 μmoL、100 μmoL)的增加PC12细胞活性的增加可更明显[(0.62±0.01)、(0.65±0.02)],上述差异均有统计学意义(P<0.05)。不同剂量SKF38393和不同时间的SKF38393处理PC12细胞后磷酸化的Akt和ERK的表达水平均明显高于剥夺血清组 (P<0.05)。与SKF38393组的PC12细胞活性(0.59±0.01)比较,PD169316组细胞活性(0.41±0.14)无明显差异(P>0.05),但LY294002组 (0.33±0.01)和PD98059(0.33±0.03)组细胞活性均更低 (P<0.05),提示仅后二者可阻断SKF38393对PC12细胞损伤的保护作用。结论 SKF38393能保护剥夺血清所致的PC12细胞损伤,其保护作用可能与激活PI3K/Akt和ERK信号通路有关。
PC12细胞 多巴胺D1受体激动剂 SKF38393 磷脂酰肌醇-3激酶/蛋白激酶B 细胞外调节蛋白激酶
中脑黑质多巴胺(Dopamine,DA)能神经元缺失导致帕金森氏病(parkinson’s diseases,PD)临床症状的产生[1-2],而越来越多的研究证明DA神经元缺失发生的根本原因是多巴胺神经元进行性凋亡[3]。目前临床中使用多巴胺受体激动剂治疗PD有效,但其作用机制仍不清楚。近年研究提示多巴胺受体激动剂除具有激动多巴胺受体的作用外,还可能具有神经保护作用[4]。蛋白激酶B(protein kinase B,PKB/Akt)和细胞外调节蛋白激酶(Extracellular signal-regulated kinases,ERK)信号通路是细胞内重要的促存活信号通路,Akt及ERK磷酸化水平的增加可对抗神经元凋亡并促进神经元存活[5]。那么,多巴胺受体激动剂是否可对抗细胞凋亡?而且其作用机制是否与Akt及ERK信号通路相关?目前尚未见报道,但上述问题的探讨具有明显的临床意义。本研究以PC12细胞建立细胞凋亡模型,并考察D1受体激动剂SKF38393是否具有神经保护作用及其作用的可能的信号转导通路。
1 材料与方法
1.1 PC12细胞的培养 PC12细胞由加拿大McGill大学Douglas Institute Dr.Remi Quirion惠赠,胎牛血清(fetal bovine serum,FBS)、马血清、抗生素和Dulbecco改良Eagle培养基(dulbecco's modified eagle medium,DMEM)均购自英韦创津公司(GIBCO)。以含5%FBS、5%马血清和0.2%抗生素的DMEM培养基于37℃、5%CO2的细胞培养箱中常规培养PC12细胞;细胞为上皮样贴壁生长,每2 d~3 d传代1次,取对数生长期细胞用于实验。细胞处理前24 h以含1%胎牛血清的DMEM接种于多聚赖氨酸包被过的细胞培养板。
1.2 PC12细胞分组及细胞处理
1.2.1 SKF38393对细胞活性的影响 PC12细胞分为:①血清剥夺模型组:剥夺培养基中胎牛血清及马血清,造成PC12细胞损伤;②5个SKF38393处理组:不含血清但含有不同浓度的SKF38393(1 μmoL、3 μmoL、10 μmoL、30 μmoL、100 μmoL);③1%FBS对照组。每组细胞设置 5个复孔,SKF38393处理 24 h后测定细胞活性,考察SKF38393对血清剥夺细胞损伤的保护作用。
1.2.2 SKF38393对Akt及ERK信号通路影响的量效及时效关系 考察SKF38393对Akt及ERK信号通路影响的量效关系时,PC12细胞分为加入不同剂量SKF38393(1 μmoL~100 μmoL)组和不加入SKF38393处理组,处理40 min后检测Akt473及ERK1/2的磷酸化水平。考察SKF38393对Akt及ERK信号通路影响的时效关系时,PC12细胞分为加入10 μmoL SKF38393不同时间处理组和不加SKF38393对照组,处理组的时间分别为0 min~80 min。处理结束后检测Akt及ERK的磷酸化水平。
1.2.3 PI3K/Akt及 ERK1/2信号通路抑制剂对SKF38393保护作用的影响 PC12细胞分为剥夺血清组、SKF38393(30 μmoL)组、PI3K/Akt抑制剂LY294002(50 μmoL)加SKF38393(30 μmoL)处理组、ERK抑制剂PD98059(50 μmoL)加SKF38393(30 μM)处理组、1%FBS对照组。每组细胞设置5个复孔,处理结束后检测细胞活性,考察SKF38393作用的信号通路。SKF38393、LY294002、PD98059、PD169316均购自美国的Sigma-Aldrich公司。
1.3 PC12细胞活性的检测 采用四甲基偶氮唑盐比色法(methylthiazolyldiphenyl-tetrazolium bromide,MTT)。将接种于96孔细胞培养板的PC12细胞抽去上清液,每孔加入100 μL MTT溶液(0.5 mg/mL)继续培养3 h,抽去上清液后于每孔加入100 μL二甲基亚砜振摇20 min,酶标仪检测490 nm处的吸光度。细胞活性以490 nm处吸光度值表示。
1.4 Akt及ERK磷酸化水平的检测 采用Western blot法,重复检测3次。将收集的PC12细胞进行蛋白定量后,等量蛋白的样品(50 μg)上样,进行10%十二烷基磺酸钠-聚丙烯酰胺电泳,电泳结束后100 V电压转印90 min,5%脱脂奶粉 TBST溶液室温封闭1 h。TBST清洗后加入1∶1000比例稀释的一抗:磷酸化的ERK1/2抗体、磷酸化的Akt抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(均购自美国的Santa Cruz公司),4℃孵育过夜。洗膜后加入1∶5000比例稀释的辣根过氧化物酶标记的二抗,室温孵育1 h后洗膜。经化学荧光试剂显影 (Paul),在暗室中用X光胶片压片成像。扫描胶片后应用Image-J进行条带灰度分析,以p-Akt及p-ERK1/2条带灰度值与GAPDH条带灰度值比值表示各组PC12细胞中p-Akt及p-ERK1/2的表达水平。
1.5 统计学分析 应用SPSS 13.0软件进行统计分析,多组间比较采用单因素方差分析,两两多重比较采用最小显著差值法 (least significant different,LSD)。检验水准α=0.05,双侧检验。
2 结果
2.1 SKF38393对细胞活性的影响 剥夺血清模型组、不同剂量SKF38393组与1%FBS对照组之间的吸光度值差异有统计学意义 (F=107.41,P<0.05)。两两比较显示,剥夺血清模型组明显低于1%FBS组(P<0.05),而3 μmoL、10 μmoL、30 μmoL和100 μmoL SKF38393处理后各组的吸光度值均明显高于剥夺血清组(P<0.05)。
2.2 SKF38393对PC12细胞胞内Akt、ERK磷酸化的影响 5个不同时间的SKF38393处理组与不加SKF38393的对照组之间Akt和ERK磷酸化水平的差异均有统计学意义(F=21.83,P<0.05;F=93.10,P<0.05)。与对照组比较,10 μmoL的SKF38393处理10 min、20 min、40 min、80 min可以明显增加Akt和ERK的磷酸化水平(P<0.05)。见表2。

表1 不同剂量SKF38393对剥夺血清后PC12细胞活性的影响
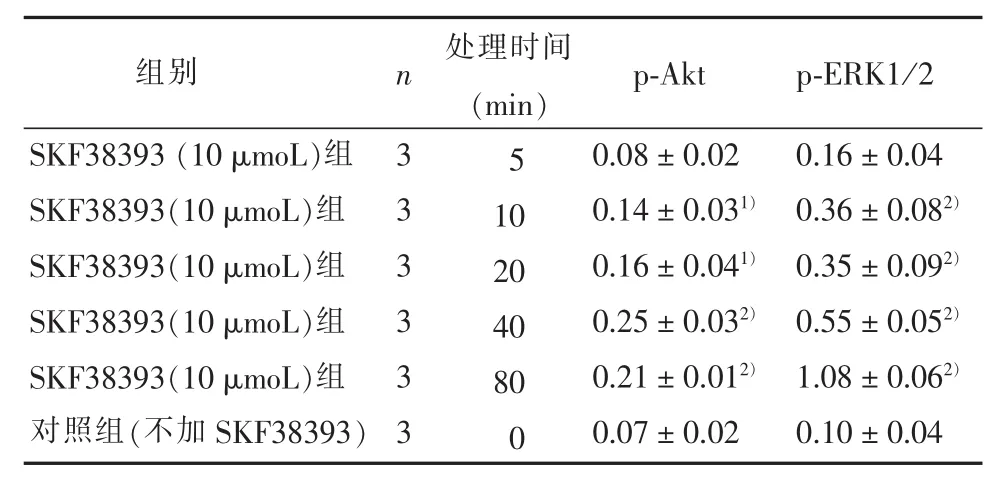
表2 SKF38393对PC12细胞胞内Akt和ERK磷酸化影响的时间关系
不同剂量的 SKF38393处理组与不加SKF38393的对照组相比,Akt和ERK磷酸化水平的差异均有统计学意义 (F=99.32,P<0.05;F=31.32,P<0.05)。1、3、10、30、100 μmoL不同剂量SKF38393处理40 min后均可以明显增加Akt和ERK的磷酸化水平 (P<0.05),并在 30~100 μmoL时达到最大值。见表3。为保证结果稳定性,后续不同信号通路抑制剂对SKF38393保护作用的实验,我们采用30 μmoL SKF38393处理细胞。
2.3不同信号通路抑制剂对SKF38393保护作用的影响 剥夺血清模型组、不同信号通路抑制剂组、SKF38393组与1%FBS对照组之间的吸光度值差异有统计学意义(F=93.02,P<0.05)。与1%FBS对照组比较,剥夺血清模型组细胞吸光度值下降(P<0.05);与剥夺血清模型组比较,给予SKF38393处理后细胞存活率明显增加(P<0.05);而给予PI3K/Akt信号通路抑制剂 LY294002、ERK信号通路抑制剂PD98059后均可明显抑制SKF38393的保护作用(P<0.05),但P38MAPK抑制剂PD169316则没有明显作用(P>0.05)。见表4。
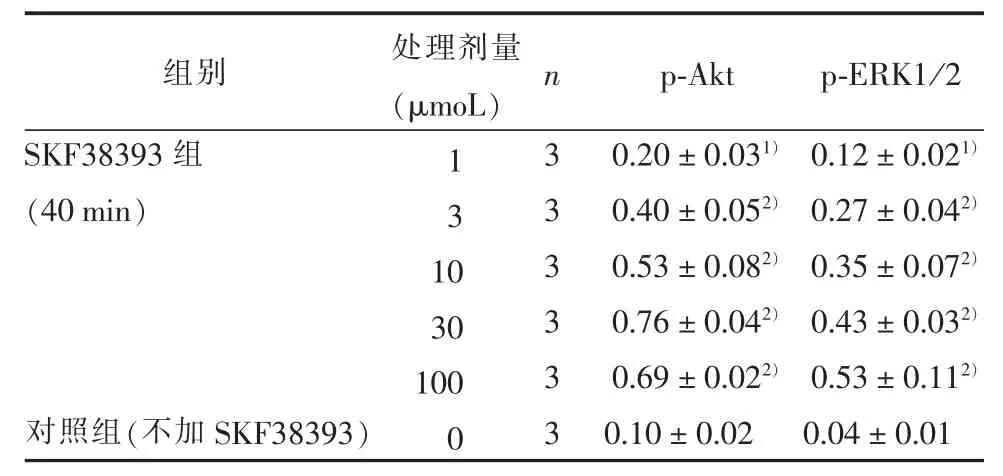
表3 SKF38393对PC12细胞内Akt和ERK磷酸化影响的量效关系

表4 不同信号通路抑制剂对SKF38393保护作用的影响
3 讨论
本研究通过剥夺血清建立PC12细胞损伤模型,在此基础上考察了SKF38393对剥夺血清引起的细胞损伤的保护作用,并进一步考察了其作用的信号通路。PC12细胞是神经科学离体研究神经元的一种重要工具细胞[6],在药物、毒物等化学物质的作用下以及缺乏神经营养因子条件下,都可发生凋亡的损伤[7]。本实验中通过剥夺血清模拟PD发病机制中的凋亡状态,血清剥夺所引起的细胞损伤模型已被广泛用于药物对细胞凋亡损伤的保护作用及机制的研究[11]。
SKF38393是选择性的多巴胺D1受体激动剂,临床上具有良好的抗帕金森病的作用并可减少左旋多巴治疗所引起的副作用[8]。本实验通过MTT实验发现与剥夺血清模型组比较,SKF38393可以显著对抗血清剥夺所引起的细胞损伤。在此之前已有实验证实SKF38393可以对抗大鼠皮质神经元中N-甲基天冬氨酸受体介导的神经毒性以及氧化应激引发的神经损伤[9-10]。这一结果与本研究结果类似,都提示了SKF38393的神经保护作用。
为进一步探讨SKF神经保护作用的机制,本研究考察了SKF38393对促存活激酶Akt及ERK磷酸化水平的影响,并通过 PI3K/Akt抑制剂LY294002、ERK抑制剂PD98059及p38MAPK抑制剂PD169316进一步考察SKF38393起作用的信号通路。Western blot实验结果显示,SKF38393可以显著增加Akt和ERK的磷酸化水平,加入Akt及ERK的抑制剂后均可显著减弱SKF38393的神经保护作用,进一步提示SKF38393可以通过或者是部分通过激活PI3K/Akt及ERK信号通路而对抗剥夺血清所诱导的细胞损伤,而p38MAPK信号通路的抑制剂则未能有效阻断SKF38393的神经保护作用。与本研究结果相似,在纹状体神经元上的研究发现多巴胺激活D1受体后以及SKF38393刺激可引起ERK信号通路激活[11]。同样SKF38393可以促使纹状体神经元TrkB受体在细胞膜表面表达增加,从而活化Akt及ERK[12]。本研究结果则在凋亡模型上进一步深入考察了SKF38393对血清剥夺所致凋亡的保护作用。
Akt及ERK均是重要的抗凋亡激酶,当Akt及ERK发生磷酸化后被激活,激活的Akt促使底物蛋白特定部位位点磷酸化,从而导致细胞存活增殖,并保护细胞逃避凋亡[13]。SKF38393促进Akt和ERK的磷酸化水平,活化的Akt及ERK可进一步作用于下游关键的凋亡蛋白[14],使它们磷酸化进而介导细胞抗凋亡的生物学功能。但SKF38393促进Akt及ERK磷酸化的机制还有待进一步研究,Akt及ERK均是神经营养因子如神经生长因子(NGF)、脑源性神经营养因子 (BDNF)等的重要下游靶分子,SKF38393增加Akt及ERK的磷酸化是增加细胞表面神经营养因子受体的表达,还是具有激动神经营养受体的作用,还是有其他的作用机制还有待进一步研究。
细胞凋亡作为致病因子已被广泛证实参与帕金森病的发病过程。随着相关研究的逐步深入,神经保护的治疗策略越来越受到重视,有效的神经保护策略将明显挽救神经元[15]。本研究初步揭示了SKF38393对血清剥夺所诱导的神经细胞损伤的保护作用及其可能作用机制,提示D1受体激动剂的神经保护作用可能和帕金森病的治疗有关,为SKF38393应用于帕金森病的治疗提供了新的证据,但这一作用还有待在动物模型上进一步验证。
[1] 陆强,汤义平,赵群峰,等.帕金森病患者的情感淡漠及其与抑郁和认知障碍的关系[J].中国神经精神疾病杂志,2010,36(8):485-487.
[2]Liu XK,Wang G,Chen SD.Modulation of the activity of dopaminergic neurons by SK channels:a potential target for the treatment of Parkinson's disease?[J].Neurosci Bull,2010,26(3):265-271.
[3]Mattson MP.Neuronal life-and-death signaling,apoptosis,and neurodegenerative disorders[J].Antioxid Redox Signal,2006,8(11-12):1997-2006.
[4]Fujita Y,Izawa Y,Ali N,et al.Pramipexole protects against H2O2-induced PC12 cell death[J].Naunyn Schmiedebergs Arch Pharmacol,2006,372(4):257-266.
[5]Zheng WH,Kar S,Quirion R.Insulin-like growth factor-1-induced phosphorylation of transcription factor FKHRL1 is mediated by phosphatidylinositol 3-kinase/Akt kinase and role of this pathway in insulin-like growth factor-1-induced survival of cultured hippocampal neurons[J].Mol Pharmacol, 2002,62(2):225-233.
[6]Hu HW,Li XK,Zheng RY,et al.bFGF expression mediated by a hypoxia-regulated adenoviral vector protects PC12 cell death induced by serum deprivation[J].Biochem Biophys Res Commun,2009,390(1):115-120.
[7]Hirata Y.Manganese-induced apoptosis in PC12 cells[J].Neurotoxicol Teratol,2002,24(5):639-653.
[8]Mousavi SH,Tayarani-Najaran Z,Asghari M,et al.Protective effect of Nigella sativa extract and thymoquinone on serum/glucose deprivation-induced PC12 cells death[J].Cell Mol Neurobiol,2010,30(4):591-598.
[9]Zhang H,Ma L,Wang F,et al.Chronic SKF38393 induced less severe dyskinasia and attenuated L-DOPA-induced dyskinesia in 6-OHDA-lesioned rat model of Parkinson's disease[J].Neuropha-rmacology,2007,53(1):125-133.
[10]Noh JS and Gwag BJ.Attenuation of oxidative neuronal necrosis by a dopamine D1 agonist in mouse cortical cell cultures [J].Experimental Neurology,1997,146(2):604-608.
[11]Chen J,Rusnak M,Lombroso PJ,et al.Dopamine promotes striatal neuronal apoptotic death via ERK signaling cascades[J].Eur J Neurosci,2009,29(2):287-306.
[12]Iwakura Y,Nawa H,Sora I,et al.Dopamine D1 receptor-induced signaling through TrkB receptors in striatal neurons[J].J Biol Chem,2008,283(23):15799-15806.
[13]New DC,Wu K,Kwok AW,et al.G protein-coupled receptorinduced Akt activity in cellular proliferation and apoptosis[J].FEBS J,2007,274(23):6025-6036.
[14]Freyberg Z,Ferrando SJ,Javitch JA.Roles of the Akt/GSK-3 and Wnt signaling pathways in schizophrenia and antipsychotic drug action[J].Am J Psychiatry,2010,167(4):388-396.
[15]Schapira AH.Future strategies for neuroprotection in Parkinson's disease[J].Neurodegener Dis,2010,7(1-3):210-212.
Dopamine-1 receptor agonist SKF38393 protects PC12 cell against death induced by serum deprivation via PI3K/Akt pathway.
WANG Xue,WANG Haitao,REN Yannan,ZHENG Wenhua.Neuropharmacology,School of Pharmaceutical Sciences,Sun Yat-sen University.Guangzhou 510006.China.Tel:020-39943103.
Objective To study the protective effects of dopamine-1 receptor(D1)agonist SKF38393 on PC12 cells against serum deprivation and its potential protective mechanisms associated with phosphatidylinositol 3-kinases/protein kinase B(PI3K/Akt)and extracellular signal-regulated kinases(ERK)signal pathways.Methods PC12 cells were divided into serum-free group,SKF38393 treatment groups(1 μmoL、3 μmoL、10 μmoL、30 μmoL and 100 μmoL)and 1%fetal bovine serum(FBS)group.PC12 cells were treated with various concentrations(1~100 μmoL)of SKF38393 for 40 min and 10 μmoL SKF38393 for various times(0~80 min).PC12 cells were treated with PI3K/Akt signal pathway inhibitor LY294002(50 μmoL)and ERK signal pathway inhibitors PD98059(50 μmoL)、PD169316(10 μmoL) before the addition of SKF38393 into the culture medium.Cell viability and levels of phsophorylated Akt and ERK were analyzed using MTT and Western blot,respectively.Results Compared with serum deprivation group,10 μmoL SKF38393 could significantly increase cell viability [(0.58±0.02) vs (0.37±0.01)], protective effects ofSKF38393 gradually increased[(0.62±0.01),(0.65±0.02)]as the concentrations increased(30 μmoL,100 μmoL)(P<0.05).Compared with serum deprivation group, the levels of phosphorylated Akt and ERK were significantly increased after treatment with the different concentrations of SKF38393 or treatment with SKF38393 for various times(P<0.05).Compared with the cell viability in SKF38393 group(0.59±0.01),the protective effect of SKF38393 was inhibited by LY290002(0.33±0.01)or PD98059(0.33±0.03)(P<0.05),but not PD169316(0.41±0.14)(P>0.05).Conclusion SKF38393 can protect PC12 cells against the injury induced by serum deprivation through, at least in part,PI3K/Akt and ERK pathways.
PC12 cells Dopamine-1 receptor agonist SKF38393 Phosphatidylinositol 3-kinases/protein kinase B(PI3K/Akt) Extracellular signal-regulated kinases(ERK)
R749.3
A
2011-02-21)
(责任编辑:曹莉萍)
☆ 国家自然科学基金(编号:30670652、30711120565、30970935)
* 中山大学药学院神经药理实验室(广州 510006)
(E-mail:whzheng1231@gmail.com)

