大剂量BOP(N-亚硝基双(2-氧丙基)胺)诱导了金黄地鼠肝内胆管癌而非胰腺癌*
吴泽珊,蒲 宇,沈成义,向 宇,蹇顺海,谢贤镛,文 彬,张小明,杨正伟
(川北医学院,1.形态定量研究室;2.医学影像研究所;3.病理生理研究室;4.附属医院病理科,四川 南充 637000)
胰腺癌发病机制尚不明确,制备胰腺癌动物模型对于研究胰腺癌发生与发展机制非常重要。目前,国内常用裸鼠建立种植性胰腺癌模型[1];国外常用 BOP(N-nitrosobis(2-oxopropyl)amine,N-亚硝基双(2-氧丙基)胺)诱导金黄地鼠胰腺癌,其特征与人类胰腺癌很相似[2]。BOP的常用剂量为10mg/kg体重,用药后 30 周左右成模[2,3]。Ouyang等(2005)[4]用大剂量BOP来诱导金黄地鼠胰腺癌,用药后18周成模。我们参考后一方法造模,结果没有诱导出胰腺癌,而诱导了肝内胆管癌。本文将我们的造模情况作一简要报告。
1 材料与方法
1.1 动物及用药:雌性叙利亚金黄地鼠(由四川省实验动物专委会养殖场提供)68只,用药前年龄约(8-9)周,体重91克-109克。把动物随机分为实验组48只,对照组20只。给实验组动物皮下注射用生理盐水配制的BOP(C6H10N2O3,美国International Laboratory公司产品),对照组动物注射等量生理盐水。完全根据文献[4]所述剂量和方法,实验组每个动物每周注射1次BOP,共5次,首次剂量为70 mg/kg体重,后4次均为20mg/kg。
首次用药8周(54天)后处死有明显腹水的实验组动物(10只),从对照组随机选择6只处死;用药12周(82天)后处死余下存活的实验组动物(7只),并再从对照组随机抽选6只动物处死,其余对照组动物用于其他实验。
1.2 组织病理学:处死动物后立即取出肝脏和胰腺等内脏器官,浸润固定于Bouin液内2天,然后在70%乙醇内保存,(2-5)天后给器官称重并切组织块。通过肝脏中心区域随机切取1组织薄片,然后从该薄片间隔切取2个组织块;沿垂直于胰腺长轴的方向,把胰腺切成3-4个组织块。组织块经常规石蜡(德国Leica公司)包埋,每个肝脏和胰腺各包埋2个蜡块;从每个蜡块切1张7μm厚的切片(所用肝脏和胰腺切片的平均面积分别约为54、39 mm2),常规作HE(苏木素+伊红)染色。
1.3 体视学:用×20物镜观察肝脏切片,在电脑显示器上观察切片图像(最后放大倍数×535),用电动载物台(川北医学院与四川大学、北京驰马特图像技术有限公司联合研制)等距随机抽选测试视野(从每张切片上平均抽选了36个视野),并用体视学测格软件(川北医学院与北京驰马特图像技术有限公司联合研制)在切片图像上生成6个测点(“+”,点间距为125 ×175μm),计数位于胆管管壁及管腔内的测点数以及位于整个切片内的测点数,由此估计肝内胆管的体积分数[5]。
2 结果
整个实验期间,对照组动物没有死亡。实验组动物第8周取材前死亡20只,第12周取材前死亡共31只。动物死于互相撕咬、虚弱及腹水等(具体死亡原因未做详细病理解剖分析)。
实验组动物体重显著减轻,实验组第12周取材动物肝脏重量显著增加(表1)。实验组第8周取材的所有10只动物腹腔内有(8-27)ml腹水,第12周取材的6/7只动物有(2-45)ml腹水;腹水呈淡黄或深黄色,清亮。
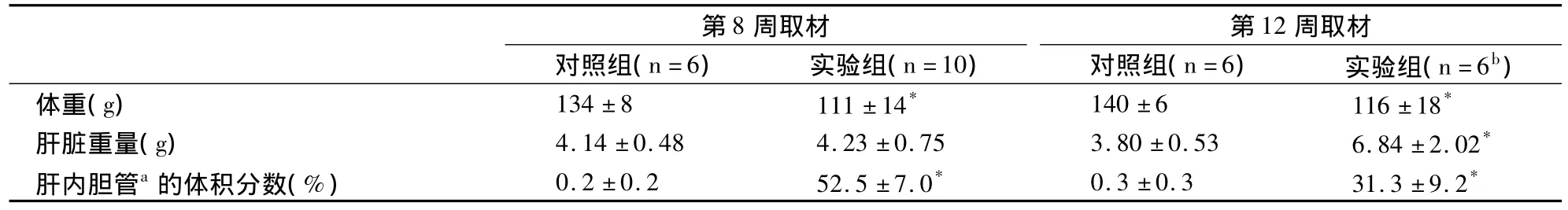
表1 主要结果(x-±SD)
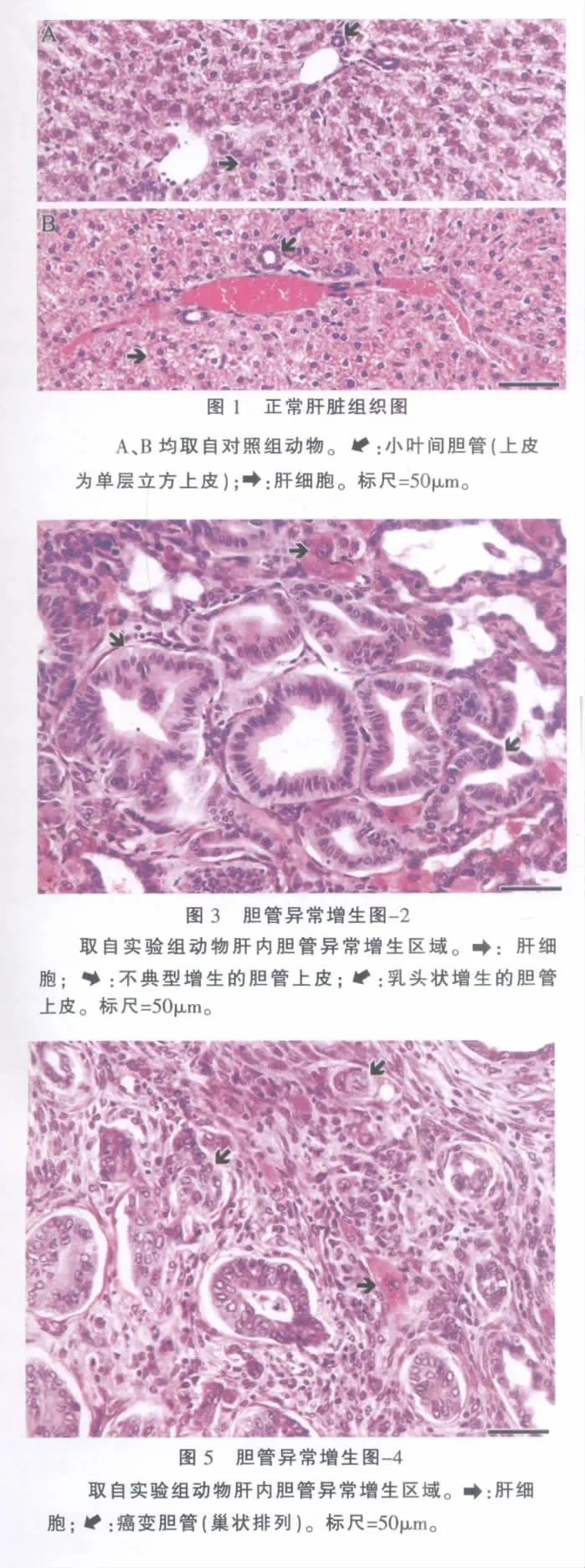
对照组所有动物的胰腺和肝脏未见明显的异常组织病理学变化,肝内可见胆管主要为稀少的小叶间胆管(图1和表1)。
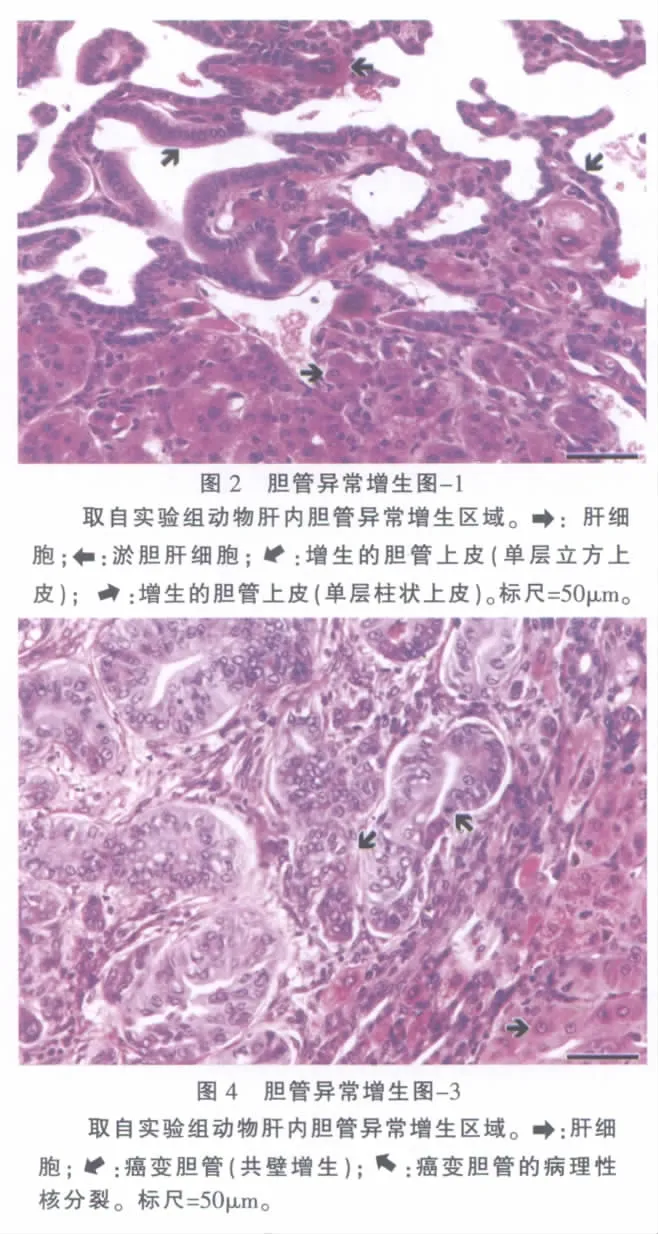
实验组所有动物胰腺的组织病理学基本正常(似有一定程度的间质水肿和炎细胞浸润),未见任何癌变组织。除第12周组有1只动物“基本正常”(肝内胆管略微扩张)外,2组所有动物肝内胆管异常增生,增生胆管占肝脏体积的14%–62%(表1)。胆管增生呈弥漫性,并向肝小叶结构内侵犯。增生的胆管上皮为单层立方、柱状(图2),部分区域呈乳头状和不同程度的不典型增生(图3)。除第12周组2只动物外,2组所有动物肝内部分异常增生的胆管出现灶性癌变[6],表现为上皮细胞形态多样,层次增加,细胞核极性消失,染色质多而不均匀,可见病理性核分裂及“背靠背”或共壁征象(图4),甚至胆管结构消失,细胞呈小巢状分布(图5)。增生胆管间残存的肝细胞中有不少细胞肿大(图1-图5),少量细胞有淤胆征象(图2)。
3 讨论
胰腺癌常用金黄地鼠造模,并常用小剂量BOP(例如10mg/kg)多次注射的方法,成模时间大约在首次用药后30周左右[2,3]。我们也用了该法造模(以10mg/kg的剂量每周注射与本文一样的BOP一次,共注射7次),首次用药后38周的确观察到胰腺癌形成(正在研究中,尚未报告)。文献[4]用大剂量BOP来诱导金黄地鼠胰腺癌,首次用药后18周大多数动物都有胰腺癌形成[4]。本文采用该文献所用方法造模,以期缩短造模时间,结果却没有造成胰腺癌,而造成严重肝损害,首次用药后12周大多数动物都已死亡。笔者觉得这很难解释,因为文献[4]用的也是雌性叙利亚金黄地鼠(用药前年龄5周,体重70克)。也许,大剂量BOP更易损害肝脏,动物存活困难,不适于建造胰腺癌模型。
肝内胆管癌尚缺乏理想的动物模型。有趣的是,本研究所用大剂量BOP“碰巧”诱导出了肝内胆管癌。人们常用亚硝胺类化合物[7]、呋喃[8]等致癌剂诱导大鼠,尤其是金黄地鼠(其胆道解剖[9]和胆汁[10]成分与人相似)肝内胆管癌。事实上,有研究报告过小剂量BOP诱导胆管癌(成模率约20%)[11];为增加造模成功率,人们常在 BOP 用药的基础上结合外科手术(胆囊小肠吻合)造模[7]。本研究显示BOP用药后绝大多数动物都出现肝内胆管不典型增生及灶性肝内胆管癌。因此,本研究结果无疑为进一步探讨用BOP创建肝内胆管癌模型提供了重要参考依据。
[1] 任丽楠,徐建华,郭晓钟,等.胰腺癌动物模型的建立及意义[J].胰腺病学,2004,4(2):109-115
[2] Takeuchi Y,TakahashiM,Sakano K,etal.Suppression of N-nitrosobis(2-oxopropyl)amine induced pancreatic carcinogenesis in hamsters by pioglitazone,a ligand of peroxisome proliferator-activated receptor gamma[J].Carcinogenesis,2007,28(8):1692-1696
[3] Takiyama Y,Egami H,Pour PM.Expression of human tumor-associated antigens in pancreatic cancer induced in Syrian hamsters[J].Am JPathol,1990,136(3):707 -715
[4] Ouyang N,Williams JL,Tsioulias GJ,etal.Nitric oxide-donating aspirin prevents pancreatic cancer in a hamster tumormodel[J].Cancer Res,2006,66(8):4503-4511
[5] 杨正伟.形态定量[A].见:成令忠,钟翠平,蔡文琴.现代组织学[M].上海:上海科学技术文献出版社,2003.34-39
[6] Ogura Y,Matsuda S,Ito M,etal.Chemoprevention of biliary carcinogenesis in syrian hamsters by the novel carboxamide derivative IS-741 after initiation with N-nitrosobis(2-oxopropyl)amine(BOP)[J].Carcinogenesis,2000,21(8):1469 -1475
[7] Tsuneoka N,Tajima Y,Kitasato A,et al.Chemopreventative effect of hochu-ekki-to(TJ-41)on chemically induced biliary carcinogenesis in hamsters[J].JSurg Res,2009,151(1):22-27
[8] Hickling KC,Hitchcock JM,Oreffo V,et al.Evidence of oxidative stress and associated DNA damage,increased proliferative drive,and altered gene expression in rat liver produced by the cholangiocarcinogenic agent furan [J].Toxicol Pathol,2010,38(2):230-243
[9] TakahashiM,Pour P,Althoff J,et al.The pancreas of the Syrian hamster(Mesocricetus auratus).I.Anatomical study[J].Lab Anim Sci,1977,27(3):336 -342
[10] Pearlman BJ,Bonorris GG,Phillips MJ,et al.Cholesterol gallstone formation and prevention by chenodeoxycholic and ursodeoxycholic acids.A new hamster model[J].Gastroenterology,1979,77(4):634-641
[11] Ikematsu Y,Tomioka T,Yamanaka S,et al.Bilioenterostomy enhances biliary carcinogenesis in hamsters [J].Carcinogenesis,1996,17(7):1505-1509

