胡柚上柑橘衰退病毒的分子检测
武晓云,刘 琦,郭玉双,武小霞
(1.浙江农林大学农业与食品科学学院,浙江 临安 311300;2.黑龙江省农业科学院园艺分院,哈尔滨 150086;3.贵州省烟草科学研究所,贵阳 550081;4.东北农业大学农学院,大豆生物学教育部重点实验室,哈尔滨 150030)
胡柚(Citrus changshanensis)原产于浙江省常山县,是一种重要的地方特色柑橘良种[1]。胡柚果实色泽艳丽、果型美观、耐储藏,并且富含多种维生素和人体必需氨基酸和丰富的柑橘类黄酮物质,如柚皮苷(Naringenin)和新桔皮苷(Neohesperidin)等,因此是一种非常值得推广和扶持的柑橘品种[2]。目前,胡柚已成为我国主要栽培柑橘品种之一:全国的种植面积多达一百多万亩,栽培种植的省份包括浙江省、江西省、福建省和湖南省、年均产量100多万t,年产值近20亿元。
胡柚黄斑病是胡柚常见病害之一,染病植株叶片较正常植株明显减少,并且叶片出现黄化症状,植株不能结果或减少,并且果实出现变小、酸味增加。该病害最早报道于上世纪90年代,由于当时条件所限该病害被认为由真菌或细菌引起[3-4]。近年来,该病害的发生范围不断扩大,有暴发流行之趋势,该病害已严重影响胡柚的产量和品质,可能对胡柚整个产业的进一步发展造成严重影响。但是,该病害的病原至今未能得到系统的鉴定,因此严重影响相应防治措施的制定。本文通过血清学和分子生物学检测,从症状表现叶片黄化的胡柚植株中检出柑橘衰退病毒(Citrus tristeza virus,CTV),并对胡柚上克隆CTV病毒外壳蛋白(CP)基因的序列与GenBank中登陆的相应序列进行了分析,结果表明胡柚黄斑病可能由CTV一个新的分离物引起。
1 材料与方法
1.1 样品采集
胡柚叶片采集自浙江省常山县,症状表现为叶片黄化,具体采集信息见表1。

表1 胡柚样品采集地点、采集时间及症状Table 1 List of sampling locations and time,and symptoms of Huyou
1.2 血清学检测
采用Agdia公司的CTV ELISA Reagent Set试剂盒进行DAS-ELISA检测,并参照Agdia公司提供的试剂盒说明书进行。DAS-ELISA的阳性对照购自Agdia公司,阴性对照采用健康胡柚叶片(由常山县农业局植保植检站提供)。
1.3RT-PCR扩增和克隆
用TRIzol Reagent(Invitrogen公司)提取胡柚叶片的总RNA。根据文献[5]报道,设计CTV外壳蛋白(CP)基因的通用引物 CP1(5′ATGGACGACGAAA CAAAGA 3′)和 CP3(5′TCAACGTGTGTTGAATTTCC 3′)。用M-MLV试剂盒(Promega公司)根据试剂盒提供的试验步骤配制反转录反应混合液,以CP3为引物合成cDNA第一链。以CP1和CP3为引物进行PCR扩增,扩增产物用1%琼脂糖进行电泳检测。扩增片段用DNA胶回收试剂盒(Axygen公司)进行回收后,连接至pGEM-T载体(Promega公司)中,并进行测序测定。
1.4 序列分析
序列拼接和同源性分析采用DNAman 6.02(Lynnon Biosoft)程序进行;应用Clustal X 1.83程序进行多序列比对[6],用MEGA4.0程序中的最大简约法(Maximum parsimony,MP)构建系统进化树,进化树的可信度用bootstrap进行检测(1 000次重复)[7]。系统进化树中其他CTV分离物及GenBank登录号如下:B165(Accession EU076703)、Mexico(DQ272579)、NUagA(AB046398)、NZ-B18(FJ525436)、NZRB-G90(FJ525432)、NZRB-M12(FJ525431)、NZRB-M17(FJ525435)、NZRB-TH28(FJ525433)、NZRB-TH30(FJ525434)、Qaha(AY340974)、SY568(AF001623)、T30(AF260651)、T36(U16304)、T318A(DQ151548)、T385(Y18420)、HA16-5(GQ454870)、P09.18(GQ424346)和 VT(U56902)。
2 结果与分析
2.1 田间症状观察
对浙江省主要胡柚种植区衢州市和常山县5处胡柚种植株园的胡柚的田间调查表明,胡柚黄化病的发病率在2.3%左右。症状主要包括植株叶片减少、脉间黄化(见图1),结果数量及质量降低,大部分发病植株的茎部不出现茎点的症状,少数植株具轻微的茎点症状。由于发病植株分布具有分散性和不连续性,且路边植株的发病率较中间高,具有病毒病害的特征。

图1 胡柚黄化症状Fig.1 Yelllowing symptoms of Huyou
2.2DAS-ELISA检测
用DAS-ELISA对采集的18个植株表现黄化症状的胡柚进行了检测,结果表明除CS-3、CS-6和QZ-7外,其余15个样品与CTV抗血清均有反应。其中,CS-7与CTV抗体的反应最强(OD值为3.783),约为阳性对照的3倍,其余样品与CTV抗体的反应较弱(见表2)。表明,胡柚黄化病可能与CTV病毒有关。为进一步明确感染胡柚的CTV株系,我们对CS-7样品进行了进一步的分析。
2.3RT-PCR扩增
用CP3进行反转录后,用CP1和CP3进行PCR扩增。琼脂糖凝胶电泳结果显示扩增的目的条带约700 bp,与预期条带大小一致(见图2)。PCR产物经纯化、克隆、测序分析发现,扩增至目的片段长672 bp(GenBank登陆号:HQ634290)。Blastn同源性搜索结果表明该片段与CTV P09.18分离物(GQ424346)的CP基因具最高相似性,为97.17%[8]。
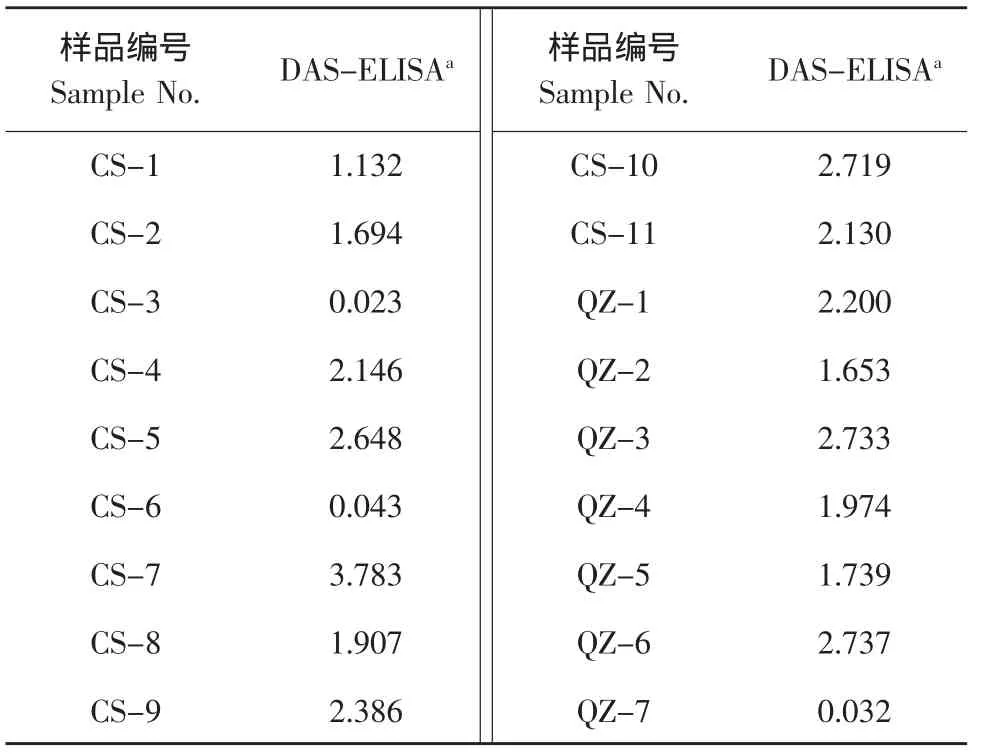
表2 胡柚样品的DAS-ELISA检测Table 2 DAS-ELISA detection results of different Huyou samples
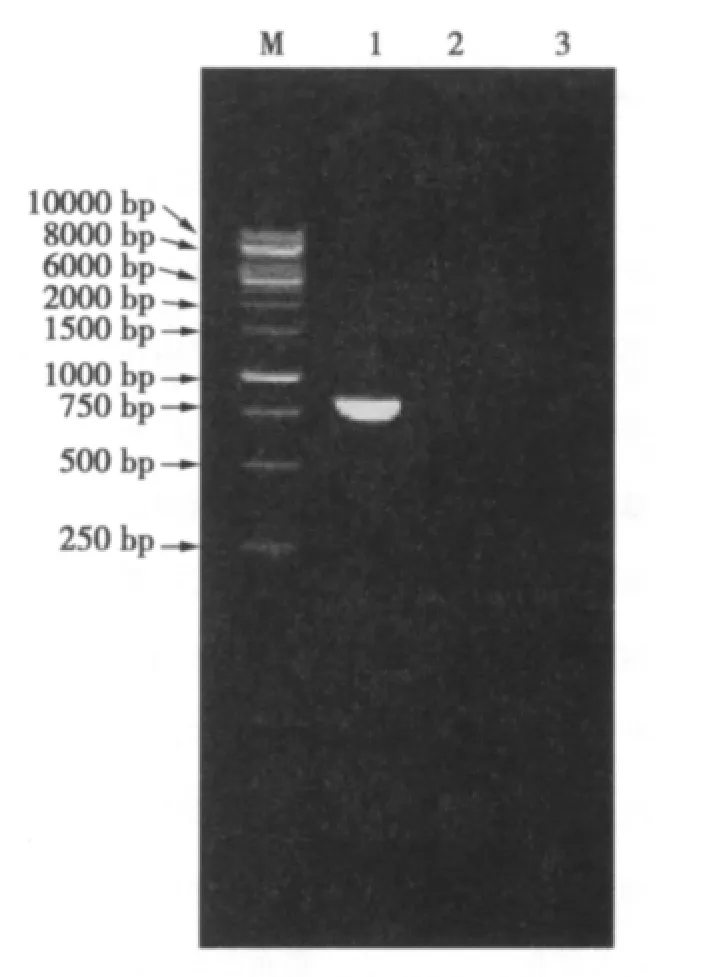
图2 CS-7样品的RT-PCR检测Fig.2 RT-PCR detection of CS-7
2.4 同源性分析
将克隆的CS-7 CP基因与CTV GenBank中的其他CTV分离物的相应序列用Clustal X 1.83程序进行多序列比对后进行同源性分析。结果表明,在核苷酸水平上,CS-7与P09.18相似性最高(97.0%),其次分别是 NZRB-TH30(96.8%)、NZRB-M17(96.6%)、NZRB-M12(96.5%)、NZRBTH28(96.5%);在氨基酸水平上,CS-7与P09.18、NZRB-TH30、NZRB-M17、NZRB-M12 和 NZRBTH28的相似性都为96.6%(见表3)。表明CS-7与P09.18、NZRB-TH30、NZRB-M17、NZRB-M12 和NZRB-TH28具有较近的遗传关系。
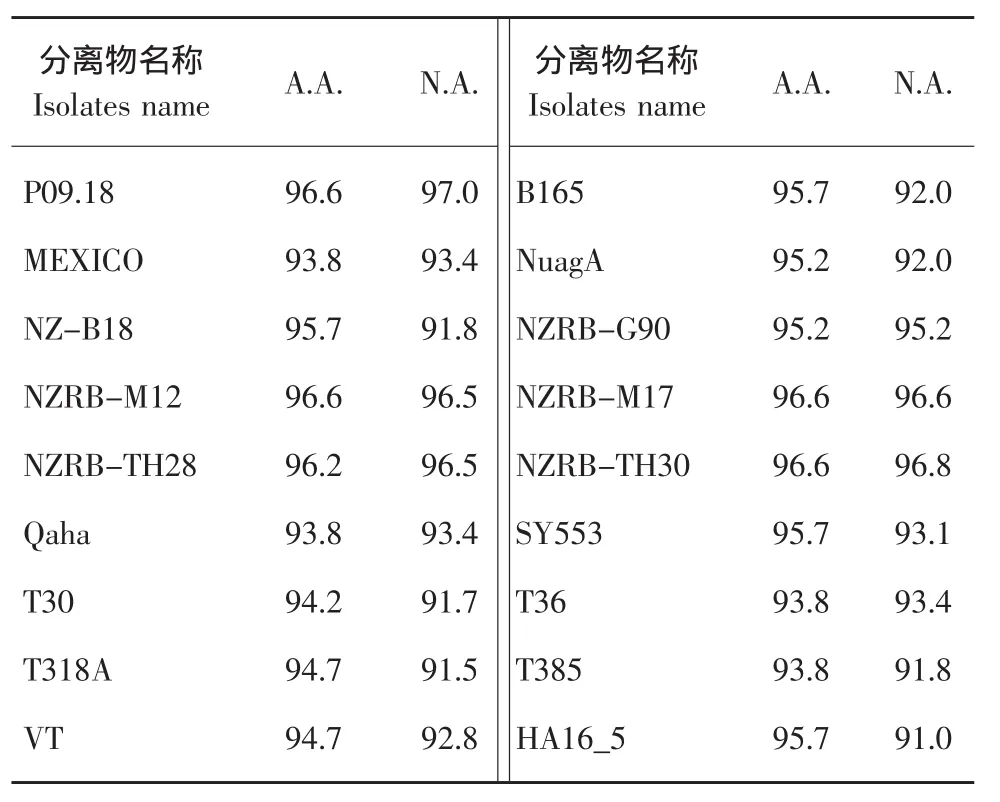
表3 CS-7 major CP的核苷酸及氨基酸序列与CTV不同分离物之间相似性比较Table 3 Similarity between nucleotide and amino acid sequences of major CP of CS-7 and other CTV isolates
2.5 系统进化分析
将克隆的CTV CS-7分离物的CP基因与GenBank中的其他CTV分离物的相应序列用MEGA 4.0程序构建系统进化树(见图3)。在系统进化树中,CS-7与P09.18聚于一小分支后再与NZRB-TH28、NZRB-M17、NZRB-M12 和 NZRBTH30 4个分离物形成一个单独的分支,进一步表明 CS-7 与 P09.18、NZRB-TH30、NZRB-M17、NZRB-M12和NZRB-TH28具有较近的进化关系。
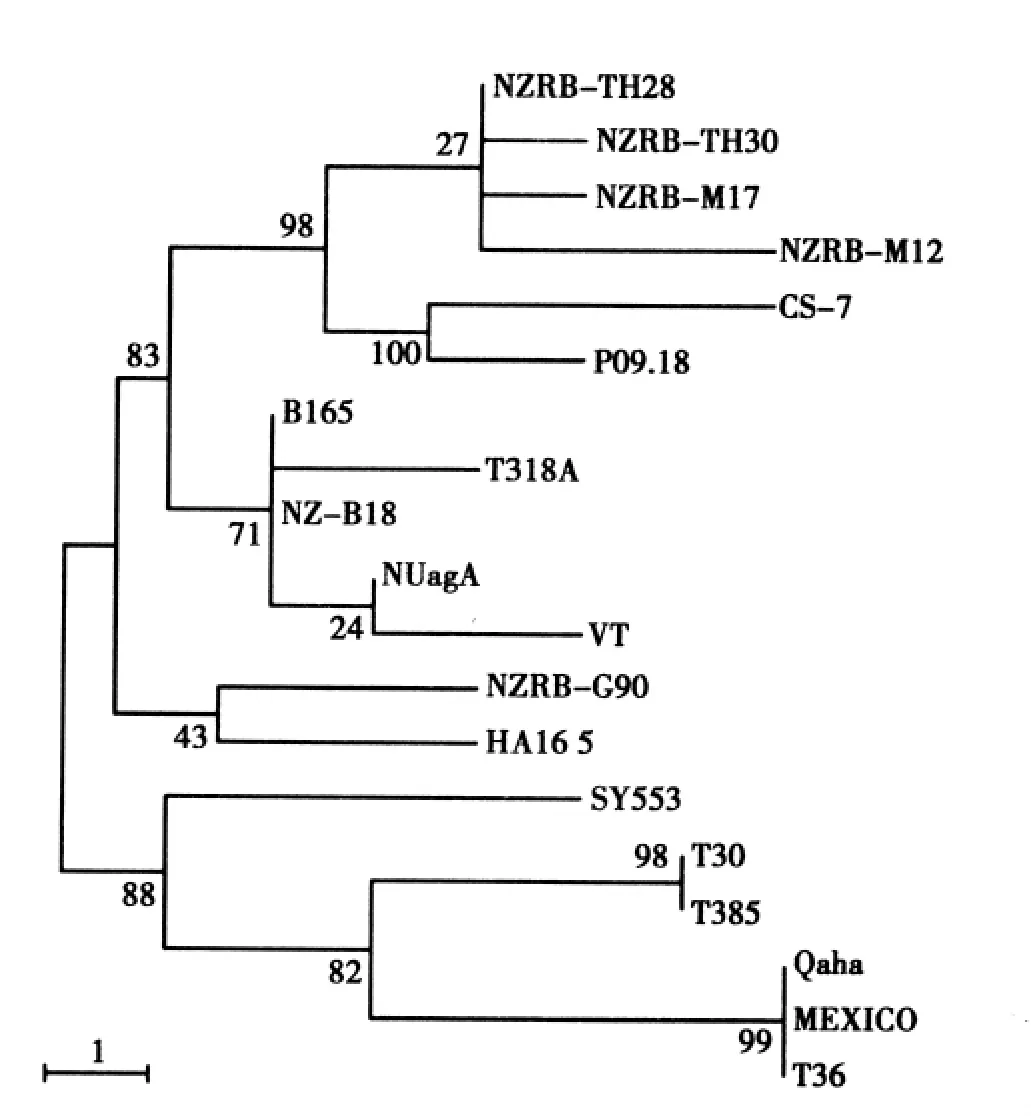
图3 CS-7与其他CTV分离物构建的系统进化树Fig.3 Phylogenetic tree of CS-7 and other CTV isolates
3 讨论
CTV属于长线型病毒科(Closteroviridae)长线型病毒属(Closterovirus),是世界范围内危害最强、经济意义最为重要的柑橘病害之一[9]。该病毒在我国也普遍发生,全国几乎所有的柑橘种植区都有该病毒发生与为害的报道[10-14]。CTV的寄主范围仅限于芸香科植物,研究表明CTV可侵染绝大多数栽培的柑橘品种。但是,胡柚上至今还未见有CTV分布与为害的报道。本研究首次从血清学和分子水平证实了CTV病毒在胡柚上的存在,表明胡柚也是CTV的寄主之一。
根据对寄主植物造成的症状,CTV可粗分为4个株系:茎陷点株系(Stem-pitting,SP)、衰退株系(Decline inducing,DI)、苗黄化株系(Seedling yellows,SY)和弱症状株系[9,15]。其中 SP 株系以分离物VT为代表,DI株系以T30为代表,SY株系以T36为代表。王洪祥等对浙江省黄岩的“本地早”(Citrus succosa)密柑上的CTV进行了研究[16],结果表明CTV在“本地早”发生相当普遍,株茎陷点株系、衰退株系和苗黄化株系都有存在,并且发现苗黄株系或强茎陷点株系和碎叶病毒存在复合感染,这是造成黄岩本地早和新本1号产量低下的一个重要原因。在系统进化树中本文分离的CTV株系(CS-7)与上述株系都有较远的遗传距离,而与P09.18、NZRB-TH28、NZRB-M17、NZRB-M12 和NZRB-TH30聚于一分支,表明CS-7可能是CTV一个新的可诱导胡柚植株黄化症状的株系。CTV P09.18分离自美国的California,而NZRB-TH30、NZRB-M17、NZRB-M12和NZRB-TH28来自于新西兰。由于柑橘起源于我国及东南亚等地区,因此P09.18和NZRB-TH30等美国和新西兰的CTV可能通过柑橘及其种苗等的贸易被传入。
在血清学检测中,不同的分离物与抗血清有着不同的反应,表明侵染胡柚的CTV可能也由不同的株系存在,并且可能存在复合侵染现象。因此,有必要扩大样品采集范围,对胡柚上CTV的株系组成以及为害进行更系统的研究,为胡柚黄斑病的防治提供理论基础。虽然,我们从植株表现黄化的胡柚中检测到了CTV病毒,但是胡柚植株黄化症状是否由CTV引起,还有待将该分离物接种至健康胡柚幼苗并完成柯赫氏法则鉴定,但是这最少需要1~2年的时间才可能有结果。
*武小霞为本文的同等贡献者。
[1] 俞日梁,陈新建,叶杏元,等.常山胡柚品种起源及栽培研究进展[J].浙江林业科技,2006,26(3):83-86.
[2] Lu Y H,Zhang C W,Bucheli P,et al.Citrus flavonoids in fruit and traditional Chinese medicinal food ingredients in China[J].Plant Foods for Human Nutrition,2006,61(2):57-65.
[3] 杨兴良.柑桔黄斑病在胡柚上发生特点及防治[J].中国南方果树,1998,27(6):18.
[4] 刘联友.胡柚黄斑病的发生与防治[J].浙江柑橘,2001,18(1):25.
[5] Gillings M P,Broadbent J I,Lee L F.Characterization of isolates and strains of Citrus tristeza closterovirus using restriction analysis of the coat protein gene amplified by the polymerase chain reaction[J].Journal of Virological Methods,1993,44(2-3):305-317.
[6] Chenna R,Sugawara H,Koike T,et al.Multiple sequence alignment withtheCulstalseriesofprograms[J].NucleicAcidsResearch,2003,31(13):3497-3500.
[7] Tomura K,Dudley J,Nei M,et al.MEGA 4:molecular evolutionary gentics analysis(MEGA)software version 4.0[J].Molecular Biology and Evolution,2007,24(8):1596-1599.
[8] Camacho C,Coulouris G,Avagyan V,et al.BLAST+:architecture and applications[J].BMC Bioinformatics,2009,10:421.
[9] Pedro M,Silvia A,Maria R A M,et al.Citrus tristeza virus:A pathogen that changed the course of the citrus industry[J].Molecular Plant Pathology,2008,9(2):251-268.
[10] 李红叶,陈力耕,周雪平.柑橘病毒与类似病毒分子生物学和抗病毒基因工程研究进展[J].果树科学,2000,17(2):131-137.
[11] 周彦,王雪峰,唐科志,等.重庆地区柑桔衰退病毒组群分析[J].西南农业大学学报:自然科学版,2004,26(4):420-422.
[12] 周彦,周常勇,王雪峰,等.重庆地区柑桔衰退病毒多态性研究[J].植物保护学报,2005,32(2):143-147.
[13] 董家红,岳建强,尹跃艳,等.云南柠檬生产区衰退病检测与分析[J].云南大学学报:自然科学版,2008,30(S1):73-76.
[14] 丁芳,洪霓,钟云,等.不同来源的柑橘衰退病毒分离物基因组5′端A、F变异区序列克隆及分析 [J].植物病理学报,2008,38(2):252-257.
[15] Niblett C L,Genc H,Cevik B,et al.Progress on strain differentiation of Citrus tristeza virus and its application to the epidemiology of citrus tristeza disease[J].Virus Research,2000,71(1-2):97-106.
[16] 王洪祥,刘保健,韩玲玲.本地早柑桔病毒类病害的发生和生物学鉴定[J].浙江农业学报,1998,10(2):85-89.
[17] 崔伯法,崔圣为,王洪祥,等.本地早柑桔衰退病毒病的交叉保护研究[J].浙江大学学报:农业与生命科学版,2005,31(4):433-438.

