紫鹃茶和苦丁茶中功效成分的提取分离
隋秀芳,王玉株,黄 涛,秦礼康,*
(1.贵州大学生命科学学院,贵州 贵阳 550025;2.六盘水市第二实验中学,贵州 六盘水 553001;3.六盘水三山食品有限公司,贵州 六盘水 553001)
紫鹃茶和苦丁茶中功效成分的提取分离
隋秀芳1,王玉株2,黄 涛3,秦礼康1,*
(1.贵州大学生命科学学院,贵州 贵阳 550025;2.六盘水市第二实验中学,贵州 六盘水 553001;3.六盘水三山食品有限公司,贵州 六盘水 553001)
优选降压效果显著的紫鹃茶和苦味特征明显的苦丁茶为原料,采用微波辅助有机溶剂提取法对紫鹃茶和苦丁茶中的功效成分进行分离提取获得茶提取物,通过添加茶提取物解决整米苦荞茶热加工过程中特征风味和部分功效成分严重缺失的技术难题。结果表明,不同贮藏期的紫鹃茶除茶黄素含量差异不显著外,其余功效成分差异显著(P<0.05)。苦丁茶老叶、嫩叶及其超微粉营养成分存在显著性差异(P<0.05)。通过正交试验优化,紫鹃茶提取最佳工艺条件为乙醇体积分数65%、微波功率540W、提取时间50s、液料比为10:1,其提取物富含花青素(Δ A示差值0.925),茶多酚27.709%,茶黄素0.707%,茶红素15%,儿茶素259.735mg/g,咖啡碱7.053%;苦丁茶提取最佳工艺条件为乙醇体积分数55%、微波功率360W、提取时间120s、液料比25:1,其提取物苦味浓烈,含黄酮30.79%、叶绿素0.699mg/g、茶多酚13.619%、咖啡碱4.812%、儿茶素26.161mg/g。紫鹃茶和苦丁茶提取物均可作为苦荞茶风味与功能强化用基料。
苦荞茶;紫鹃茶;苦丁茶;超微粉碎;功效成分
紫鹃茶,是云南特有的一种茶叶,属于纯正云南大叶种乔木普洱茶系列,是经千年以上的大叶乔木古茶树变种而来。据分析,该茶富含茶多酚、氨基酸、水浸出物、茶黄素、茶红素、花青素等营养功能成分。其中,花青素由于其卓越的抗氧化能力,可清除人体内致病的自由基,减缓细胞死亡和细胞膜变性,延缓衰老;并且其能通过降低胆固醇水平,减少血管壁上的胆固醇沉积,提高血管壁弹性而达到降压的功能,在预防和治疗心血管疾病中发挥越来越大的作用[3]。
苦丁茶(Ileχ kudingcha),属冬青科冬青属植物,含有多酚、黄酮、咖啡碱、蛋白质等200多种成分,具有降血压、降胆固醇、抑菌消炎、清除人体自由基、增强人体免疫力等功效,对它的研究与开发已成为近年来的热点[4]。贵州苦丁茶,因其明显的生理活性和独特的苦后回甜风味特征,深受消费者青睐。
本实验以紫鹃茶和苦丁茶作为原料,旨在利用其降压、抗氧化等保健功能和特征苦味,通过正交试验,确定提取的最佳工艺方案,并跟踪分析提取物的主要功能成分,为后续应用于苦荞茶风味与功能强化提供科学依据。
1 材料与方法
1.1 材料与试剂
贮藏期分别为1年、2年、3年的蒸青紫鹃茶 云南茶叶研究所;苦丁茶老叶、苦丁茶嫩叶 贵州余庆县。
茚三酮(AR)、甲醇(色谱级)、没食子酸标准品(AR)天津科密欧化学试剂有限公司;碳酸钠(≥99.0%) 成都金山化学试剂有限公司;黄酮标样(芦丁) 南京替斯艾么中药技术研究所;其他化学试剂均为分析纯。
1.2 仪器与设备
AK-98型流水式超细中药粉碎机 东莞市创瑞工业实验设备有限公司;TGL20M型台式高速冷冻离心机 长沙迈佳森仪器设备有限公司;UV-7502 PC紫外可见分光光度计 上海欣茂仪器有限公司;HH-S6型电热恒温水浴锅 北京科伟永兴仪器有限公司。
1.3 方法
1.3.1 紫鹃茶、苦丁茶测定指标与方法
将不同贮藏期(分别为1、2、3年)的紫鹃茶,超微粉碎后得到超微紫鹃茶粉(320目),后分别对所得超微紫鹃茶粉做功效成分测定;选择不同成熟度的苦丁茶及其超微茶粉做营养功效成分测定,测定指标与方法如下:茶多酚:GB/T 831 3—2008《茶叶中茶多酚和儿茶素类含量的检测方法》;儿茶素:香荚兰比色法;可溶性糖含量:蒽酮比色法;水浸出物:GB/T 8305—2002《茶水浸出物测定》;叶绿素含量:丙酮分光光度法;咖啡碱:GB/T 8312—2002《茶咖啡碱测定》;游离氨基酸总量:茚三酮比色法;茶黄素、茶红素:Roberts分光光度法。
1.3.2 紫鹃茶提取物制备的单因素试验[5-8]
将不同储藏期的紫鹃茶混合,超微粉碎得到紫鹃茶粉(320目)作为实验原料,利用微波辅助有机溶剂法提取紫鹃茶粉中的花青素。参考文献[7],采用pH值示差法对紫鹃茶提取物中的花青素进行定量分析。具体方法如下:分别精确称取1g紫鹃茶粉7份,按照表1安排,用不同体积分数乙醇按照一定的料液比添加后(按照0.1% HCl-乙醇=1:20)加入0.1%的盐酸。微波辅助提取,离心(4000r/min,15min),吸取提取液。取提取液1mL,分别加入pH1.0和pH4.5缓冲体系,定容至10mL,分别于530nm和700nm测定吸光度,以吸光度的差值表示花青素的提取量,用示差法按照公式计算:


表1 紫鹃茶提取物制备单因素试验因素水平表Table 1 One-factor-at-a-time design for optimizing Zijuan Pu-erh tea extraction
1.3.3 紫鹃茶提取物制备的正交试验
根据单因素试验结果,设计正交试验的因素水平表(表2)。设计采用L9(34)正交试验,确定紫鹃茶花青素粗提取的最佳提取方案。后将提取液进一步浓缩干燥成粉末状,密封保存。

表2 紫鹃茶提取物制备正交试验因素与水平设计表Table 2 Factors and their levels in orthogonal array design foroptimizing Zijuan Pu-erh tea extraction
1.3.4 苦丁茶提取物的制备方法[9-11]
采用超微粉碎设备将苦丁茶老叶、嫩叶分别粉碎,得到超微粉(320目)。利用微波辅助有机溶剂法提取超微粉中的黄酮类物质。
1.3.4.1 苦丁茶提取物制备的单因素试验
精确称取一定量干燥粉碎的苦丁茶粉,根据表3,按照一定液固比(固定液体体积为l00mL)加入不同体积分数乙醇溶液,在设定的微波功率下加热提取一定时间,取出提取液,经离心分离(4000r/min,15min)后取上清液lmL定容,测定苦丁茶总黄酮含量。

表3 苦丁茶提取物制备的单因素试验因素水平表Table 3 One-factor-at-a-time design for optimizing Kuding tea extraction
1.3.4.2 总黄酮含量测定
标准曲线的绘制:精确称取芦丁标样36.6mg,用30%乙醇溶解定容于100mL棕色容量瓶中。分别吸取l、2、4、6、8mL芦丁标准溶液,加入5个25mL容量瓶中,用30%乙醇溶液补充至12.5mL,加入0.7mL 5% NaNO2,摇匀,放置5min后加入0.7mL Al(NO3)3,6min后,加入5mL lmol/L NaOH,摇匀后用30%乙醇溶液稀释至刻度。放置10min后于波长510nm处比色测定吸光度(以试剂为空白参比)。以标准芦丁含量为纵坐标,吸光度为横坐标,绘制标准曲线。用最小二乘法,以芦丁溶液质量浓度(y)与吸光度(A)进行线性回归得到回归方程和相关系数。
总黄酮含量测定:取上清提取液lmL于25mL容量瓶中定容后,精确吸取lmL溶液,其余按“标准曲线绘制”的方法操作后,在510nm处测定吸光度,代入上述所得回归方程计算总黄酮含量。计算公式如下:

式中:X为总黄酮含量/%;m为查曲线所得黄酮含量/mg;M为待测样品干基的质量/g;n为样品提取液测定时稀释的倍数。
1.3.4.3 苦丁茶提取物制备的正交试验

表4 苦丁茶提取物制备正交试验因素与水平设计表Table 4 Factors and their levels in orthogonal array design for optimizing Kuding tea extraction
根据单因素结果,设计正交试验的因素水平表(表4)。采用L9(34)正交试验,确定苦丁茶黄酮粗提物的最佳提取方案。后将提取液进一步浓缩干燥成粉末状,密封保存。
1.4 统计分析
所有试验数据平行测定3次,采用SPSS 13.0统计软件分析,用均值加标准差表示。
2 结果与分析
2.1 不同贮藏期超微紫鹃茶粉的抗氧化功能成分分析

表5 超微紫鹃茶粉抗氧化功能成分测定结果Table 5 Antioxidant components in Zijuan Pu-erh tea powder
由表5可知,贮藏期不同的紫鹃茶超微粉碎后得到的超微茶粉,主要营养成分中仅茶黄素含量不存在显著性差异,其他均存在明显差异。随着紫鹃茶贮藏时间的延长,紫鹃茶粉中茶多酚、花青素、茶红素、儿茶素、还原性糖总量呈现先降低后增长的变化趋势;水浸出物、氨基酸总量和咖啡碱呈递减趋势;茶黄素含量变化不大。分析原因是:茶叶在储藏过程中,其品质成分在内外因子的作用下会发生一系列变化。短时间贮藏时,茶多酚、花青素、儿茶素等功效成分会不同程度的氧化、降解和转化,所以含量逐渐减少;随着储藏时间的延长,紫鹃茶自身发酵程度加深,部分营养成分反而因为某些物质间的转化,含量有所增加[12-13],例如茶红素的变化。因为茶叶中部分儿茶素经过氧化聚合形成茶黄素,茶黄素进一步转化,形成茶红素[14-16]。这就是茶红素含量先降低后增大的原因。此外造成此结果的原因还可能出自原料自身。本实验选用的不同贮藏期的紫鹃茶可能并不是同个批次的茶叶。不同批次的茶叶会因为采摘时间、生长地域、生长条件的差异而造成自身营养功效成分保留的差异。本实验中贮藏期为3年的紫鹃茶可能同其他紫鹃为不同批次茶叶,所以造成试验结果的差异。

表6 苦丁茶抗氧化功能成分测定结果Table 6 Antioxidant components in Kuding tea
2.2 不同成熟度苦丁茶抗氧化功能成分分析
由表6可知,不同成熟度的苦丁茶各个营养功效成分的差异。苦丁茶老叶的茶多酚、叶绿素总量高于苦丁茶嫩叶的;苦丁茶老叶的水浸出物、儿茶素、氨基酸总量和咖啡碱的含量低于嫩叶的。因为茶多酚是茶汤涩味的主要成分,苦丁茶老叶中茶多酚含量较高,所以老叶茶汤与嫩叶茶汤比较,滋味略涩;茶叶的绿色主要是由叶绿素决定的,苦丁茶老叶中叶绿素的总量高于嫩叶,所以前者茶汤的颜色更深,呈现黄绿色,后者为浅绿色;水浸出物、儿茶素、氨基酸总量和咖啡碱又不同程度的决定了茶汤的“浓、强、鲜”,苦丁茶嫩叶中,这几个营养功效成分含量较高,所以其茶汤滋味浓烈,苦味明显。综合比较,苦丁茶嫩叶浸泡后,感官评价好于苦丁茶老叶。
2.3 紫鹃茶提取物制备的单因素试验
由图1可见,表示花青素含量的ΔA值随着微波提取时间的延长而增大,随着乙醇体积分数的升高呈现增长趋势,但在55%时略有下降。但是,ΔA值随着微波功率的增大反而出现减少的趋势,只在360W处略微增长。随着乙醇体积的增加,ΔA值出现下降的趋势。究其机理,微波提取利用了在微波场中,微波吸收能力的差异使得基体物质的某些区域或萃取体系中的某些组分被选择性加热,从而使得被萃取物质从基体或体系中分离,进入到具有较小介电常数、微波吸收能力相对较差的萃取溶剂中[3]。微波提取时间的延长利于紫鹃茶粉中花青素的溶出,但时间过长会造成溶剂温度的升高和挥发,影响目标物的提取,所以应控制在一定范围内。体积分数较少乙醇不宜于花青素的溶出,而且后续的过滤、干燥等操作困难且费时。其原因可能在于水的极性比较大,当它作为溶剂时,容易浸提出蛋白质和一些糖类物质,因此造成后续处理的困难,但乙醇体积分数过高又会增加杂质的浸出量,影响结果。微波功率过大,会破坏花青素的结构,使其分解,造成提取率的下降,当微波功率增加到一定范围时,花青素的含量变化趋于平缓。关于料液比对紫鹃茶粉中花青素提取率的影响,原因在于,溶剂与茶粉构成的体系中,茶粉所占的比例越大,花青素提取率就越高。综上所述,乙醇体积分数、提取时间、微波功率、液料比均对紫鹃茶粉花青素的提取有着重要的影响。

图1 乙醇体积分数、提取时间、微波功率、料液比对紫鹃茶花青素提取率的影响Fig.1 Effects of ethanol concentration, extraction duration, microwave output power, and liquid-to-solid ratio on anthocyanin extraction rate from Zijuan Pu-erh tea
2.4 紫鹃茶提取物制备的正交试验
由表7、8可知,影响超微紫鹃茶提取物花青素微波辅助提取效果的各因素主次关系为:液料比>乙醇体积分数>提取时间>微波功率。最佳条件为乙醇体积分数65%、微波功率540W、提取时间50s、液料比10:1,即为A3B3C2D1。正交试验方差分析结果表明,修正模型的P值为0,小于0.05,说明正交试验模型适用,乙醇体积分数、微波功率、提取时间、液料比的P值均小于0.01,对花青素提取的影响达到极显著水平。按照最优提取方案提取超微紫鹃茶粉中花青素,多次测定花青素含量,ΔA值均在0.9以上。将提取液进一步浓缩,冷冻干燥得到花青素粗提物干粉,提取率为19.5%。
2.5 紫鹃茶粗提物干粉的成分测定

表7 紫鹃茶提取物制备正交试验设计及结果Table 7 Orthogonal array design and corresponding experimental results for optimizing Zijuan Pu-erh tea extraction

表8 紫鹃茶提取物制备正交试验方差分析表Table 8 Variance analysis of anthocyanin extraction rate from Zijuan Pu-erh tea with various extraction conditions

表9 超微紫鹃茶粉及紫鹃茶粗提物干粉成分测定结果Table 9 Antioxidant components in Zijuan tea powder and extract
由表9数据可以得出,紫鹃茶提取物中的功效成分含量远高于超微紫鹃茶粉,而且各个功效成分的提取率均在30%以上,其中茶黄素的提取率达到69.982%。茶黄素是一类多酚羟基具茶骈酚酮结构的物质,具有“软黄金”之称。经过临床试验,验证茶黄素具有调节血脂、预防心血管疾病的功效,而且无毒副作用。茶黄素不但能与肠道中的胆固醇结合减少食物中胆固醇的吸收,还能抑制人体自身胆固醇的合成,广泛应用于生产上并制成有调节血脂保健功能的保健食品,市场前景十分广阔[14]。本实验所得粗提物中茶黄素含量较高,为后序将其用于强化苦荞茶保健功能提供了科学依据。
2.6 苦丁茶提取物制备的单因素试验
图2表明,苦丁茶黄酮提取率随着微波提取时间的延长而增大,但在120~150s处略下降;随着乙醇体积分数的增大提取率增加,但在95%处下降;提取率随着微波功率的增大反而出现减少的趋势,在360~540W之间提取率变化不大;料液比在1:30处,提取率最高。究其机理,微波提取时间的延长利于苦丁茶黄酮的浸出,但时间过长会造成溶剂内部温度的升高,目标物提取率反而下降。试验结果表明:低浓度的乙醇不益于黄酮的溶出,这与毛莉娟等[17]的研究结果相近。微波功率过大,会破坏苦丁茶黄酮的结构,使其中的活性成分被破坏,杂质溶出量增加。随着料液比值的增大,提取率略微增长,在1:30处时提取率最高。综合考虑提取量、溶剂用量、后续处理等因素,不宜选择较大的料液比。综上所述,乙醇体积分数、提取时间、微波功率、液料比均对苦丁茶粉黄酮类物质的提取有着重要的影响。
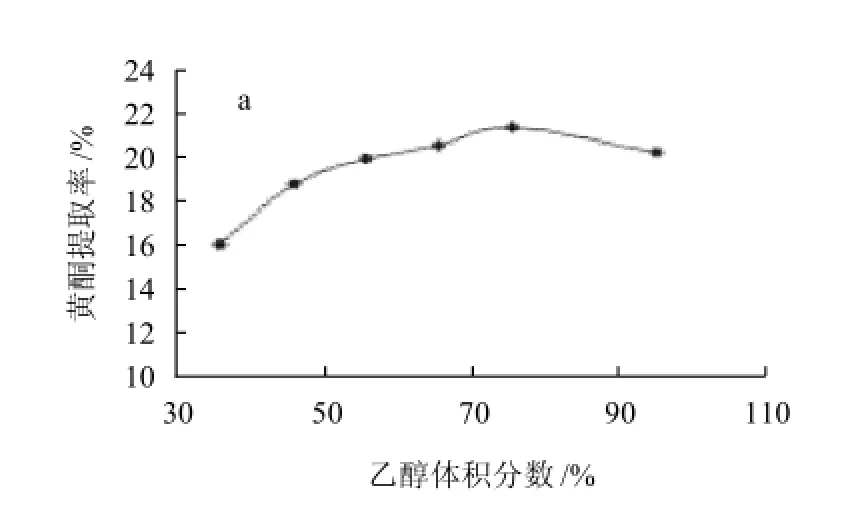

图2 乙醇体积分数(a)、提取时间(b)、微波功率(c)和料液比(d)对苦丁茶黄酮提取率的影响Fig.2 Effects of ethanol volume, extraction duration, microwave power, and liquid to solid ratio on Kuding tea flavonidos extraction rate
2.7 苦丁茶提取物制备正交试验
由表10、11可知,影响超微苦丁茶粉黄酮微波辅助提取效果的各因素主次关系为:液料比>乙醇体积分数>提取时间>微波功率。最佳条件为乙醇体积分数55%、微波功率360W、提取时间120s、液料比为25:1,即A2B1C2D3。正交试验方差分析结果表明,修正模型的P值为0,小于0.05,说明正交试验模型适用,乙醇体积分数、微波功率、液料比、提取时间4个因素的P小于0.01,对黄酮提取率的影响均达极显著水平。按照最优提取方案提取超微苦丁茶粉中黄酮类物质,提取次数为2次,测得黄酮提取率为30.79%。将提取液进一步浓缩,冷冻干燥得到黄酮类粗提物干粉,提取率为3.57%。
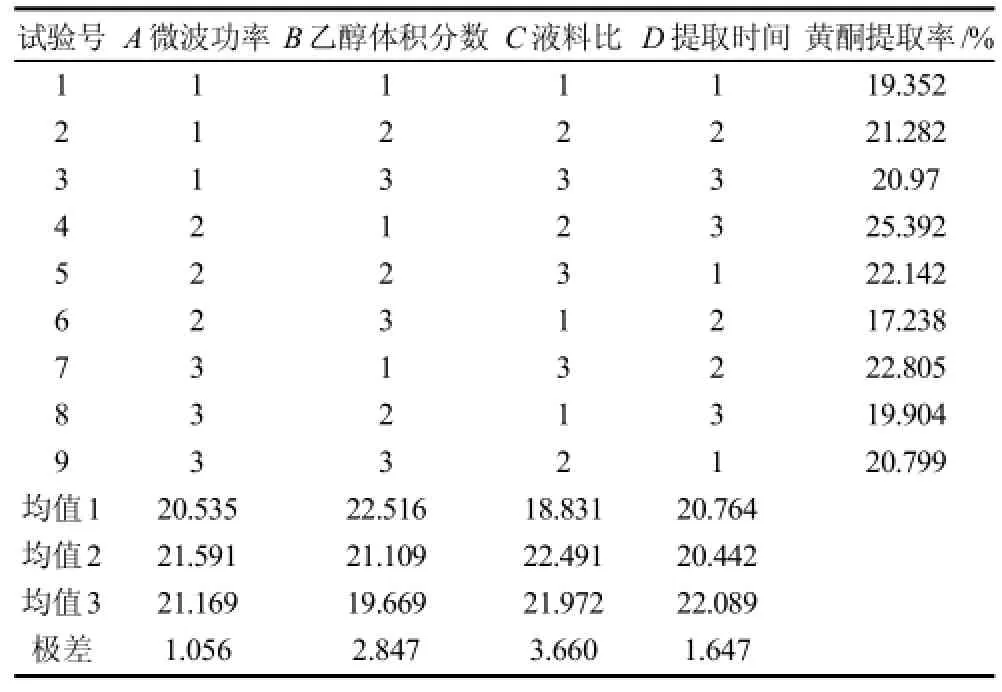
表10 苦丁茶提取物制备正交试验设计及结果Table 10 Orthogonal array design and corresponding experimental results for optimizing Kuding tea extraction

表11 苦丁茶提取物制备正交试验方差分析表Table 11 Variance analysis of flavonoids extraction rate from Kuding tea with various extraction conditions
2.8 苦丁茶老叶、嫩叶超微粉及黄酮粗提物功能成分测定
根据表12所示,苦丁茶老叶超微粉、嫩叶超微粉、老叶提取物、嫩叶提取物,它们所含有的营养成分含量不同。老叶超微茶粉中的水浸出物、茶多酚、咖啡碱、儿茶素、氨基酸总量高于老叶原叶,叶绿素含量略低于老叶原叶;嫩叶超微粉中的叶绿素、咖啡碱以及氨基酸总量均低于嫩叶原叶,茶多酚、儿茶素总量高于嫩叶原叶,水浸出物含量变化不大。这说明,苦丁茶超微茶粉仍保留着原茶的品质特征。老叶提取物、嫩叶提取物中的叶绿素含量低于超微茶粉,这是由于在提取物的制备过程中,涉及到浓缩干燥等步骤,造成了叶绿素的损失[18-19];其他营养成分则显著高于超微茶粉。
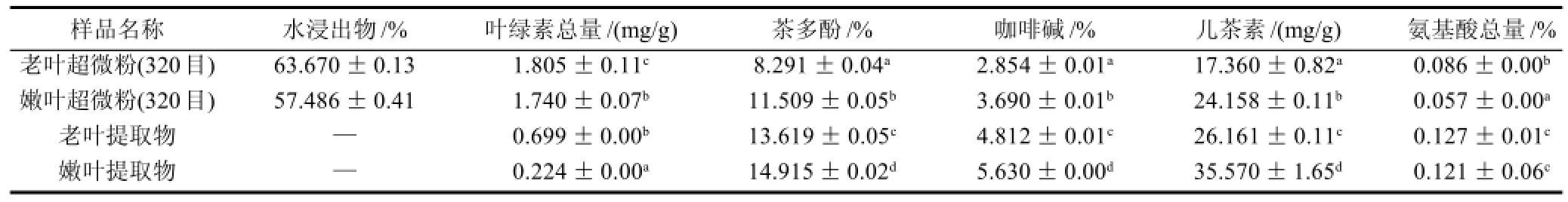
表12 苦丁茶功能成分测定结果Table 12 Nutritional and functional components in young leaf Kuding tea, old leaf Kuding tea and their superfine powders
3 结 论
3.1 不同贮藏期对紫鹃茶及其超微茶粉的品质有着重要影响。苦丁茶嫩叶的品质好于苦丁茶老叶。
3.2 紫鹃茶提取物最佳工艺条件为乙醇体积分数65%、微波功率540W、提取时间50s、液料比为10:1,其提取物富含花青素、茶多酚、茶黄素等功效成分;苦丁茶提取物最佳工艺条件为乙醇体积分数55%、微波功率360W、提取时间120s、液料比25:1,其提取物苦味浓烈,富含黄酮、叶绿素、茶多酚等功效成分。紫鹃茶和苦丁茶提取物均可作为苦荞茶风味与功能强化用基料。
[1] 尹礼国, 钟耕, 闵燕萍. 苦荞保健茶开发研究[J]. 粮食与油脂, 2003 (7): 6-8.
[2] 肖诗明. 加工方法对苦荞麦粉营养成分影响的研究[J]. 粮食与饲料工业, 1999(1): 48-49.
[3] 魏蕾, 吕佳飞, 李志州. 花青素的提取纯化、抗氧化能力及功用方面的研究进展[J]. 氨基酸和生物资源, 2009, 31(4): 83-86.
[4] 高爱红, 龚永新, 童华荣. 苦丁茶的开发利用研究进展[J]. 食品研究与开发, 2003, 24(6): 47-50.
[5] 任俊, 曹飞, 卢金珍. 微波辅助有机溶剂法提取葡萄籽中原花青素的工艺研究[J]. 保鲜与加工, 2010, 4(10): 44-47.
[6] 郭焰, 黄文书, 赵靖靖, 等. 玫瑰花青素的微波法辅助提取工艺研究[J]. 中国食物与营养, 2009(12): 42-44.
[7] 王少波, 杜永峰, 姚秉华. pH示差法测定黑豆皮中的花青素[J]. 化学分析计量, 2008, 17(1): 46-47.
[8] 赵尔丰, 高畅, 高欣, 等. 酶-超声波辅助提取蓝莓果渣中花青素的工艺研究[J]. 东北农业大学学报, 2010, 41(4): 98-102.
[9] 冉旭, 刘学文, 王文贤. 苦丁茶中总黄酮的微波辅助提取工艺研究[J]. 安徽农业科学, 2008, 36(21): 9133-9134.
[10] 李建法, 胡六江, 吕金, 等. 苦丁茶黄酮类化合物的提取与分析[J].浙江林业科技, 2005, 25(1): 31-33.
[11] 何翔, 黄荣增, 范彦博, 等. 苦丁茶总黄酮不同提取方法的比较[J].湖北中医杂志, 2010, 32(4): 74-75.
[12] 高飞虎, 袁林颖, 张玲. 超微绿茶粉贮藏过程中主要内含成分变化的研究[J]. 农产品加工: 创新版, 2010(3): 49-51.
[13] FITZPATRICK J O, AHRNE L. Food powder handling and processing: Industry problems, knowledge barriers and research opportunities[J]. Chemical Engineering and Processing, 2005, 44(2): 209-214.
[14] 谭和平, 叶善蓉, 陈丽, 等. 茶叶中色素的测试方法概述[J]. 中国测试, 2009, 35(2): 78-82.
[15] ROBERTS E A H, SMITH R F. Spectrophotometric measurements of theaflavins and thearubisins in black tea liquors in assessoreats of quality of teas[J]. Analyst, 1961, 86: 94-98.
[16] OWOUR P O. Changes in theaflavin composition and astringency during black tea fermentation[J]. Food Chemaistry, 1994, 51(3): 251-254.
[17] 毛莉娟, 刘学文, 冉旭. 苦丁茶中黄酮的提取工艺[J]. 食品科技, 2002 (11): 18-24.
[18] METERC D, PETERMANN M, WEIDNER E. Extraction of green tea and drying with a high pressure sprayprocess[J]. Hemuska Industrua, 2007, 61(5): 222-228.
[19] CHEONM J, JUN H S, CHEON B S, et al. Functional properties of raw and cooked pork patties with added irradiated, freeze-dried green tea leaf extract powder during storage at 4 ℃[J]. Meat Science, 2003, 64 (1): 13-17.
Extraction of Flavor and Functional Components from Zijuan Pu-erh Tea and Kuding Tea
SUI Xiu-fang1,WANG Yu-zhu2,HUANG Tao3,QIN Li-kang1,*
(1. College of Life Science, Guizhou University, Guiyang 550025, China;2. Second Experimental Middle School of Liupanshui, Liupanshui 553001, China;3. Liupanshui Three Mountain Food Company, Liupanshui 553001, China)
In this study, the functional and flavor components in antihypertensive Zijuan Pu-erh tea and bitter Kuding tea, which can be added to whole buckwheat tea to compensate their deficiency, were extracted by microwave-assisted organic solvent extraction. The results showed that Zijuan Pu-erh tea samples stored for different times exhibited a significant difference in all investigated functional components except theaflavins (P<0.05). Nutritional ingredients significantly differed among young leaf Kuding tea, old leaf Kuding tea and their superfine powders (P<0.05). Orthogonal array based optimizations showed that the optimum extraction conditions of Zijuan Pu-erh tea were 65% ethanol concentration, 540 W microwave output power, 50 s extraction time and 10:1 liquid-to-solid ratio and the resulting extract was rich in anthocyanins (ΔA = 0.925) and contained 27.709% polyphenol, 0.707% theaflavins (TF), 15% thearubigins(TR), 259.735 mg/g total catechinsand 7.053% caffeine. The optimum extraction conditions of Kuding tea were 55% ethanol concentration, 360 W microwave output power, 120 s extraction time and 25:1 liquid-to-solid ratio, and the extract obtained under the optimum conditions tasted strongly bitter and contained 30.79% flavonidos, 0.699 mg/g chlorophyll, 13.619% tea polyphenol, 4.812% caffeine, and 26.161 mg/g total catechins. Together, these findings demonstrate that both tea extracts can be used to enhance the flavor and function of buckwheat tea.
buckwheat;Zijuan Pu-erh tea;Kuding tea;functional components
R284.2;TS272
:A
1002-6630(2011)20-0072-07
2011-06-14
贵阳市生物重大专项([2010]筑科农合同字第8-1号);贵州省科技厅农业攻关项目(NY字[2011]3057号)
隋秀芳(1987—),女,硕士研究生,研究方向为食品加工与安全。E-mail:sxf0503@126.com
*通信作者:秦礼康(1965—),男,教授,博士,研究方向为食品加工与安全。E-mail:likangqin@126.com

