Leigh综合征的MRI表现
陈志晔 综述 马 林 审校
Leigh综合征(Leigh syndrome, LS)是一种少见的、病因不明的X连锁常染色体隐性遗传性疾病,常可同时累及脑部和脊髓,故又称为亚急性坏死性脑脊髓炎。目前认为主要是染色体突变累及电子链复合物(electron transport chain complexes, COs)Ⅰ~Ⅴ导致复合物缺陷所致[1,2]。依发病年龄可分为新生儿型、经典婴儿型及少年型[3],成人罕见[4]。大部分患者发病年龄在6岁以前,通常在2岁时起病,无性别及种族倾向。在临床诊断中,通常需要行肌肉或脑组织活检、生化或基因检测来确诊。随着影像学技术的发展,尤其是磁共振功能成像,可以从分子水平评估病变的特征,本文综述Leigh综合征的MRI表现,旨在提高对Leigh综合征的影像学认识及诊断。
1 Leigh综合征常规MRI影像表现
Leigh综合征病变通常呈对称性分布于双侧壳核及导水管周围灰质。发生在基底节区的常见部位为纹状体(壳核后部及尾状核头常见)及苍白球;发生在脑干的常见部位为导水管周围灰质、脑桥、延髓。另外,病变也可见于丘脑(尤其是背内侧核)和小脑齿状核,但乳头体通常不受累。Leigh综合征不常见的部位包括大脑及小脑白质。MRI主要表现为长T1长T2信号影,T2液体衰减反转恢复序列( fl uid attenuated inversion recovery, FLAIR)为高信号影,增强扫描通常不强化(图1)。由于出血或髓鞘裂解产物通常也可表现为短T1信号影。病变的分布呈对称性分布,脊髓的病变主要位于导水管周围灰质。信号特点主要为长T1长T2信号,T2FLAIR为高信号[5-8],此外,3D等体素薄层T2FLAIR(图1C)的应用可以更好地显示病变,并进行三维重建,所以T2FLAIR对于Leigh综合征病变的诊断有一定的价值。
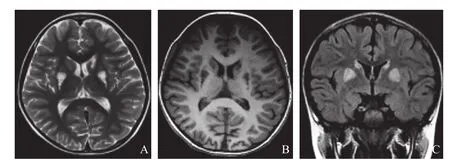

图1 Leigh综合征常规MRI表现。A.横轴位T2WI;B.横轴位T1WI;C.冠状位T2FLAIR;D.矢状位T2FLAIR;E.横轴位增强T1WI。病变位于双侧壳核后部、双侧尾状核头部及体部、双侧丘脑,呈长T1长T2信号影,边界清楚
2 Leigh综合征脑部DWI表现
扩散加权成像(diffusion weighted imaging, DWI)是一种在活体水平探测生物组织水分子扩散运动的无创技术,通过测量施加扩散敏感梯度场前后组织发生的信号强度变化来探测组织中水分子扩散的状态,可间接反映组织微动态和微结构的变化,并且DWI还可对病变进行表观扩散系数(apparent diffusion coef fi cient, ADC)值的量化分析。Leigh综合征患者在急性期通常表现为高信号,提示水分子扩散受限,细胞毒性水肿[9],但是也有文献报道病变在发病后13个月和2年后DWI仍表现为高信号[10],但部分病变为等信号(图2),信号的不一致性说明病变的时间分布多样性。DWI也可以用来鉴别线粒体脑肌病伴乳酸血症和卒中样发作(mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes, MELAS)综合征,MELAS综合征在急性期通常表现为血管源性水肿,DWI上呈等或低信号(等或高ADC值)[11,12],尽管有研究认为血管源性水肿周围也可演变为细胞毒性水肿,在DWI表现为高信号[13],但DWI对于Leigh综合征与MELAS综合征的鉴别有一定的价值。

图2 横轴位DWI,双侧尾状核、双侧壳核及丘脑病变呈明显高信号影
3 Leigh综合征脑部磁共振波谱成像表现
磁共振波谱成像(magnetic resonance spectroscopy,MRS)对于Leigh综合征的诊断具有较高的价值。Leigh综合征患者MRS常表现为Cho峰升高和NAA峰减低,在病变、脑脊液或看似正常的脑实质内可见乳酸双峰[14-16](图3A~C);延髓病变MRS提示巨大脂峰(图3D),说明此病变内发生坏死而未发生无氧酵解。MRS可为线粒体脑病的诊断提供间接的代谢信息,而且无创、无辐射,可以定量监测脑组织代谢变化,但MRS对于线粒体脑病的不同亚型的鉴别有待于进一步研究。
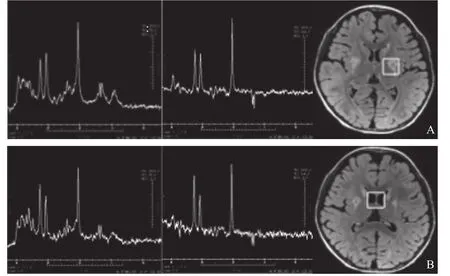

图3 Leigh综合征磁共振波谱成像。A.单体素PRESS成像,感兴趣区放置在左侧壳核后部,分别进行短TE(35ms)及长TE(144ms)扫描,提示N-乙酰门冬氨酸(NAA)峰、肌酸(Cr峰)及胆碱(Cho)峰未见异常,1.33ppm处可见乳酸双峰(TE 35ms为直立双峰,TE 144ms为倒置双峰);B.单体素PRESS成像,感兴趣区放置在侧脑室区,1.33ppm处可见乳酸双峰,胆碱峰略升高;C.单体素PRESS成像,感兴趣区放置在左侧额叶白质区,胆碱峰略升高,1.33ppm处未见乳酸峰显示;D.单体素PRESS成像,感兴趣区放置在脊髓病变处,1.2ppm处可见巨大脂峰
4.Leigh综合征脑部灌注表现
灌注是指单位组织的营养性血液供应,人脑的正常神经生理及高级活动要求以一定的血流灌注为基础,在病理情况下,脑灌注异常可以用来早期诊断并在治疗中动态观察脑组织受损情况。因此,活体脑血流灌注的检测具有重要的临床意义。常用的磁共振灌注成像主要包括动态磁敏感增强磁共振灌注加权成像(dynamic susceptibility contrast MR perfusion weighted imaging, DSC-PWI)和流动敏感交替反转恢复( flowsensitive alternating inversion recovery, FAIR),前者主要是利用团注对比剂通过毛细血管网时,引起周围组织局部磁场短暂变化所致的磁共振信号强度变化的成像技术,动态测量对比剂首次通过受检组织时引起组织内磁场信号的改变来计算血流动力学参数[17],通常患者需要团注对比剂。而FAIR主要是通过磁化标记动脉血液中的水分子作为内源性示踪剂来测量脑血流量,根据标记方式不同可分为连续性动脉自旋标记(continuous arterial spin labeling, CASL)和脉冲式动脉自旋标记(pulsed arterial spin labeling, PASL)[18],其成像原理主要是在成像层面近端施加非选择性的反转脉冲,使血液中的质子磁化矢量反转,经过一定的反转恢复时间,当标记的血流入成像层面时成像,得到标记后的图像;然后保持参数不变施加选择性的反转脉冲对相同层面成像,得到对比图像,最后根据两种不同标记下的质子流入信号的改变计算脑血流量图(cerebral blood flow, CBF)[17,19]。CBF 图(图 4)通常会提示双侧壳核及尾状核病变呈高灌注,但是对于其他病变区域如双侧丘脑背内侧核并没有显示高灌注,推测可能与病变所处的不同时期有关;另外,高灌注的基础可能与血管增生有关[20]。FAIR空间分辨率相对较差,因此对于低灌注区域的显示相对于DSC-PWI较差,且受扫描层数的限制,不能进行全脑扫描。然而,FAIR作为一种新的无创性的磁共振灌注成像技术,可以定量测量脑血流量,适用于对比剂过敏及儿童患者,对于Leigh综合征患者病变的检出及灌注情况的判断是一种较为安全可行的选择。

图4 流动敏感交替反转恢复(FAIR)灌注成像,提示双侧壳核及尾状核病变呈高灌注
5.Leigh综合征累及视路
Leigh综合征常见的视觉系统病变表现为视神经萎缩,在发病早期很难发现视力丧失[21]。组织病理学研究发现其视觉系统受累为视网膜节细胞丢失,乳头黄斑束(papillomacular bundle)神经纤维板层脱落,视路髓磷脂(myelin)和轴索丢失(通常位于中央,而周围可免于受累)[21,22]。Hayashi等[23]报道了1例伴有线粒体DNA突变且母系遗传的Leigh综合征患者表现为选择性的视网膜节细胞丢失及相应的视神经颞侧萎缩。3D T1-FSPGR序列可以行三维扫描,并进行三维曲面重建,可以全程显示视神经眶内段、管内段及视交叉的形态(图5A)。三维T2FLAIR同样可以进行三维重建,观察视路的信号特点(图5B)。进一步的视路DTI分析提示双侧视神经眶内段、管内段、视交叉、视束、外侧膝状体及视辐射FA值的变化,纤维束的粗细及连接性(图5C)可以早于常规影像发现双侧视路隐匿性病变,且可以进行定位及量化分析。因此,对于Leigh综合征患者视路三维T2FLAIR及DTI分析可以敏感地检出视路病变,并可以进行疗效及预后评价。
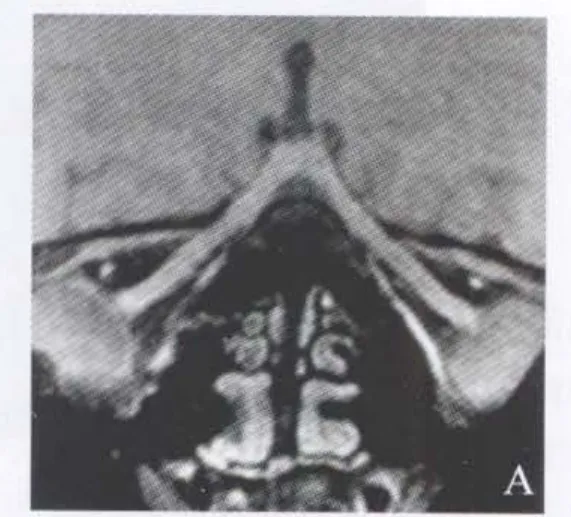
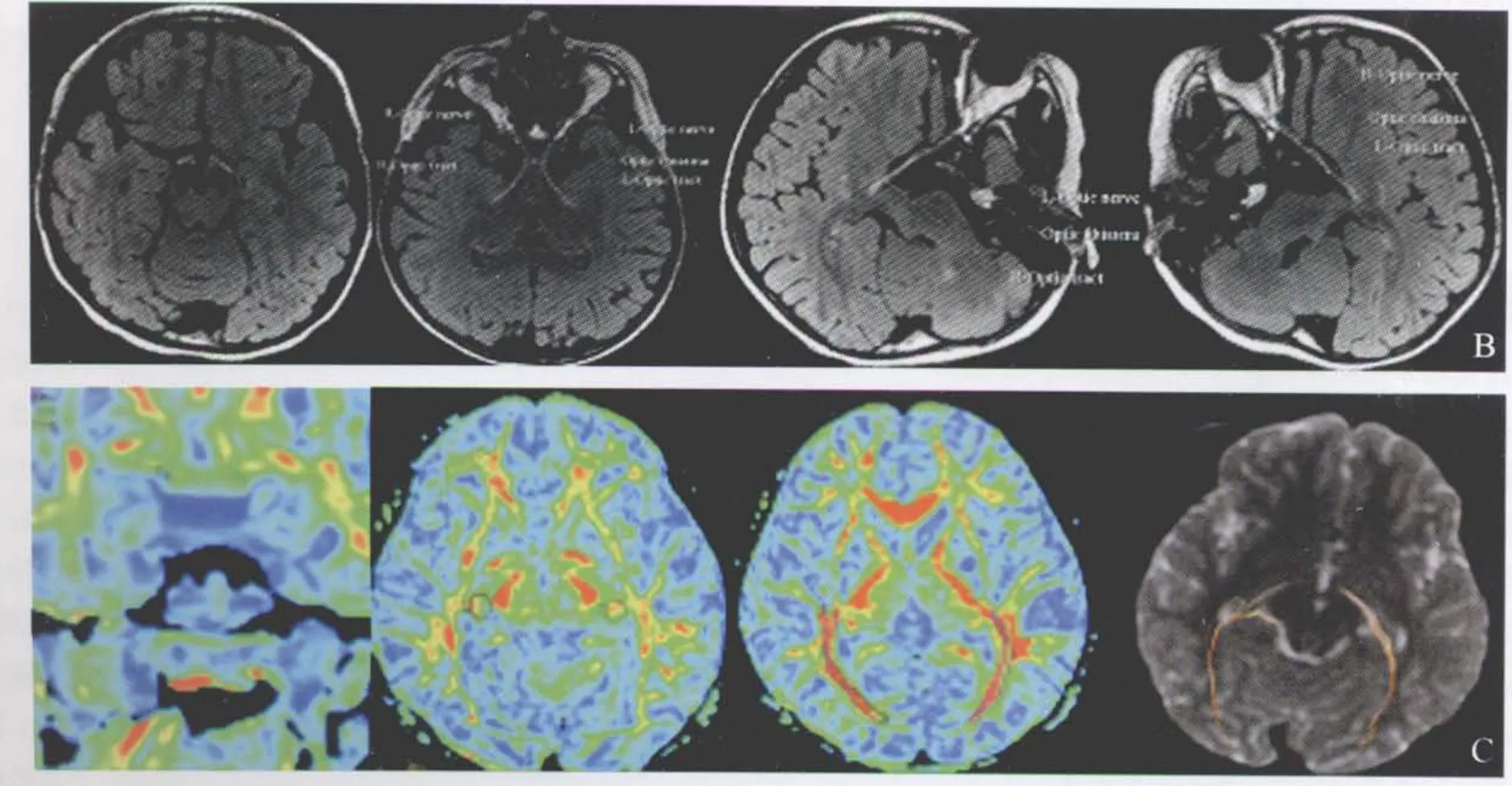
图5 Leigh综合征患者视觉通路MRI表现。A.3D T1-FSPGR成像进行曲面重建,显示双侧视神经形态及走形未见异常;B.3D T2-FLAIR成像显示双视束呈高信号,外侧膝状体及双侧视辐射未见异常信号;C.视路DTI提示双侧视神经眶内段、管内段、视交叉FA值未见异常,而双侧视束、外侧膝状体及视辐射FA值减低,双侧视辐射纤维束变细
总之,Leigh综合征可以同时累及双侧壳核、尾状核、丘脑背内侧核、脊髓及视路。DWI、MRS、FAIR及视路DTI可以用来敏感准确地检出Leigh综合征的脑部、脊髓及视路病变,并进行量化分析。综合运用多种MRI成像新技术可以全面评价Leigh综合征中枢神经系统受累情况,对于更好地理解发病机制、早期诊断、病情监测及预后评价具有重要意义[24]。
[1] Benit P, Slama A, Cartault F, et al. Mutant NDUFS3 subunit of mitochondrial complex I causes Leigh syndrome. J Med Genet, 2004, 41(1): 14-17.
[2] Naess K, Freyer C, Bruhn H, et al. MtDNA mutations are a common cause of severe disease phenotypes in children with Leigh syndrome. Biochim Biophys Acta, 2009,1787(5): 484-490.
[3] Ashra fi MR, Ghofrani M, Ghojevand N. Leigh syndrome:clinical and paraclinical study. Acta Medica Iranica, 2002,40(4): 236-240.
[4] Sakushima K, Tsuji-Akimoto S, Niino M, et al. Adult leigh disease without failure to thrive. Neurologist, 2011, 17(4):222-227.
[5] Koch TK, Yee MH, Hutchinson HT, et al. Magnetic resonance imaging in subacute necrotizing encephalomyelopathy(Leigh's disease). Ann Neurol, 1986, 19(6): 605-607.
[6] Davis PC, Hoffman JC Jr, Braun IF, et al. MR of Leigh's disease (subacute necrotizing encephalomyelopathy). Am J Neuroradiol, 1987, 8(1): 71-75.
[7] Kissel JT, Kolkin S, Chakeres D, et al. Magnetic resonance imaging in a case of autopsy-proved adult subacute necrotizing encephalomyelopathy (Leigh's disease). Arch Neurol, 1987, 44(5): 563-566.
[8] Ghosh D, Pradhan S. Antemortem diagnosis of Leigh's disease: role of magnetic resonance studies. Indian J Pediatr, 1996, 63(5): 683-689.
[9] Cakmakci H, Pekcevik Y, Yis U, et al. Diagnostic value of proton MR spectroscopy and diffusion-weighted MR imaging in childhood inherited neurometabolic brain diseases and review of the literature. Eur J Radiol, 2010,74(3): e161-171.
[10] Sakai Y, Kira R, Torisu H, et al. Persistent diffusion abnormalities in the brain stem of three children with mitochondrial diseases. Am J Neuroradiol, 2006, 27(9):1924-1926.
[11] Yoneda M, Maeda M, Kimura H, et al. Vasogenic edema on MELAS: a serial study with diffusion-weighted MR imaging. Neurology, 1999, 53(9): 2182-2184.
[12] Yonemura K, Hasegawa Y, Kimura K, et al. Diffusionweighted MR imaging in a case of mitochondrial myopathy,encephalopathy, lactic acidosis, and strokelike episodes.Am J Neuroradiol, 2001, 22(2):269-272.
[13] Sakamoto S, Nakahara T, Hamasaki O, et al. A case of MELAS showing both cytotoxic and vasogenic edema on serial diffusion-weighted imaging. European Journal of Radiology Extra, 2003, 45(2): 57-63.
[14] Sijens PE, Smit GP, Rodiger LA, et al. MR spectroscopy of the brain in Leigh syndrome. Brain Dev, 2008, 30(9):579-583.
[15] Krageloh-Mann I, Grodd W, Schoning M, et al. Proton spectroscopy in five patients with Leigh's disease and mitochondrial enzyme de fi ciency. Dev Med Child Neurol,1993, 35(9): 769-776.
[16] Detre JA, Wang ZY, Bogdan AR, et al. Regional variation in brain lactate in Leigh syndrome by localized 1H magnetic resonance spectroscopy. Ann Neurol, 1991, 29(2):218-221.
[17] Zaharchuk G. Theoretical basis of hemodynamic MR imaging techniques to measure cerebral blood volume,cerebral blood flow, and permeability. Am J Neuroradiol,2007, 28(10): 1850-1858.
[18] Wolf RL, Detre JA. Clinical neuroimaging using arterial spin-labeled perfusion magnetic resonance imaging.Neurotherapeutics, 2007, 4(3): 346-359.
[19] Kim SG. Quantification of relative cerebral blood flow change by flow-sensitive alternating inversion recovery(FAIR) technique: application to functional mapping. Magn Reson Med, 1995, 34(3): 293-301.
[20] Leigh D. Subacute necrotizing encephalomyelopathy in an infant. J Neurol Neurosurg Psychiatry, 1951, 14(3):216-221.
[21] Cavanagh JB, Harding BN. Pathogenic factors underlying the lesions in Leigh's disease. Tissue responses to cellular energy deprivation and their clinico-pathological consequences. Brain, 1994, 117 (Pt 6): 1357-1376.
[22] Howard RO, Albert DM. Ocular manifestations of subacute necrotizing encephalomyelopathy (Leigh's disease). Am J Ophthalmol, 1972, 74(3): 386-393.
[23] Hayashi N, Geraghty MT, Green WR. Ocular histopathologic study of a patient with the T 8993-G point mutation in Leigh's syndrome. Ophthalmology, 2000, 107(7):1397-1402.
[24] Lee HF, Tsai CR, Chi CS, et al. Leigh syndrome: clinical and neuroimaging follow-up. Pediatr Neurol, 2009, 40(2):88-93.

