Folin-Ciocalteu比色法测定枳椇果梗多酚含量
向进乐,李志西,郭香凤,李 欢,郑淑彦
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.河南科技大学食品与生物工程学院,河南 洛阳 471003)
Folin-Ciocalteu比色法测定枳椇果梗多酚含量
向进乐1,2,李志西1,*,郭香凤2,李 欢1,郑淑彦1
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.河南科技大学食品与生物工程学院,河南 洛阳 471003)
以没食子酸为标样,研究Folin-Ciocalteu比色法测定枳椇果梗总酚含量的适宜条件。结果表明,枳椇果梗提取物加Folin-Ciocalteu试剂0.6mL、20g/100mL Na2CO3溶液1.5mL,定容至10mL,30℃避光反应60min,测定反应体系在750nm处的吸光度,多酚质量浓度在0~8.47mg/L范围内与吸光度有良好的线性关系。该方法的稳定性、重现性、精密度以及加标回收率的相对标准偏差均符合要求,可用于枳椇果梗多酚含量的测定。
Folin-Ciocalteu法;枳椇果梗;多酚
枳椇为鼠李科枳椇属(Hovenia thunb)植物,又称拐枣、鸡柤子、半甜夜。全世界有三个种,两个变种。我国除东北三省、内蒙古、新疆、宁夏、青海和台湾外,其余各省区均有分布。枳椇属植物始载于《唐本草》,以果实、木汁、木皮入药,现由《中国人民共和国卫生部药品标准·中药材》收载[1]。枳椇属植物多以枳椇子入药,即枳椇干燥成熟的种子,关于枳椇子生物活性成分和生理功能及其作用机制等方面已有诸多报道[1-2]。而关于肉质肥大扭曲、酸甜的枳椇果梗的研究开发鲜见报道,这可能与其个体小、外形扭曲、残渣多、适口性差有关。
目前,国内报道的枳椇果梗初级加工制品有枳椇果汁饮料[3-6]、果酒[7]、果醋[8]和酸乳[9]等产品。本课题组[10]以枳椇果梗为原料,采用液态深层发酵法酿制出风味独特的枳椇果梗酒、果醋,并对枳椇醋的保健功能进行初步研究。发现枳椇醋具有较强的体外抗氧化作用、良好的减肥降脂作用,对急性酒精中毒以及由酒精引起的慢性肝损伤也有很好的预防作用。邹礼根等[11]也发现枳椇果梗水提物具有一定的解酒效果。
对枳椇果梗的化学成分研究也有少量报道。符树根[3]、江庆中[4]等对枳椇果梗和种子质量所占比例和基本化学组成进行研究,枳椇果梗约占总质量的90%,两者基本化学组成差异很大。鲜果梗中含有大量糖分、有机酸、氨基酸和维生素等,其中总糖含量35.13%、还原糖17.23%、总酸390mg/100g、VC 44mg/100g。贾春晓等[12]通过气相色谱-质谱联用(gas chromatographymass spectrometry,GC-MS)对枳椇果梗中有机酸进行分析,鉴定出19种有机酸,其中苹果酸的含量最高,占22.88%;枳椇果梗还含有多种不饱和高级脂肪酸,其中亚麻酸和亚油酸含量分别为5.06%和3.35%。朱炯波等[13]采用蒽酮硫酸比色法对枳椇果梗多糖含量进行分析,枳椇果梗中多糖为13.83%。Yoo等[14]以枳椇果实为原料通过水提、有机溶剂萃取和低压制备色谱技术分离制备出高纯度的二氢杨梅素。
多酚是植物原料的一种重要次生代谢产物,是绝大多数植物性食品和药材的活性成分。枳椇果中含有二氢杨梅素等酚类物质[14-15],但枳椇果梗多酚含量测定的方法尚未见报道。植物多酚含量测定方法较多,包括滴定法、比色法等[16]。Folin-Ciocalteu比色法是Folin-Denis的改进,是目前测定植物多酚含量的最常用方法,但目前报道的不同原料多酚含量测定条件,如检测波长、Folin-Ciocalteu试剂用量、碱液加入量以及显色温度和时间等都有较大差异[16-17]。本研究拟建立Folin-Ciocalteu法测定枳椇果梗多酚含量的适宜条件,以期为枳椇果的进一步研究开发提供参考依据。
1 材料与方法
1.1 材料与试剂
枳椇果 采自西安市临潼区龙河西岸南姚村;没食子酸(纯度≥98%) 成都曼斯特生物科技有限公司;Folin-Ciocalteu试剂 上海荔达生物科技有限公司;甲醇、Na2CO3等常规试剂均为分析纯。
1.2 仪器与设备
UV-2550双光束紫外分光光度计、UVmini 1240单孔紫外分光光度计 日本岛津公司;旋转蒸发仪 上海亚荣生化仪器厂;KH5200B超声清洗机 昆山禾创超声设备有限公司;电子天平 北京塞多利斯天平有限公司;电热恒温水浴锅 北京科伟永兴仪器有限公司;移液器上海大龙医疗设备有限公司。
1.3 方法
1.3.1 对照品溶液与样品溶液的制备
对照品溶液配制:精密称取没食子酸对照品12.1mg加甲醇溶解定容至100mL,得质量浓度121mg/L没食子酸标准溶液。
枳椇果梗多酚溶液的制备:参考吕群金等[18]的方法略有改动。称取干燥的枳椇果梗粉末1.0g加入40mL 70%甲醇溶液,40℃超声提取30min,过滤得滤液。滤渣加入30mL 70%甲醇溶液重复提取2次,合并滤液,减压浓缩定容至25mL作为枳椇果梗多酚样品溶液。
1.3.2 Folin-Ciocalteu法比色条件的选择
1.3.2.1 检测波长的选取[16]
取没食子酸标准溶液和枳椇果梗样品溶液各0.1mL,分别加蒸馏水稀释,加0.5mL Folin-Ciocalteu试剂混匀,3min后加入1.5mL 20g/100mL Na2CO3溶液,加水定容至10mL,室温避光反应120min,以空白为对照,在500~900nm范围内扫描确定最大吸收波长。
1.3.2.2 显色温度和时间的确定[17]
分别取对照品溶液和枳椇果梗样品溶液0.25mL于25mL容量瓶中,加水稀释,加入Folin-Ciocalteu试剂1.25mL混匀,3min后加入20g/100mL Na2CO3溶液3.75mL,加水定容,将各比色试剂混合均匀后,分别于25、30、35、40、45℃条件下水浴避光反应,分别于30、60、90、120、150min时测定吸光度,以考察反应温度和显色时间对显色效果的影响。
1.3.2.3 Folin-Ciocalteu试剂和Na2CO3溶液加入量[17]
取枳椇果梗样品溶液0.1mL,加水稀释,分别加入0.3、0.4、0.5、0.6、0.7mL Folin-Ciocalteu试剂混匀,3min后加入20g/100mL Na2CO3溶液1.5mL,30℃避光反应60min,考察Folin-Ciocalteu试剂用量对吸光度的影响。
取枳椇果梗样品溶液0.1mL,加水稀释,分别加入0.6mL的Folin-Ciocalteu试剂混匀,3min后按1∶1.5、1∶2、1∶2.5、1∶3、1∶3.5的比例加入20g/100mL Na2CO3溶液,30℃避光反应60min,考察Folin-Ciocalteu试剂与Na2CO3溶液比例对吸光度的影响。
1.3.3 标准曲线的绘制[16]
精密吸取1、2、3、4、5、6、7mL没食子酸标准溶液,加水稀释定容于10mL棕色容量瓶得不同质量浓度的标准溶液。分别取1mL不同浓度的对照品溶液加水稀释,加入0.6mL Folin-Ciocalteu试剂混匀,3min后加入20g/100mL Na2CO3溶液1.5mL,30℃避光反应60min,以蒸馏水代替样品为空白,在750nm处测定吸光度,以吸光度为纵坐标,没食子酸溶液质量浓度为横坐标绘制标准曲线。枳椇果梗多酚含量以没食子酸标准品计。
1.3.4 Folin-Ciocalteu法测定枳椇果梗多酚的方法学评价[16]
稳定性实验:取同一枳椇果梗样品溶液按确定的测定条件,分别在样品液与显色剂反应60、90、120、150、180、210min后的不同时间内测定吸光度,以评价该方法在一段时间内的稳定性。
重现性实验:取干燥的枳椇果梗粉末样品5份,依上述样品溶液制备和分析方法,计算结果的相对标准偏差,以评价该方法的重现性。
精密度实验:采用确定的测定方法对同一枳椇果梗提取液测定5次,计算结果的相对标准偏差,以评价该方法的精密度。
加标回收实验:取已知多酚含量的枳椇果梗样品5份,分别加入不同量的没食子酸标准物质,分别测定混合样品显色后的吸光度,计算其回收率和相对标准偏差,以评价该方法的准确度和可靠性。
2 结果与分析
2.1 Folin-Ciocalteu法检测条件的确定
2.1.1 检测波长的确定
多酚物质与Folin-Ciocalteu试剂反应显色是基于Folin-Ciocalteu试剂中的钨钼酸将多酚化合物定量氧化,自身被还原(使W6+变为W5+)生成蓝色的化合物,在680~780nm有较大吸收[16-22]。没食子酸对照品、枳椇果梗提取物与Folin-Ciocalteu显色后的光谱图如图1所示,两者均在750nm左右有最大吸收,故选750nm为检测波长。

图1 没食子酸对照品(a)和枳椇果梗提取物(b)显色后的光谱图Fig.1 Visible absorption spectra of Folin-Ciocalteu reagent in the presence of gallic acid (a) or of Hovenia acerba fruit extract (b)
2.1.2 显色温度和时间的确定

图2 没食子酸对照品不同显色温度和时间的吸光度Fig.2 Absorbance of reaction products between gallic acid and Folin-Ciocalteu reagent at different reaction time points and temperatures
多酚物质与Folin-Ciocalteu试剂反应需要一定温度和反应时间才能显色完全。从图2可知,没食子酸标准溶液在不同温度条件下显色,达到最大吸光度的时间有较大差异。温度越高达到最大吸光度的时间越短。35~45℃时,显色30min吸光度就达到最大,30min后吸光度下降明显。说明温度高能加快显色进程,但是显色体系的稳定性较差。25~30℃显色,反应30min吸光度达到较大值,随着反应时间的延长吸光度增加,60~120min达到最大值,显色体系稳定性很好。但在25℃,吸光度偏低,反应时间长。
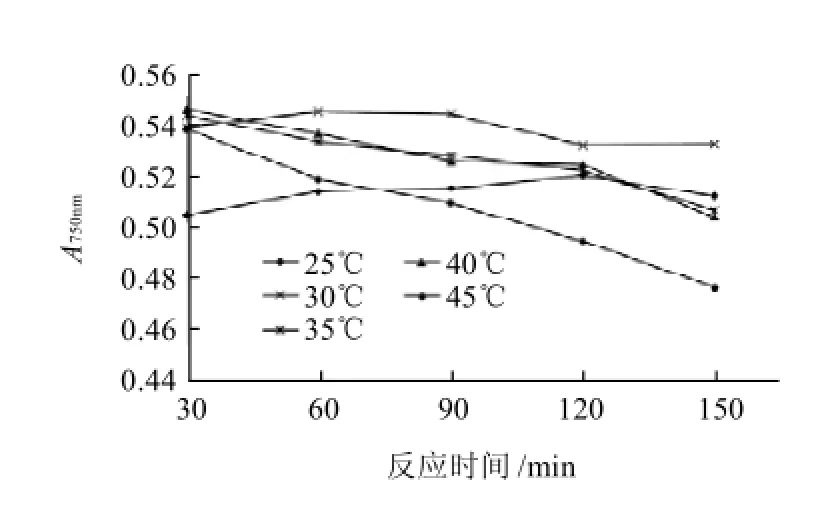
图3 枳椇样品不同显色温度和时间的吸光度Fig.3 Absorbance of reaction products between Hovenia acerba fruit extract and Folin-Ciocalteu reagent at different reaction time points and temperatures
图3为不同显色温度和时间条件下,枳椇果梗样品溶液显色后的吸光度的变化。可以看出,温度低,反应慢,吸光度小;温度高,反应快,达到最大吸光度的时间短,但是反应体系很不稳定,而且,温度越高,越不稳定。30℃时,随着时间的延长,吸光度升高,在60~120min处于最大值。因此,确定Folin-Ciocalteu法测定枳椇多酚含量的显色温度为30℃,显色时间为60min。
比较图2、3发现,枳椇果梗样品与没食子酸对照品在不同温度和时间后显色结果有相同的趋势。故在其他显色条件的确定中,只以枳椇果梗样品溶液为研究对象。
2.1.3 Folin-Ciocalteu显色剂和Na2CO3加入量

图4 Folin-Ciocalteu试剂加入量对吸光度的影响Fig.4 Effect of Folin-Ciocalteu reagent amount on the absorbance of reaction products at 750 nm
由图4可以看出,Folin-Ciocalteu试剂用量在0.3~0.6mL内,随着显色剂用量的增加,测得的吸光度增加,当显色剂的用量超过0.6mL后,吸光度的变化不明显。因此,选择Folin-Ciocalteu试剂加入量为0.6mL。
Folin-Ciocalteu试剂与酚类化合物反应的必须在碱性条件下才可以显色,反应体系中Na2CO3溶液是显色的支持介质。Na2CO3溶液与Folin-Ciocalteu试剂的比例会影响体系的显色效果[17]。由图5可以看出,当Na2CO3溶液用量增加时,吸光度升高,当Na2CO3溶液与Folin-Ciocalteu试剂比例增加到2.5∶1时,吸光度最大。但进一步增加Na2CO3溶液吸光度反而降低,说明体系中碱液的用量不宜过大。可能是碱性过强,显色体系不稳定造成吸光度的降低。因此,确定Folin-Ciocalteu试剂与20g/100mL的Na2CO3溶液的体积比为1∶2.5。

图5 Na2CO3与Folin-Ciocalteu的体积倍数对吸光度的影响Fig.5 Effect of sodium carbonate amount on the absorbance of reaction products at 750 nm
2.1.4 标准曲线的绘制
按照确定的检测条件绘制标准曲线,得线性回归方程为y=0.1192χ+0.011,相关系数R2=0.9995。没食子酸质量浓度在0~8.47mg/L范围内,吸光度与质量浓度呈良好的线性关系。
2.2 Folin-Ciocalteu法测定枳椇果梗多酚方法学评价
2.2.1 稳定性实验
同一样品在不同时间的吸光度见表1,相对标准偏差为0.55%。说明该方法在一定时间内稳定性较好。
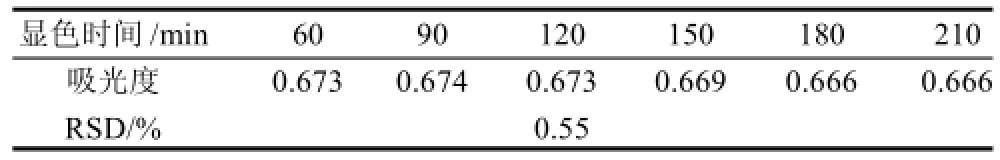
表1 不同时间点测定样品吸光度Table 1 Stability test for the optimized Folin-Ciocalteu method
2.2.2 重现性实验

表2 5份样品测得的多酚含量Table 2 Repeatability test for the optimized Folin-Ciocalteu method
称取5份枳椇果梗样品测得多酚含量如表2,相对标准偏差为1.95%。说明该方法的重现性较好。
2.2.3 精密度实验
同一样品测定5次,吸光度分别为0.676、0.673、0.657、0.671、0.665。相对标准偏差为1.13%,说明该方法具有较高的精密,能满足枳椇果梗多酚测定。
2.2.4 加标回收实验
对Folin-Ciocalteu比色法测定枳椇果梗多酚进行加标回收实验,见表3。5次加标回收最高回收率为101.9%,最低为96.3%,平均为99.9%,相对标准偏差为2.22%。说明Folin-Ciocalteu法测定枳椇果梗多酚含量具有一定的可靠性。

表3 加标回收实验Table 3 Spike recovery test for the optimized Folin-Ciocalteu method
3 结论与讨论
Folin-Ciocalteu比色法测定枳椇果梗中总酚含量的适宜条件为枳椇果梗提取液加Folin-Ciocalteu试剂0.6mL、20g/100mL Na2CO3溶液1.5mL,30℃避光反应60min后在750nm波长处测定。
Folin-Ciocalteu比色法测定枳椇果梗中总酚在前人研究[17-22]的基础上有所该改进。该方法缩短了显色反应时间,同时具有操作简单、稳定性好、精密度高、准确可靠等优点。Folin-Ciocalteu比色法能够用于枳椇果梗多酚含量的测定。
枳椇果梗除具有高糖分以及较高的营养价值外,多酚物含量也较高,枳椇果梗具有很好的开发利用价值。实验测得多酚含量为1.38%,多酚物质可能是枳椇果梗及其加工制品的主要生理活性物质之一,本实验采用HPLC-DAD,通过标准品对照发现枳椇果梗提取物中含有二氢杨梅素、没食子酸等酚类物质。
[1]张晶, 李慧萍, 弓晓杰, 等. 枳椇属植物化学成分及生物活性研究进展[J]. 天然产物研究与开发, 2006(18)∶ 674-680.
[2]嵇扬, 陆红. 枳椇子研究进展[J]. 中草药, 2002, 39(9)∶ 5-7.
[3]符树根, 江庆中. 枳椇果特性与饮料开发研究[J]. 中国林副特产, 2007 (6)∶ 21-23.
[4]江庆中, 符树根, 况小宝, 等. 枳椇综合利用研究[J]. 江西林业科技,2004(6)∶ 3-6.
[5]黎继烈, 吴耀辉. 枳椇保健饮料的研制[J]. 食品与机械, 2004, 20(6)∶54-56.
[6]李维新, 何志刚, 林晓姿, 等. 拐枣的营养保健功能及其果汁饮料的研制[J]. 食品科学, 2005, 26(8)∶ 249-251.
[7]黎继烈. 枳椇果酒的酿制工艺[J]. 食品与发酵工业, 2002, 28(12)∶ 71-73.
[8]邵伟, 乐超银, 唐明, 等. 野生拐枣保健醋的开发研究[J]. 中国调味品, 2002(11)∶ 16-18.
[9]黎继烈, 吴耀辉. 枳椇酸乳加工工艺研究[J]. 经济林研究, 2004, 22 (2)∶ 27-29.
[10]赵晓野. 枳椇醋解酒护肝减肥降脂功能研究[D]. 杨凌∶ 西北农林科技大学, 2009.
[11]邹礼根, 柳爱春, 刘超, 等. 拐枣水提取液对小白鼠解酒的作用[J].浙江农业科学, 2010(1)∶ 109-110.
[12]贾春晓, 熊卫东, 毛多斌, 等. 拐枣果梗中有机酸成分的GC-MS分析[J]. 中国食品学报, 2005, 5(1)∶ 72-74.
[13]朱炯波, 赵虹桥, 董爱文, 等. 拐枣中多糖的提取与含量测定[J]. 林产化工通讯, 2005, 39(1)∶ 27-30.
[14]YOO S M, MUN S Y, KIM J H. Recovery and pre-purification of (+)-dihydromyricetin from Hovenia dulcis[J]. Process Biochemistry, 2006, 41(3)∶ 567-570.
[15]YOSHIKAWA M, UEDA T, MURAOKA O, et al. Absolute stereostructures of hovenidulciosides A1 and A2, bioactive novel triterpene glycosides from Hoveniae semenseu fructus, the seeds and fruit of Hovenia dulcis Thunb[J]. Chem Pharm Bull, 1995, 43(3)∶ 532-534.
[16]刘丽香, LAURA T, 梁兴飞, 等. Folin-Ciocalteu比色法测定苦丁茶中多酚含量[J]. 茶叶科学, 2008, 28(2)∶ 101-106.
[17]何志勇, 夏文水. Folin-Ciocalteu比色法测定橄榄中多酚含量的研究[J]. 林产化学与工, 2006, 26(4)∶ 99-101.
[18]吕群金, 衣杰荣, 丁勇. Folin-Ciocalteu比色法测定杨桃的多酚含量[J]. 湖南农业科学, 2009(7)∶ 99-101.
[19]LIN J Y, TANG C Y. Determination of total phenolic and ?avonoid contents in selected fruits and vegetables, as well as their stimulatory effects on mouse splenocyte proliferation[J]. Food Chemistry, 2007, 101 (1)∶ 140-147.
[20]PAIXAO N, PERESTRELO R, MARQUES J C, et al. Relationship between antioxidant capacity and total phenolic content of red, rose and white wines[J]. Food Chemistry, 2007, 101(1)∶ 204-214.
[21]LI B B, SMITH B, HOSSAIN M M. Extraction of phenolics from citrus peelsⅠ∶ Solvent extraction method[J]. Separation and Purification Technology, 2006, 48(2)∶ 182-188.
[22]YANG J, GADI R, PAULINO R, et al. Total phenolics, ascorbic acid, and antioxidant capacity of noni (Morinda citrifolia L.)juice and powder as affected by illumination during storage[J]. Food Chemistry, 2010, 122(3)∶ 627-632.
Folin-Ciocalteu colorimetric Determination of Total Polyphenol Content in Hovenia acerba Fruit
XIANG Jin-le1,2,LI Zhi-xi1,*,GUO Xiang-feng2,LI-Huan1,ZHENG Shu-yan1
(1. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China;2. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China)
A quantitative Folin-Ciocalteu colorimetry method to determine total polyphenols in Hovenia acerba fruit was developed. The color reaction was carried out with 0.6 mL of Folin-Ciocalteu reagent and 1.5 mL of 20 g/100 mL aqueous Na2CO3 solution in darkness at 30 ℃ for 60 min. The detection wavelength was set as 750 nm. The linear range of the established standard curve was 0-8.47 mg/L. The relative standard deviations of stability, reproducibility, precision, and spike recovery rate of this method were all satisfactory. Thus, this method can be applicable to determine the total polyphenols of Hovenia acerba fruit.
Folin-Ciocalteu colorimetry;Hovenia acerba fruit;polyphenol
TS207.3
A
1002-6630(2011)14-0210-05
2010-10-25
国家级大学生科技创新资助项目(091071202)
向进乐(1980—),男,讲师,博士研究生,主要从事植物活性成分研究。E-mail:xiangjinlexinong@163.com*
李志西(1958—),男,教授,博士,主要从事发酵功能食品研究。E-mail:lizhxi@nwsuaf.edu.cn

