产辅酶Q10白地霉菌的罐发酵条件优化
魏宝东,齐 欣*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
产辅酶Q10白地霉菌的罐发酵条件优化
魏宝东,齐 欣*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
以白地霉菌(Geotrichum candidum)为出发菌株,根据摇瓶发酵结果控制pH值进行罐发酵。采用间歇补料分批发酵的方法,考察溶氧量、搅拌转速、空气流量及补糖因素对菌体生物量及辅酶Q10产量的影响。确定发酵罐发酵的最适条件为控制溶氧在35%~40%,补糖控制在发酵液糖质量浓度为2g/L,该发酵条件下辅酶Q10产量从分批发酵的78.75mg/L提高到106.26mg/L,较摇瓶发酵提高了69.8%。
辅酶Q10;发酵罐;发酵条件
辅酶Q10(CoQ10)又名泛醌、癸烯醌,化学名称为2,3-二甲基-5-甲基-6-癸异戊烯苯醌[1-2]。它与线粒体内膜相结合,是呼吸链中重要的递氢体。它是细胞自身产生的天然抗氧化剂、细胞代谢的激活剂[3]。辅酶Q10也具有重要的生理作用,广泛应用于食品添加剂、功能食品、保健品、化妆品及减肥食品等领域[4-6]。目前,辅酶Q10的制备方法中微生物发酵法应用最广泛[7-8],利用微生物发酵法生产具有原料成本低[9]、反应条件温和及可实现大规模生产等许多优点,是一种非常经济的生产方法。近几年来,国内关于微生物发酵法生产辅酶Q10的研究也取得了部分进展,其中以邹祥[10]、李俊峰等[11]应用根瘤菌发酵和农杆菌发酵最为常见。
摇瓶发酵适用于实验室,从摇瓶到发酵罐上的放大是发酵产品开发中一个非常重要的环节[12]。由于摇瓶发酵的条件与发酵罐的发酵条件在一定程度上存在差异,往往存在着“放大效应”[13],所以需在摇瓶发酵的基础上对发酵罐的发酵条件做进一步研究。本实验选用白地霉菌(Geotrichum candidum)为出发菌株生产辅酶Q10,在前期摇瓶发酵的基础上,在7L发酵罐中进行发酵实验研究[14-15]。
1 材料与方法
1.1 菌种
白地霉菌(Geotrichum candidum)由本实验室保存。
1.2 培养基
斜面培养基(g/L):葡萄糖4、蛋白胨0.3、酵母浸粉0.15、牛肉浸膏0.15、K2HPO40.05、琼脂1.8、蒸馏水1L,pH6.0;种子培养基(g/L):葡萄糖3、蛋白胨0.3、K2HPO40.05、蒸馏水1L,pH6.0;发酵培养基(g/L):葡萄糖4、蛋白胨0.3、酵母浸粉0.15、牛肉浸膏0.15、K2HPO40.05、蒸馏水1L,pH6.0。
1.3 仪器与设备
BGZ-7智能型机械搅拌发酵罐 上海保兴生物设备工程有限公司;ZWD-0.05/7全无油空气压缩机 宁波鄞州展翅全无油空压机有限公司;TH-3560型全自控蒸汽灭菌锅 上海奉贤协新机电厂;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.4 方法
1.4.1 适宜pH值的确定
控制适当的pH值对发酵过程是非常重要的。在摇瓶发酵过程中,采用250mL三角瓶,固定转速为200r/min,分别测定pH4、5、6、7、8、9时菌体生物量及辅酶Q10产量,以确定适宜的初始pH值。
1.4.2 7L自动罐分批发酵参数的设定
发酵罐中各过程参数设定:培养温度:29℃,罐压:0.01MPa,7L发酵罐装液量:5L,接种量:4g/L,发酵72h,随需要调整通气量,采用聚醚类消泡剂。根据摇瓶发酵pH值的研究结果,7L自动罐采用流加2mol/L的NaOH溶液来控制pH值,使pH值控制在易于辅酶Q10生成的范围内,直至发酵结束。
确定发酵过程的最适溶氧量,通过搅拌转速及空气流量两方面共同控制溶氧量,菌体进入生长对数期时耗氧量增大,罐内溶氧量下降,此时增加搅拌转速;当菌体进入稳定期,辅酶Q10也开始大量产生时,降低搅拌转速,适时调节空气流量,使溶氧维持在35%~40%。
1.4.3 7L自动罐间歇补料分批发酵
1.4.3.1 发酵液中葡萄糖适宜质量浓度的确定
发酵液葡萄糖初始质量浓度为4g/L,当发酵液中葡萄糖质量浓度分别下降至3、2.5、2、1.5g/L时,平均每3h补糖一次,使葡萄糖质量浓度分别维持在3、2.5、2、1.5g/L,以确定能够获得最高辅酶Q10产量的发酵液葡萄糖质量浓度。
1.4.3.2 补糖种类及方式
根据葡萄糖适宜质量浓度确定的结果,在葡萄糖质量浓度下降到2g/L以下时,开始补加碳源为50%的葡萄糖,维持葡萄糖的质量浓度在2.0g/L,以促进菌体及辅酶Q10的大量合成。
1.4.4 辅酶Q10提取方法
参照文献[16]方法进行。
2 结果与分析
2.1 初始pH值对菌体生物量及辅酶Q10产量的影响
由图1可知,随着pH值升高菌体生物量及辅酶Q10产量呈先上升后下降的趋势,在pH值为6时菌体生物量及辅酶Q10产量均达到最大值,分别为37.25g/L、62.47mg/L,因此确定最佳初始pH值为6。在采用自动发酵罐发酵时,通过流加2mol/L的NaOH溶液来调节pH值。

图1 初始pH值对菌体生物量及辅酶Q10产量的影响Fig.1 Effect of initial pH on cell biomass and the yield of coenzyme Q10
2.2 7L自动罐分批发酵工艺参数的确定
2.2.1 溶氧量对辅酶Q10产量的影响

图2 不同溶氧量对辅酶Q10产量的影响Fig.2 Effect of dissolved oxygen on the yield of coenzyme Q10
研究不同溶氧量对辅酶Q10产量的影响,从而更好的控制搅拌转速及空气流量。由图2可知,当溶氧控制在35%~40%时,辅酶Q10产量达到最大值,为62.77mg/L。因此将溶氧控制在35%~40%范围之内。
2.2.2 搅拌转速对菌体生物量和辅酶Q10产量的影响
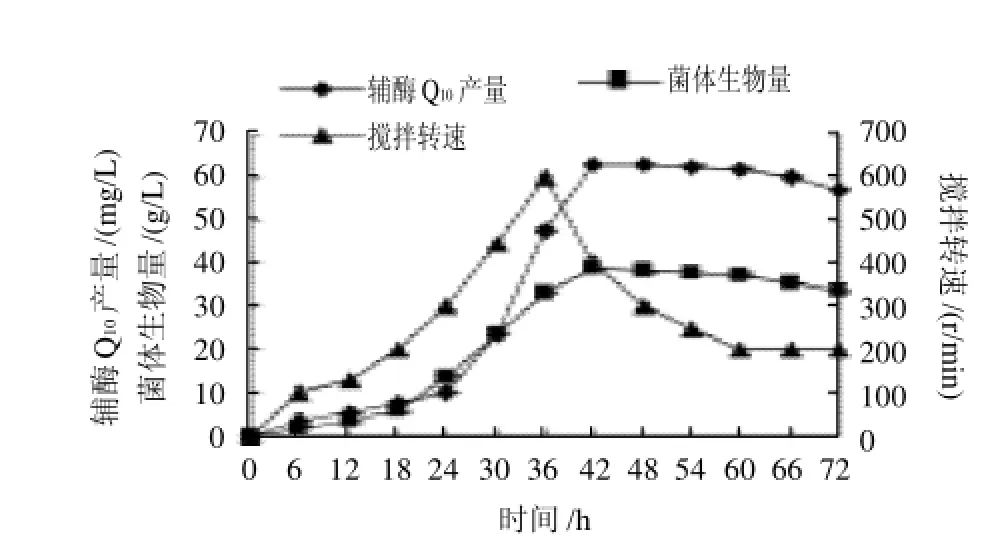
图3 搅拌转速对菌体生物量及辅酶Q10产量的影响Fig.3 Effect of stirring speed on cell biomass and yield of coenzyme Q10
在控制溶氧35%~40%,空气流速5L/min相对固定的条件下,研究全自动罐搅拌转速对菌体生物量和辅酶Q10产量的影响,结果见图3。在18~36h菌体进入对数生长期,由于好氧搅拌转速从100r/min增加到600r/min,在此期间菌体生物量及辅酶Q10产量都呈上升趋势,在36h之后,随着菌体进入稳定期,搅拌转速也应逐渐减慢,辅酶Q10产量有所提高。
2.2.3 空气流量对菌体生物量和辅酶Q10产量的影响
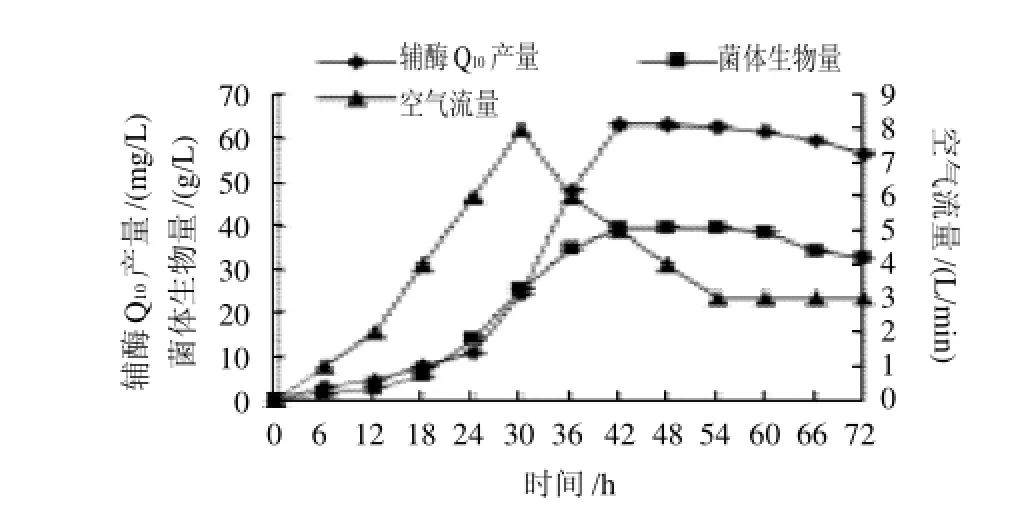
图4 空气流量对菌体生物量及辅酶Q10产量的影响Fig.4 Effect of airflow rate on cell biomass and the yield of coenzyme Q10
在控制溶氧35%~40%,搅拌转速350r/min相对固定的条件下,研究全自动罐空气流量对菌体生物量和辅酶Q10产量的影响,结果见图4。在18~36h菌体进入对数生长期,由于好氧不断提高空气流量,最大值为8L/min,在此期间菌体生物量及辅酶Q10产量都呈上升趋势,36h之后,菌体进入稳定期,从而减少空气流量,辅酶Q10产量有所提高。
2.2.4 搅拌转速及空气流量对菌体生物量、辅酶Q10产量及葡萄糖质量浓度的综合影响

图5 搅拌转速及空气流量对菌体生物量、辅酶Q10产量及葡萄糖质量浓度的综合影响Fig.5 Combined effect of stirring speed and airflow rate on cell biomass and the yield of coenzyme Q10
从搅拌转速及空气流量两方面同时控制溶氧在35%~40%,搅拌转速不超过400r/min,空气流量随时调整(不超过于8L/min),结果见图5。菌种在对数生长期空气流量最高达6L/min时可满足菌种生长需要,进入稳定期后搅拌转速及空气流量分别下降到350r/min和4L/min,结果较摇瓶发酵辅酶Q10的产量有所提高。
2.2.5 消泡剂对菌体生物量及辅助Q10产量的影响
发酵过程中通气搅拌和代谢所产生的气体是泡沫产生的原因。泡沫的控制方法可分为机械消泡和化学消泡剂两大类。常用的消泡剂分为天然油脂、聚醚类、高级醇类和硅树脂类,这些物质可作为碳源,但其消泡能力不强,应用较多的是聚醚类。本研究在摇瓶条件下进行对比实验,结果见图6。针对该菌种聚醚类消泡剂性能稳定,对菌体和辅酶Q10产量均无影响。因此,7L自动罐发酵采用聚醚类消泡剂,自动罐可通过泡沫液位检测电极自动控制消泡剂的添加,维持发酵的正常进行。

图6 摇瓶发酵聚醚类消泡剂对菌体生物量和辅酶Q10产量的影响Fig.6 Effect of polyether defoamer on cell biomass and the yield of coenzyme Q10 during shake flask fermentation
2.3 7L自动罐分批发酵曲线

图7 7L自动发酵罐分批发酵曲线Fig.7 Time courses of batch fermentation in a 7 L automatic fermenter
在控制发酵过程各参数(溶氧量、搅拌转速、通气量、pH值)的前提下,进行7L自动罐分批发酵试验,做出发酵曲线,结果如图7所示。菌种在对数生长期,由于迅速生长对营养物质的需要,发酵液中的碳源迅速下降,同时也伴随着辅酶Q10的大量产生,当碳源含量不高时,菌体生物量及辅酶Q10产量也不再增加,在分批发酵中,菌体生物量及辅酶Q10产量分别为44.34g/L、78.75mg/L。
2.4 7L自动罐间歇补料分批发酵
2.4.1 发酵液中适宜葡萄糖质量浓度的确定
由表1可知,由于发酵液中初始葡萄糖质量浓度为4g/L,当葡萄糖质量浓度降至3g/L和2.5g/L时开始补糖,此时发酵液中葡萄糖质量浓度过高,影响菌体及辅酶Q10的产生;维持1.5g/L的葡萄糖质量浓度不能满足菌体及辅酶Q10产生的需要;当葡萄糖质量浓度维持在2g/L时补糖,菌体生物量及辅酶Q10产量最大,因此确定发酵液中葡萄糖质量浓度为2g/L最适宜。

表1 发酵液中葡萄糖适宜质量浓度的选择Table 1 Effects of starting time and amount of glucose addition on cell biomass and the yield of coenzyme Q10
2.4.2 补糖指标的确定
以葡萄糖质量浓度作为发酵液的补糖指标,发酵液中初始葡萄糖质量浓度为4g/L,当葡萄糖质量浓度降至2g/L,发酵时间为30h时开始补糖,平均每隔3h补糖一次,通过控制葡萄糖的流加量维持发酵液中葡萄糖质量浓度在2g/L,使菌体生物量及辅酶Q10产量大幅度提高,在48h时停止补糖后,菌体生物量及辅酶Q10产量都有所下降,在整个发酵过程中,葡萄糖总流加量为40g/L。
2.4.3 7L自动罐间歇补料分批发酵曲线
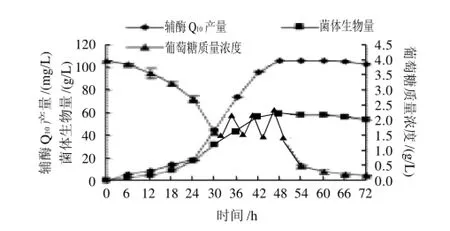
图8 7L自动发酵罐间歇补料分批发酵曲线Fig.8 Time courses of intermittent fed-batch fermentation in a 7 L automatic fermenter
在控制发酵过程各参数的前提下,进行7L自动罐间歇补料分批发酵实验,做出发酵曲线。结果如图8所示,通过间歇补料分批发酵过程中添加葡萄糖,使菌体生物量及辅酶Q10产量的最大值较分批发酵时滞后6h,但产量有所提高,菌体生物量及辅酶Q10产量分别为58.56g/L、106.26mg/L。
3 结 论
研究7L自动罐分批发酵中的各个参数,通过搅拌转速及空气流量两方面共同控制溶氧量,使溶氧维持在35%~40%,通气量随需要随时进行调节,发酵过程中加入聚醚类做为消泡剂,通过添加碱液控制发酵过程的pH值在适宜的范围内,确定了7L自动罐间歇补料分批发酵的参数,葡萄糖的流加量控制在维持发酵液葡萄糖质量浓度为2g/L,以获得更高的菌体生物量及辅酶Q10产量。7L自动发酵罐间歇补料分批发酵辅酶Q10产量为106.26mg/L,较摇瓶发酵提高了69.8%。
[1] 韩少英, 窦洁, 周长林. 发酵法生产辅酶Q10的研究进展[J]. 药物生物技术, 2006, 13(3): 227-232.
[2] 吕春茂, 李英华. 辅酶Q10几种提取工艺的优化研究[J]. 食品科学, 2007, 28(12): 132-135.
[3] 步文磊, 赵显峰. 辅酶Q10大豆甙元以及卵磷脂对小鼠体内抗氧化体系的影响[J]. 食品科学, 2010, 31(7): 256-259.
[4] HATHCOCK J N, SHAO A. Risk assessment for coenzyme Q10(Ubiquinone)[J]. Regulatory Toxicology and Pharmacology, 2006, 45 (3): 282-288.
[5] 田宝静, 李剑. 土壤杆菌中辅酶Q10的提取工艺[J]. 食品与生物技术学报, 2009, 28(6): 858-861.
[6] 李伟静, 于群. 辅酶Q10的生理作用及临床应用[J]. 生物技术通讯, 2007, 18(5): 882-884.
[7] 张千, 武标. 提高微生物发酵辅酶Q10产量的研究进展[J]. 生物学杂志, 2007, 24(1): 67-69.
[8] 吴品芳, 路茂林. 皂化法分离测定三袍布拉氏霉菌体中辅酶Q10的研究[J]. 食品生物技术学报, 2006, 16(1): 43-45.
[9] 王普, 张晓军. 发酵法生产辅酶Q10的季也蒙假丝酵母菌株的选育[J].浙江工业大学学报, 2006, 34(3): 281-285.
[10] 邹祥. 发酵法生产辅酶Q10的研究进展[J]. 山东食品发酵, 2004(2): 26-28.
[11] 李俊峰, 姚淑敏. 产辅酶Q10海洋酵母的筛选及培养条件的优化[J].食品科学, 2008, 29(12): 426-430.
[12] 郑凤娥. 纳他霉素产生菌诱变、种内原生质体融合及发酵条件研究[D]. 沈阳: 沈阳农业大学, 2008.
[13] 赵成建, 张定丰, 金志华. 利福霉素B发酵放大Ⅰ从摇瓶到15L发酵罐的发酵放大[J]. 中国抗生素杂志, 2002, 27(7): 398-340.
[14] HA S J, KIM S Y, SEO J H, et al. Optimization of culture conditions and scale-up to pilot and plant scales for coenzyme Q10production by Agrobacterium tumefaciens[J]. Appl Microbiol Biotechnol, 2007, 74 (5): 974-980.
[15] 杨启银, 刘淑超. 生物富硒对沼泽红假单胞菌G3菌株营养组分的影响[J]. 食品科学, 2010, 31(23): 253-257.
[16] 陈亮, 朱振华. 辅酶Q10的高产菌种筛选及发酵工艺优化[J]. 西北大学学报: 自然科学版, 2007, 37(3): 429-432.
Optimization of Tank Fermentation Conditions for Coenzyme Q10Production by White Geotrichum candidum
WEI Bao-dong,QI Xin*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
For the production of Coenzyme Q10, Geotrichum candidum was intermittent fed-batch cultured in a stirred tank fermenter, and pH was controlled according to the results of previous studies on shake flask fermentation during the process. The effects of dissolved oxygen, stirring speed, airflow rate, and sugar amount on biomass and coenzyme Q10production were investigated. The optimal fermentation conditions were determined as follows: dissolved oxygen, 35%-40% and sugar concentration, 2 g/L. Under these optimal conditions, the yield of coenzyme Q10 from batch fermentation was increased from 78.75 to 106.26 mg/L, which exhibited an improvement by 69.8% as compared to shake flask fermentation.
coenzyme Q10;fermenter;fermentation conditions
TS201.3
A
1002-6630(2011)07-0247-04
2010-08-09
魏宝东(1969—),男,副教授,博士,研究方向为食品制造与保藏。E-mail:bdwei2003@yahoo.com
*通信作者:齐欣(1984—),女,硕士研究生,研究方向为食品科学。E-mail:qixin771015@163.com

