植物乳杆菌发酵培养基的优化及其高密度培养技术
熊 涛,黄锦卿,宋苏华,关倩倩,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
植物乳杆菌发酵培养基的优化及其高密度培养技术
熊 涛,黄锦卿,宋苏华,关倩倩,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
应用响应面法优化植物乳杆菌培养基配方以及利用中和法与指数流加法优化植物乳杆菌高密度培养的发酵条件。在单因素试验基础上,进一步采用SAS软件进行中心组合设计和响应面法优化发酵培养基。优化后的培养基配方为:葡萄糖质量分数5.43%、蛋白胨质量分数0.98%、K2HPO4质量分数0.59%。利用15L全自动发酵罐,在接种量3%、pH6.5、培养温度35℃的最佳条件下,采用氨水中和发酵培养基和指数流加碳、氮源,最终发酵液中植物乳杆菌菌体浓度达到9.3×109CFU/mL。
植物乳杆菌;响应面;培养基优化;高密度培养;指数流加
乳酸菌为人体益生菌[1-4]。乳酸菌发酵产品主要有酸奶、奶酪、风味泡菜及近年来研究较多的植物发酵饮料等,因其都具有一定的保健功能而受到越来越多消费者的重视和喜爱[5]。直投式发酵菌剂在蔬菜发酵工业中的应用越来越广泛,在发酵剂的制备过程中,关键环节是获得高浓度的菌体,因此,必须对乳酸菌进行高密度培养[6]。
高密度培养是一个相对的概念[7-9],广义的讲,凡是细胞密度比较高,以至接近其理论值的培养均可称为高密度培养。目前,国内研究者对缓冲盐法和化学中和法应用较多,但最终获得的菌体浓度较小,一般不超过109CFU/mL[10],国外研究者在细胞循环培养法和透析法方面做了许多探索,Hayakawa等[11]以1.3g/(L·h)的产率和0.2m3/kg的耗水量产出了40g/L的干细胞;Suzuki[12]用陶瓷滤器获得的最大细胞干质量浓度为141g/L,其产率约为0.8g/(L·h),耗水量约为0.2m3/kg,用陶瓷滤器的主要缺陷是膜的堵塞,本实验利用缓冲盐法、化学中和法和指数流加法对植物乳杆菌进行高密度培养,通过在发酵过程中流加补料,菌体浓度在发酵终止时获得了很大提高,对乳酸菌大规模培养以及乳酸菌发酵剂的制备具有指导意义。
1 材料与方法
1.1 材料
1.1.1 菌种
植物乳杆菌(L.plantarum NCU116)由南昌大学食品科学与技术国家重点实验室保藏。
1.1.2 培养基
MRS培养基(各成分含量均指质量分数):蛋白胨1%、牛肉膏1%、葡萄糖3%、乙酸钠0.5%、酵母膏0.5%、柠檬酸二铵0.2%、磷酸氢二钾0.2%、硫酸镁0.02%、吐温-80 0.1%,121℃、30min灭菌[13];平板计数培养基:葡萄糖质量分数3%的MRS固体培养基;液体种子培养基:葡萄糖质量分数4%的MRS液体培养基。
1.1.3 仪器与设备
DHG-9246A型电热恒温鼓风干燥箱、ZHWY-2102C恒温培养振荡器、雷磁PHS-25型数显pH计 上海智城分析仪器制造有限公司;SPX-250B-Z型生化培养箱 上海精宏实验设备有限公司;FUS-15L发酵罐 上海国强生物设备有限公司。
1.2 方法
1.2.1 菌浓度的测定
采用菌落平板计数法[14]测定菌落数,计算发酵液中的菌浓度。
1.2.2 还原糖含量的测定
采用直接滴定法测定还原糖含量[15]。
1.2.3 种子液的制备
转接斜面菌种于液体种子培养基中,置于36℃恒温培养箱中培养12h。
1.2.4 发酵培养基的优化
1.2.4.1 不同碳源对植物乳杆菌高密度培养的影响
在MRS液体培养基基础上,选择蔗糖、麦芽糖、葡萄糖、乳糖以及葡萄糖与乳糖质量比1:1的复合糖5种碳源,质量分数都为5%。按2%接种量接种种子液于发酵培养基中,初始pH6.0,培养温度36℃,置于恒温箱内静置培养18h,测定培养液的菌落数。
1.2.4.2 不同氮源对植物乳杆菌高密度培养的影响
在MRS液体培养基基础上,选择蛋白胨、胰蛋白胨、硫酸铵、硝酸钠4种氮源,质量分数都为1%。按2%接种量接种种子液于发酵培养基中,初始pH6.0,培养温度36℃,置于恒温箱内静置培养18h,测定培养液的菌落数。
1.2.4.3 不同缓冲盐对植物乳杆菌高密度培养的影响
在MRS液体培养基基础上,选择CaCO3、K2HPO4、NaAc、KH2PO4作为缓冲盐,质量分数都为0.5%,以不加任何缓冲盐作为空白对照。按2%接种量接种种子液于发酵培养基中,初始pH 6.0,培养温度36℃,置于恒温箱内静置培养18h,测定培养液的菌落数。
1.2.4.4 不同生长因子对植物乳杆菌高密度培养的影响
选择玉米浆、番茄汁、VC 3种作为生长因子,质量分数都为0.5%,以不添加任何生长因子作为空白对照。按2%接种量接种种子液于发酵培养基中,初始pH 6.0,培养温度36℃,置于恒温箱内静置培养18h,测定培养液的菌落数。
1.2.4.5 响应面法优化发酵培养基
选择上述最佳碳源、氮源、缓冲盐做响应面试验。碳源质量分数分别选择1%、3%、5%、7%、9%,氮源质量分数分别选择0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%,缓冲盐质量分数分别选择0.1%、0.3%、0.5%、0.7%、0.9%,采用三因素三水平,应用SAS软件的响应面法优化培养基配方[16]。
1.2.5 植物乳杆菌高密度培养条件的优化
1.2.5.1 接种量的选择
选择不同接种量1%、2%、3%、5%、9%,接种种子液于发酵培养基中,初始pH6.0,培养温度36℃,置于恒温箱内静置培养18h,测定培养液的菌落数。
1.2.5.2 温度的选择
按最佳接种量接种种子液于发酵培养基中,初始pH6.0,分别在25、30、35、40、45℃静置培养18h,测定其菌落数。
1.2.5.3 最佳pH值的选择
选择pH值分别为7.5、7.0、6.5、6.0、5.0、4.0,在15L发酵罐内分批发酵,按最佳接种量接种,最佳温度培养,搅拌速度控制在100r/min,每隔3h测定菌落数,选择其最佳pH值。
1.2.5.4 最终生长曲线的测定
利用15L发酵罐,按得到最佳条件培养,搅拌速度100r/min,每隔3h测定菌落数和还原糖的含量。
1.2.6 高密度培养技术的研究
1.2.6.1 中和法高密度培养的研究
选择常用的Na2CO3溶液和氨水为中和剂,利用15L全自动发酵罐,按最终确定的培养条件进行发酵并比较两种中和剂对植物乳杆菌高密度培养的影响,以不流加中和剂作对照,中和剂的质量分数都选择25%,每隔4h测定菌落数和还原糖含量。
1.2.6.2 流加法高密度培养的研究
利用15L发酵罐,比较恒速流加和指数流加对植物乳杆菌高密度培养的影响,以确定一种更优的流加方式。流加葡萄糖质量浓度为300g/L,每隔4h测定菌落数和还原糖的含量。
恒速流加:以恒定的流加速度200g/h流加到发酵罐内。
指数流加:以1.2.5.4节最终确定的生长曲线做参考,在菌体生长对数期开始时进行流加,并且流加速度随着生长曲线的变化而变化,初始速度为50g/h,流加速度呈指数(2n)增加,直至对数生长末期。
1.2.6.3 中和法与流加法综合利用的高密度培养的研究
利用发酵罐自动控制功能,实现自动流加控制,控制最佳pH值,同时流加碳、氮源,当菌体培养进行至对数期时,营养物质消耗殆尽,这时补充足够的营养物能延续菌体的生长。培养过程中同时添加中和剂中和乳酸菌产生的乳酸,防止罐体内培养基的pH值降低。每隔4h测定菌落数及还原糖含量。
2 结果与分析
2.1 发酵培养基的优化
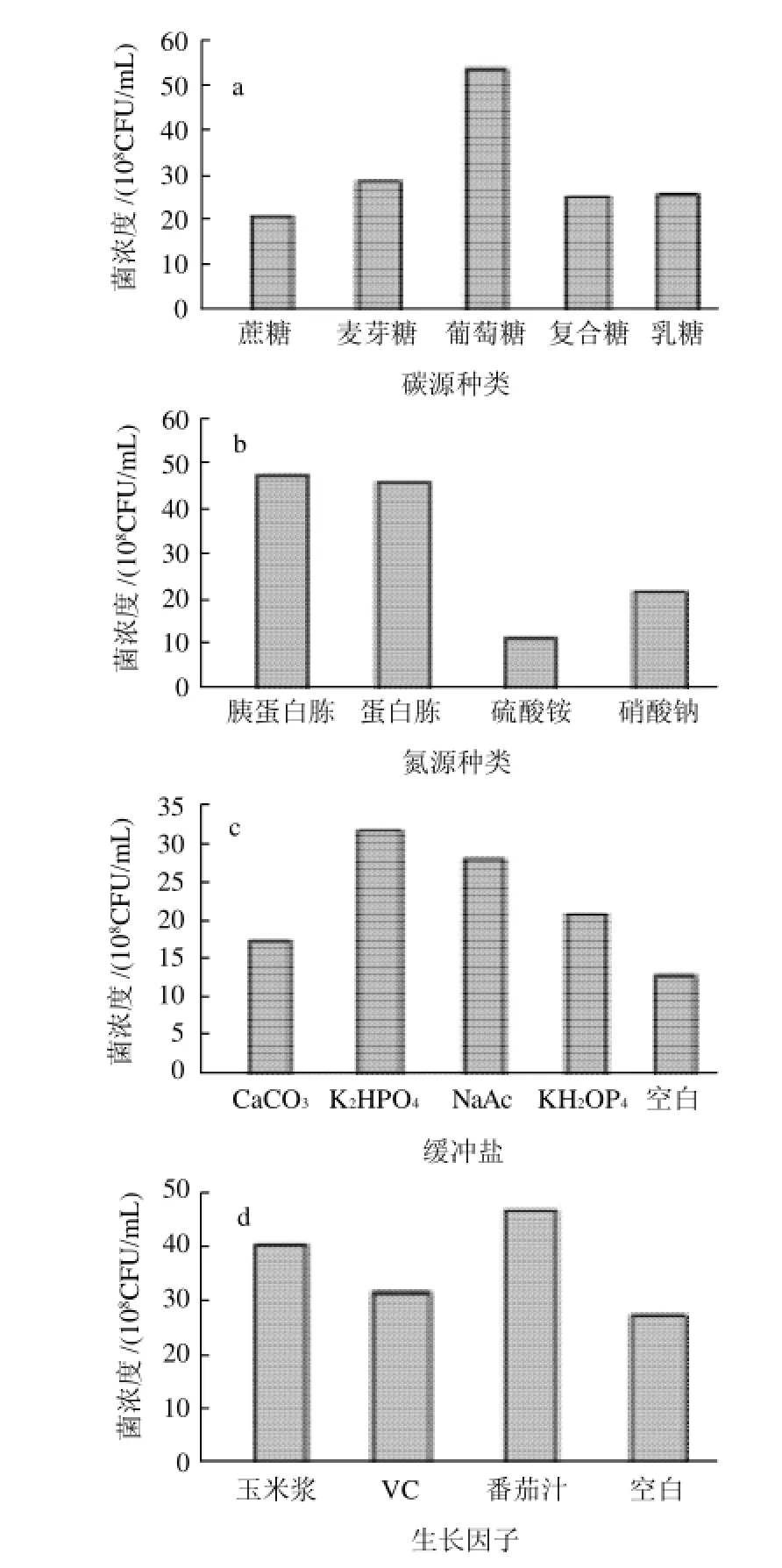
图1 碳源、氮源、缓冲盐和生长因子对植物乳杆菌高密度培养的影响Fig.1 Effects of carbon source, nitrogen source, buffer salt and growth factor on high-density culture of L. plantarum
2.1.1 碳源的选择
由图1a可知,葡萄糖作为碳源时,菌浓度最高,最适合菌体生长,可能是因为植物乳杆菌不能利用复杂的碳水化合物,细胞内缺乏分解多糖的酶,因此多糖类物质不适合作为碳源。
2.1.2 氮源的选择
由图1b可知,有机氮源比无机氮源的效果更好,有机氮源直接含有植物乳杆菌生长所需的氮源如氨基酸等物质,而无机氮源需要经过合成或转化才能得到氨基酸。由于胰蛋白胨的成本较高,所以选择蛋白胨作为氮源。
2.1.3 缓冲盐的选择
由图1c可知,K2HPO4作为缓冲盐的效果最好,而CaCO3的效果最差,可能是因为CaCO3在水中的溶解度很低,易形成乳浊液,与乳酸不能充分接触,也易形成空间阻隔,使菌体不能和培养基充分接触,造成菌浓度偏低。
2.1.4 生长因子对菌浓度的影响
由图1d可知,玉米浆、VC、番茄汁3种生长因子中番茄汁促进菌体生长的效果最佳。植物乳杆菌为生长因子异养型微生物,自身不能合成生长因子,它们的生长需要多种生长因子,如多种维生素等。
2.1.5 碳源、氮源、缓冲盐添加水平的选择

图2 不同葡萄糖、蛋白胨和K2HPO4质量分数对菌浓度的影响Fig.2 Effects of glucose, peptone and K2HPO4concentrations on highdensity culture of L. plantarum
2.1.5.1 葡萄糖添加量选择
由图2a可以看出,葡萄糖质量分数在5%时菌浓度最高,发酵培养效果最好。
2.1.5.2 蛋白胨添加量选择
由图2b可以看出,当蛋白胨质量分数增加到1%时菌浓度最高,最佳氮源质量分数选择1%。
2.1.5.3 缓冲盐添加量选择
由图2c可以看出,K2HPO4质量分数为0.5%时菌浓度最高,发酵培养效果最好。
2.1.6 响应面优化试验结果
2.1.6.1 响应面方差分析结果
通过单因素试验并且确定重要因素最佳质量分数的取值区间,利用SAS V8.0分析软件进行响应面试验设计,见表 1、2。

表1 响应面试验因素和水平表Table 1 Factors and levels in response surface design
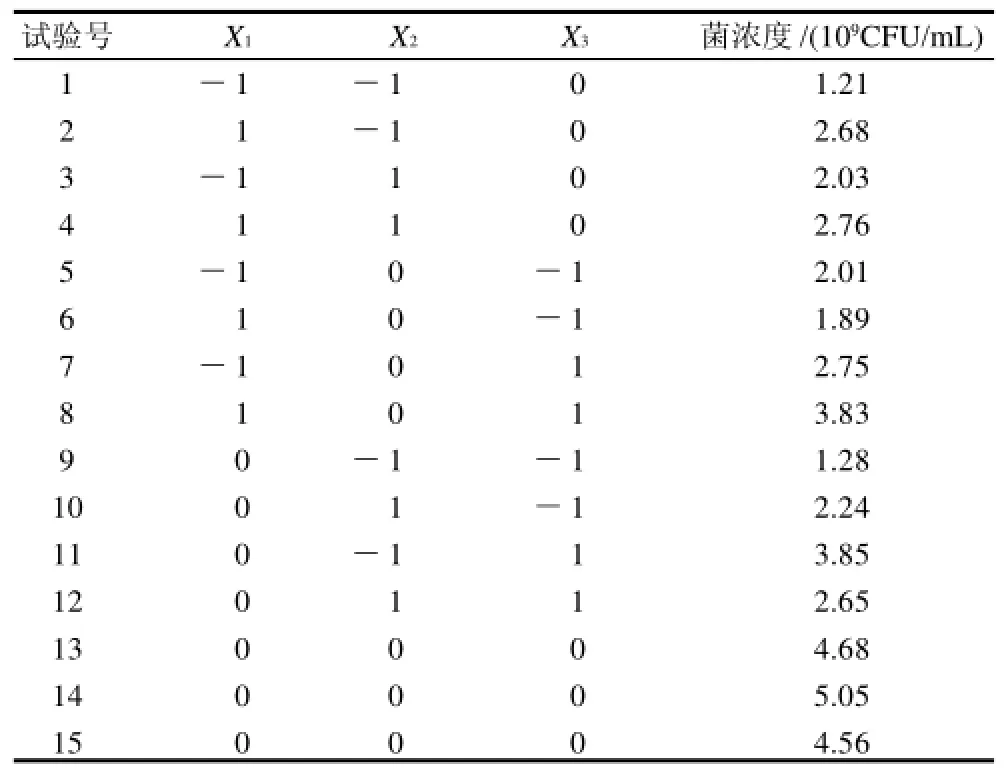
表2 响应面试验设计方案及结果Table 2 Scheme and results of response surface design
对试验结果进行方差分析,拟合得回归方程为:Y=4.763333+0.395X1+0.0825X2+0.7075X3-1.239167X12-1.354167X22-0.904167X32-0.185X1X2+0.3X1X3-0.54X2X3。
由表3方差分析可知,X1、X12、X3、X22、X32、X2X3对响应值的影响显著,说明葡萄糖、蛋白胨、K2HPO4是植物乳杆菌NCU116发酵培养基成分的重要控制因素。失拟项P=0.6057,没有显著性意义。从模型可信度分析表4可见,回归方程复相关系数R2=97.63%,说明回归方程拟合度良好,失拟较小,可用于培养基的优化。

表3 响应面试验方差分析表Table 3 Variance analysis of the established regression equation for cell density of L. plantarum
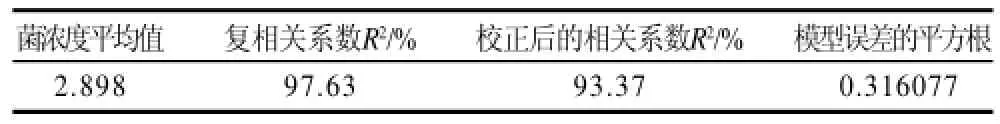
表4 模型的可行度分析Table 4 Feasibility analysis of the established regression equation for cell density of L. plantarum
2.1.6.2 响应面优化最佳条件
根据上述回归方程绘出响应面分析图及等高线图,研究葡萄糖、蛋白胨、K2HPO43个因素对发酵的影响,响应面和等高线图见图3~5。
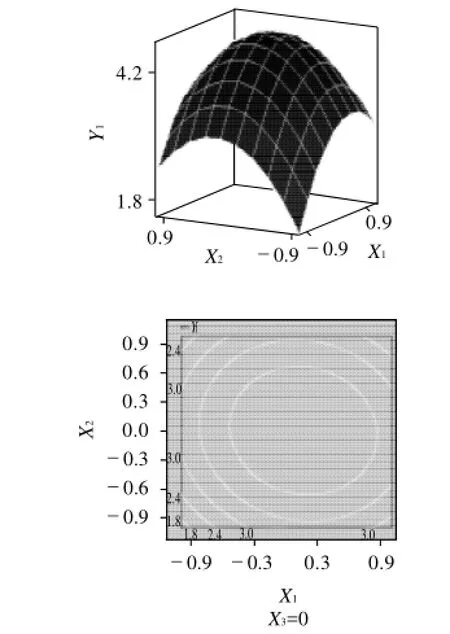
图3 Y=f(X1, X2)的响应面及其等高线图Fig.3 Response surface and contour plots of Y=f(X1, X2)

图4 Y=f(X1, X3)的响应面及其等高线图Fig.4 Response surface and contour plots of Y=f(X1, X3)
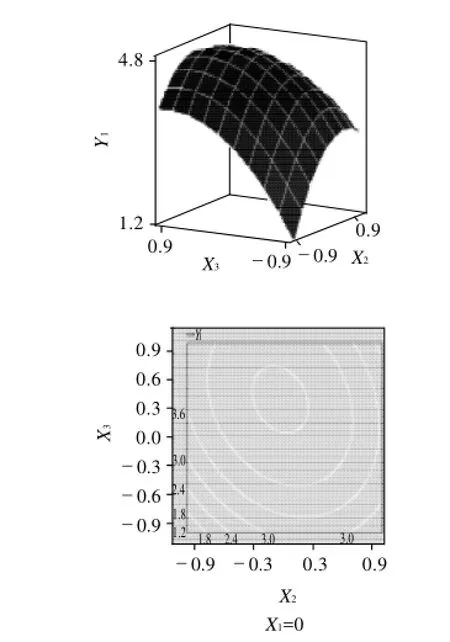
图5 Y=f(X2,X3)的响应面及其等高线图Fig.5 Response surface and contour plots of Y=f(X2, X3)
从图3~5可看出,两两因素之间存在比较明显的交互作用,最佳点落在试验考察区域内。为进一步求得最佳点值,对回归方程分别求一阶偏导数,得到最后的最佳值分别为X1=5.43%、X2=0.98%、X3=0.59%,菌体浓度4.76×109CFU/mL。
2.1.6.3 优化条件的验证
用响应面试验优化后的理论值做验证实验。以所得最佳反应条件:葡萄糖质量分数5.43%、蛋白胨质量分数0.98%、K2HPO4质量分数0.59%进行实验,得到菌体浓度为4.68×109CFU/mL,拟合度为97.63%,表明预测值和真实值之间有很好的拟合性,进一步验证了模型的可靠性。
2.2 植物乳杆菌高密度培养条件
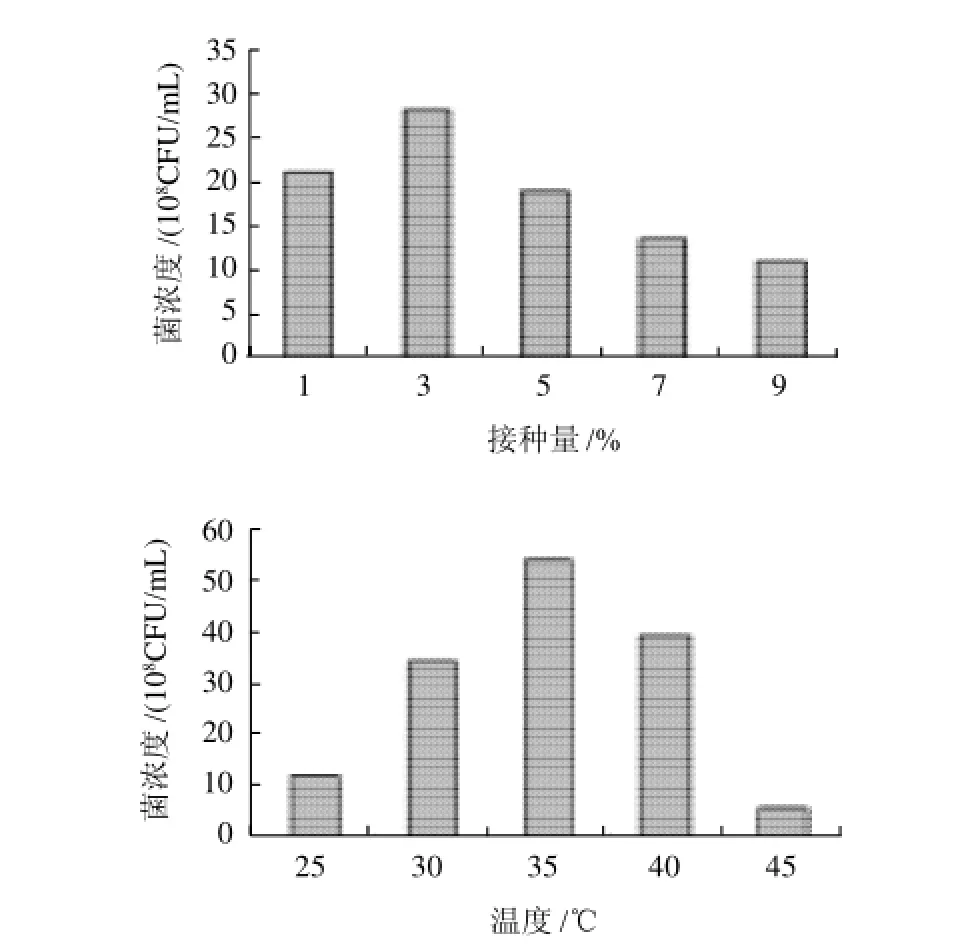
图6 接种量和培养温度对菌浓度的影响Fig.6 Effects of inoculation amount and culture temperature on cell density of L. plantarum
2.2.1 接种量的选择
由图6可见,接种量在3%时,菌体生长效果最佳。接种量在9%时菌浓度偏低,接种量过高,菌体生长不好,可能是因为在发酵初始阶段培养基中的营养物质不能满足大量菌体生长的需求。
2.2.2 培养温度的确定
由图6可知,温度对植物乳杆菌的影响比较明显,在35℃时,菌体浓度达到5.4×109CFU/mL。温度变化会直接影响菌体内蛋白质、酶的活性,温度过高会使得细胞内蛋白质变性,影响核糖体、RNA等大分子的稳定性;温度过低会降低酶活力,引起细胞膜流动性的变化,从而影响菌体的正常生长。
2.2.3 最佳pH值的确定
由图7可知,在pH6.5时,菌体生长最好,而在pH4.0时,菌体生长缓慢,pH值越低,植物乳杆菌所受酸胁迫的影响越大,所以最佳pH值应该控制在6.5左右。
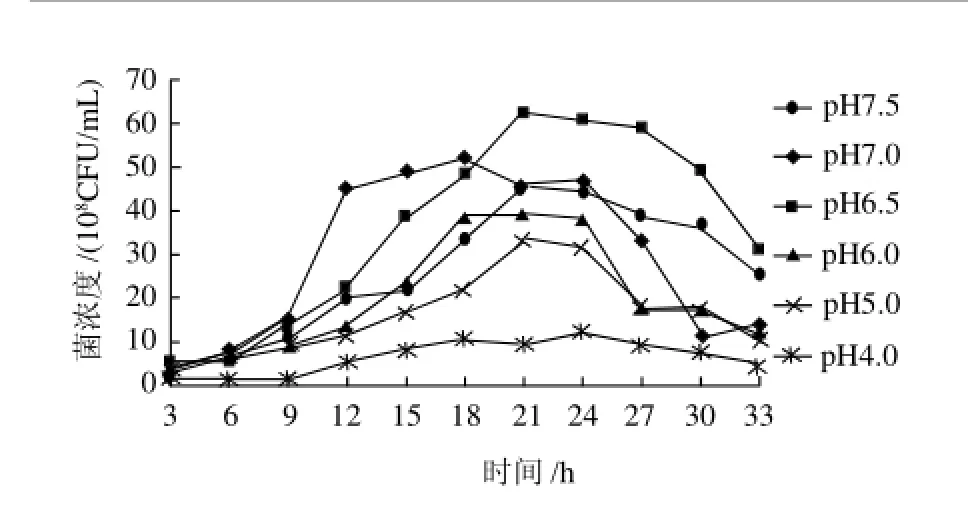
图7 pH值对菌浓度的影响Fig.7 Effect of pH on cell density of L. plantarum
2.2.4 植物乳杆菌最终生长曲线
确定培养基配方和培养条件,利用15L发酵罐培养植物乳杆菌,绘制其菌浓度生长曲线以及还原糖含量曲线,结果如图8所示。
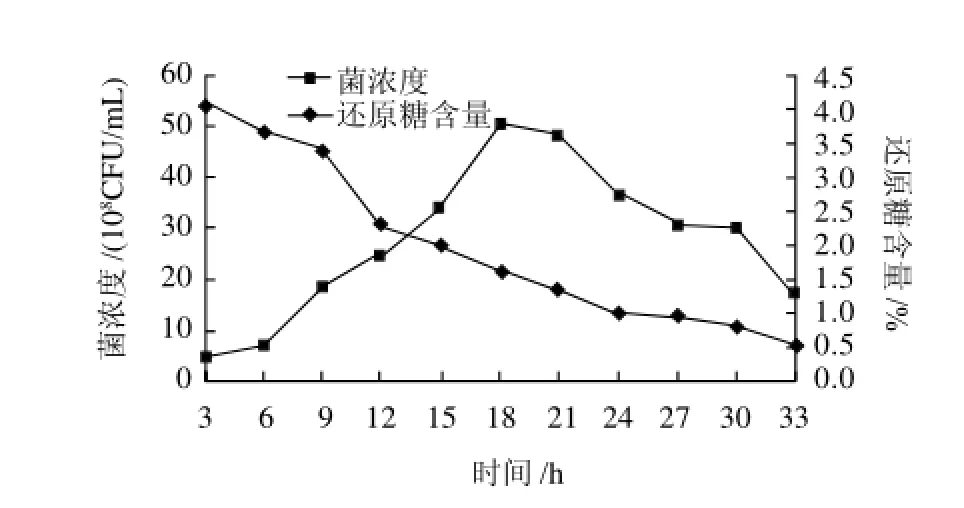
图8 植物乳杆菌生长曲线及还原糖含量变化Fig.8 Growth curve of L. plantarum and sugar content change
由图8可知,得到最佳培养基条件和培养条件后,菌体的最佳收获期是在20h左右,后续实验以这个收获期为收获依据。
2.3 植物乳杆菌高密度培养技术的研究
2.3.1 中和法对高密度培养的影响
利用发酵罐,选择氨水、Na2CO3溶液作为中和剂,并且研究两种中和剂对发酵的影响,其生长曲线如图9所示。
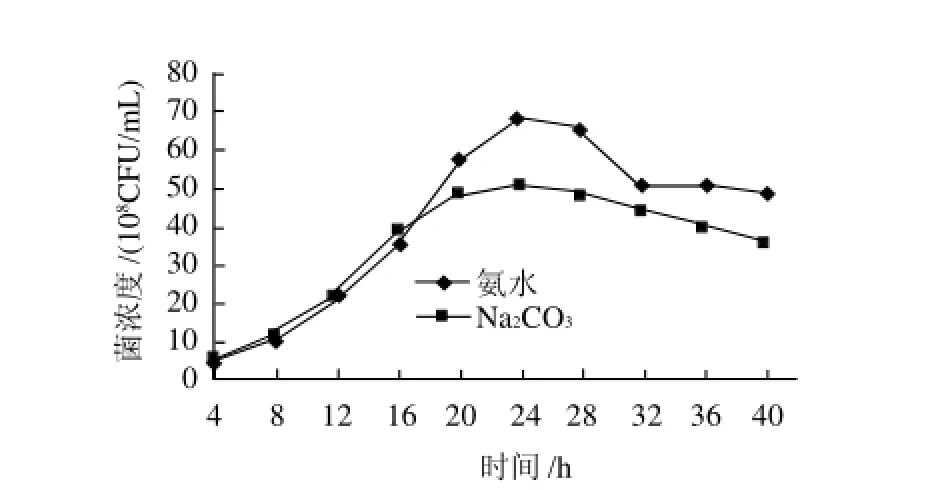
图9 中和剂对菌浓度的影响Fig.9 Effect of neutralizer on cell density of L. plantarum
参考生长曲线图与不添加中和剂对比,由图9可知,流加中和剂氨水后植物乳杆菌高密度培养最高菌浓度比不添加中和剂要高,达到6.8×109CFU/mL。在植物乳杆菌的培养过程中,由于其代谢物质会对菌体的繁殖产生抑制作用,pH值降低,从而影响菌体继续繁殖。植物乳杆菌在高密度培养过程中产生的酸量较大,使得植物乳杆菌的耐受性不能降低酸对菌体产生的胁迫效应。在培养过程中加入中和剂,使培养过程的pH值保持稳定,可以去除酸胁迫。
2.3.2 流加方式对高密度培养的影响
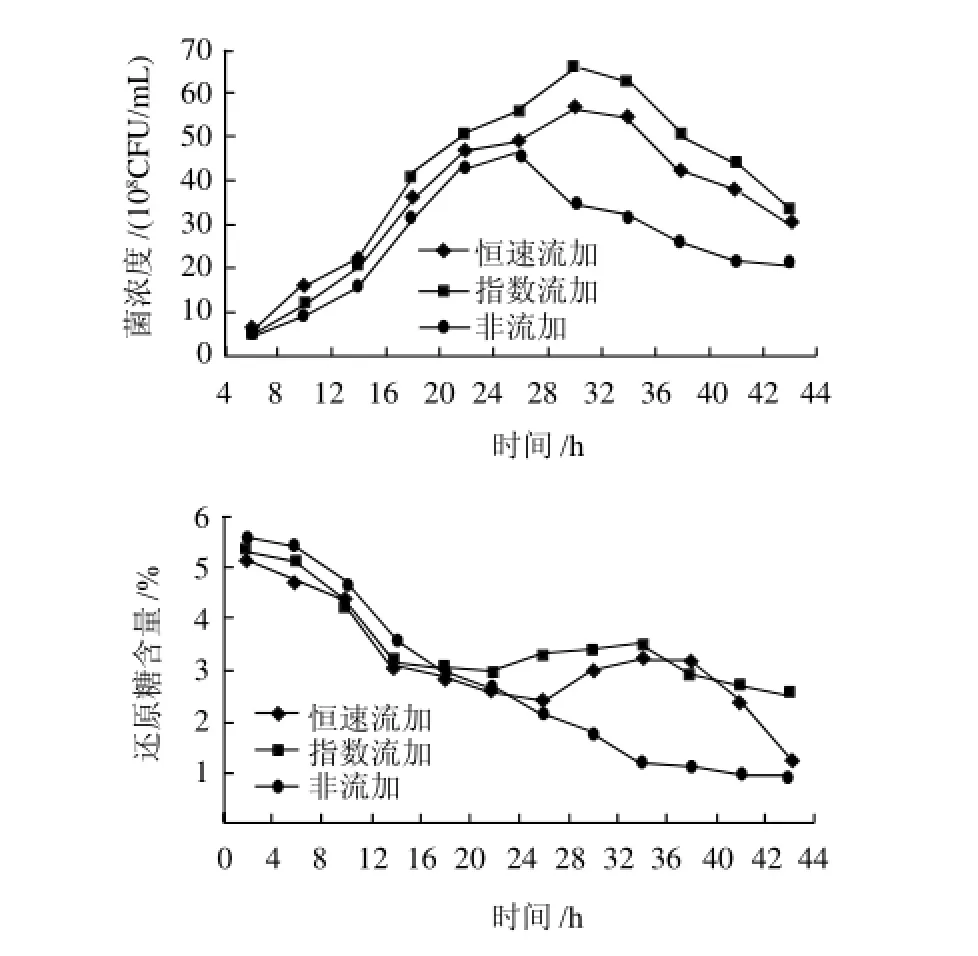
图10 流加方式对菌浓度和还原糖含量的影响Fig.10 Effect of feeding batch mode on cell density of L. plantarum and reducing sugar content
由图10可知,指数流加培养的效果最佳,菌浓度能达到6.6×109CFU/mL,而恒速流加能达到5.5× 109CFU/mL,两种流加培养方式的菌浓度都高于非流加培养。
在高密度培养早期,细胞浓度较低,流加速率必须控制在较低水平,葡萄糖过量会影响植物乳杆菌发酵,而随着细胞的生长,碳源和氮源不断被大量消耗,菌体生长速率也随之降低。指数流加是根据菌体的生长曲线以及还原糖含量进行流加,其流加速率与生长曲线和还原糖含量同步,在指数生长区间进行流加;而恒速流加只是在发酵初期能满足细菌对营养物质的要求,随着细胞生长,碳、氮源消耗过快,则不能满足菌体对营养物质的需求。综上所述,本实验选择指数流加方法对植物乳杆菌进行高密度培养。
2.3.3 中和法和指数流加法综合利用对高密度培养的影响
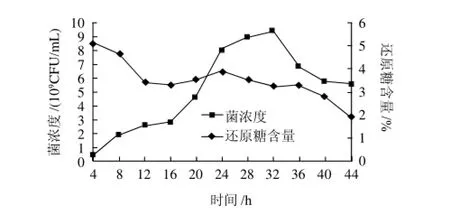
图11 中和法和指数流加综合利用的菌体生长曲线和还原糖含量变化Fig.11 Combined effect of neutralization and exponential feeding method on cell density of L. plantarum and reducing sugar content
如图11所示,中和法与指数流加法综合应用于植物乳杆菌高密度培养时效果明显,可以提高菌体的生长速率,最终菌浓度达到9.3×109CFU/mL。中和法和指数流加法相结合的综合利用不仅能消除乳酸对菌体的酸胁迫效应,还能满足菌体在对数生长期大量营养物的需求。
3 结 论
以植物乳杆菌NCU116为实验菌种进行高密度培养,经过单因素试验以及响应面试验设计分析,最终得到发酵培养基的配方为葡萄糖质量分数5.43%、蛋白胨质量分数0.98%、K2HPO4质量分数0.59%,在接种量为3%、培养温度35℃、pH6.5,中和法和指数流加综合利用,培养结束后最终菌浓度达到9.3×109CFU/mL。
[1] 张刚. 乳酸细菌: 基础、技术和应用[M]. 北京: 化学工业出版社, 2007: 212- 266.
[2] GARDNER N J, SAVARD T, OBERMEIER P, et al. Selection and characterization of mixed starter cultures for lactic acid fermentation of carrot, cabbage, beet and onion vegetable mixtures[J]. International Journal of Food Microbiology, 2001, 64(3): 261-275.
[3] 吴祖芳, 刘璞, 翁佩芳. 榨菜加工中乳酸菌技术的应用及研究进展[J]. 食品与发酵工业, 2005, 31(8): 73-76.
[4] 吴祖芳, 刘璞, 翁佩芳. 传统榨菜腌制加工应用乳酸菌技术的研究[J]. 食品工业科技, 2008(2): 101-103.
[5] 申彤, 徐静. 植物原料乳酸菌发酵剂增菌培养的研究[J]. 食品科技, 2006(9): 47- 49.
[6] PEEBLES M M, GILLILAVD S E, SPECK M L. Preparation of concentrated lactic streptococcus starters[J]. Appl Microbiol, 1969, 17(1): 805-810.
[7] 张安平. 重组大肠杆菌培养条件的优化及其高密度发酵的初步研究[D]. 北京: 中国科学院化工冶金研究所, 1996.
[8] 陈洪章, 李佐虎. 酵母菌的高密度发酵[J]. 工业微生物, 1998, 28(1): 28-31.
[9] 李民, 陈常庆. 重组大肠杆菌高密度发酵研究进展[J]. 生物工程进展, 2000, 20(2): 26-30.
[10] 靳志强, 李平兰. 补料分批法高密度培养德氏乳杆菌保加利亚亚种S-1[J]. 中国乳品工业, 2007, 35(1): 4-9.
[11] HAYAKAWA K, SANSAWA H, NAGUMEME T. High density culture of Lactobacillus casei by cross flow culture flow culture method based on kinetic properties of the micorganism[J]. Ferment Bioeng, 1990, 70 (1): 404-405.
[12] SUZUKI T. A dense cell culture system for microorganisms using a stirred ceramic filters[J]. Ferment Bioeng, 1996, 82(1): 264-271.
[13] 熊泽, 仇敏, 邵伟, 等. 瑞士乳杆菌冻干发酵剂制备中保护剂的选择[J]. 冷饮与速冻食品工业, 2006, 12(3): 20-21; 24.
[14] 张艳, 刘均娥, 张晶, 等. 平板活菌计数法检测粪便中的肠道菌群[J].首都医科大学学报, 2008, 29(1): 85-86.
[15] 中国国家标准化管理委员会. GB/T 5009.7—2008 食品中还原糖的测定[S]. 北京: 中国标准出版社, 2008.
[16] SOLIMAN N A, BEREKAA M M, ABDEL-FATTAH Y R. Polyglutamic acid (PGA) production by Bacillus sp. SAB- 26: Application of Plackett-Burman experimental design to evaluate culture requirements[J]. Appl Microbiol Biotechnol, 2005, 69(1): 259-267.
Lactobacillus plantarum: Optimization of Fermentation Medium and Investigation of High-density Culture Methods
XIONG Tao,HUANG Jin-qing,SONG Su-hua,GUAN Qian-qian,XIE Ming-yong
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In this study, response surface methodology was applied to optimize medium composition for Lactobacillus plantarum, and high-density cultivation of L. plantarum was optimized by neutralization and exponential feeding method. On the basis of single-factor experiments, the optimal fermentation medium formula was determined by central composite design combined with response surface methodology to be made up of 5.43% glucose, 0.98% peptone and 0.59% K2HPO4. Ammonia neutralization and exponential feeding carbon and nitrogen sources together operated in a 15 L fermenter under the optimal conditions (inoculation amount of 3%, pH 6.5 and cultivation temperature of 35 ℃) resulted in a final cell concentration of up to 9.3×109CFU/mL.
L. plantarum;response surface;medium optimization;high-density culture;exponential feeding batch
TS201.3
A
1002-6630(2011)07-0262-07
2010-07-26
教育部留学回国人员创业基金项目;江西省青年科学家(井冈之星)培养项目(2009年135号)
熊涛(1970—),男,教授,博士研究生,研究方向为细胞工程和酶工程。E-mail:xt-ncu@hotmail.com

