地衣芽孢杆菌弹性蛋白酶纯化和性质研究
傅明亮,刘晓杰,刘 婧,何国庆,陈启和*
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310029)
地衣芽孢杆菌弹性蛋白酶纯化和性质研究
傅明亮,刘晓杰,刘 婧,何国庆,陈启和*
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310029)
用地衣芽孢杆菌发酵液制备弹性蛋白酶粗酶液,采用硫酸铵分级沉淀和Sephadex凝胶柱层析的方法分离纯化弹性蛋白酶,并对弹性蛋白酶的酶学性质进行研究。结果表明:弹性蛋白酶粗酶液经40%~70%饱和度的硫酸铵纯化后比活力提高到120U/mg,经凝胶柱层析纯化后比活力可达到292U/mg,纯化倍数为12.6,SDS-PAGE法证实弹性蛋白酶分子质量为29.5kD。对酶学性质的研究结果表明:弹性蛋白酶最适反应温度为55℃,最适反应pH值为7.4,以刚果红-弹性蛋白为底物,米氏常数Km为9.67mg/mL。低浓度金属离子Ca2+和K+对酶活力有促进作用,而Mg2+、Mn2+、Zn2+和Al3+对酶活力则有抑制作用。
地衣芽孢杆菌ZJUEL31410;弹性蛋白酶;纯化;酶学性质
弹性蛋白酶(EC 3.4.4.7,elastase),是一种以水解不溶性弹性蛋白为特征的蛋白水解酶,可作为治疗高血脂症、防止动脉粥样硬化的生化药物[1]。兰辛[2]研究发现,弹性蛋白酶能有效抑制用高脂高营养饲料喂养小鼠的血清和胆固醇的升高,降低体内甘油三酯(TG)和丙二醛含量(MDA)。此外,由于弹性蛋白酶能够专一降解结缔组织中坚韧的弹性纤维组分,当其他蛋白与弹性蛋白共存时,此酶优先对弹性蛋白水解,因此弹性蛋白酶可以作为理想的肉类嫩化剂用于食品加工业[3]。
弹性蛋白酶可由动物胰脏提取或由微生物发酵制得,我国弹性蛋白酶的生产主要从猪胰脏提取,但由于脏器资源利用受限制,弹性蛋白酶向来供不应求,因此研究者都转向微生物发酵法制备弹性蛋白酶[4]。微生物弹性蛋白酶与猪胰弹性蛋白酶一样,具有广泛的水解活性,不但能降解弹性硬蛋白,而且对酪蛋白、明胶、血纤维蛋白、血红蛋白、白蛋白等多种蛋白质都有分解作用,是一种广谱的肽链内切酶。利用微生物大规模工业化发酵生产弹性蛋白酶在国外早已开始,并取得了巨大进展,已经出现了商品化的弹性蛋白酶[5]。国外学者已发现一系列具有产弹性蛋白酶能力的微生物,包括P.aeruginosa、F. immotum、B. subtilis等[6-8]。近年来,国内学者也从土壤中分离出大批菌株,经鉴定这些菌株大多属于芽孢杆菌属[9-11]。本课题组在前期研究中从肉联厂和屠宰场附近的土壤中分离筛选获得一株高产弹性蛋白酶的地衣芽孢杆菌[12],本实验对该地衣芽孢杆菌弹性蛋白酶进行分离纯化并对其酶学性质进行研究,以期为地衣芽孢杆菌弹性蛋白酶的开发应用提供一定的参考依据。
1 材料与方法
1.1 材料、试剂与培养基
地衣芽孢杆菌Bacillus licheniformis ZJUEL31410为本课题组从土壤中分离所得,现保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC 1397。
刚果红-弹性蛋白、Marker蛋白 美国Sigma公司;酪蛋白 上海研生生化试剂有限公司;考马斯亮蓝G-250 美国Fluka公司;Sephadex G-100 美国Phamacia公司。
发酵培养基(g/L):酪蛋白11.30、葡萄糖74.0、玉米提取物6.16、K2HPO22.06、MgSO4·2H2O 0.34,pH7.5。
1.2 仪器与设备
HD-93-1型核酸蛋白检测仪 上海金达生化仪器厂;恒流泵、分步收集器 上海精科实业有限公司;JS-380A自动凝胶成像系统 上海培清科技有限公司;DH-8D型电热恒温水浴锅 上海一恒科技有限公司;Beckman冷冻高速离心机 美国Beckman公司; TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司;Christ ALPHA 1-4 LD Plus针孔冷冻干燥机 德国Christ公司。
1.3 培养方法
斜面种子活化完成后,转接一环用于液体种子的培育,37℃培养18h后,按5%的接种量接种于发酵培养基,在旋转式摇床上于37℃、转速220r/min条件下发酵培养24h。250mL三角瓶中液体种子和发酵培养基装液量为25mL。
1.4 地衣芽孢杆菌弹性蛋白酶活性测定
弹性蛋白酶活力测定采用分光光度法,见文献[12]。称取20mg刚果红-弹性蛋白溶于1mL水中,加1mL pH7.4、0.2mol/L的硼酸缓冲液和1mL适当稀释的酶液于37℃振荡反应20min,加入pH6.0、0.7mol/L磷酸钠缓冲液2mL终止反应,过滤后取上清液在波长495nm处测定光密度,采用蒸馏水替代酶液的反应体系为空白。在此反应条件下溶解1mg刚果红-弹性蛋白底物所需的酶量定义为1个弹性蛋白酶活力单位(U)。
1.5 硫酸铵分级盐析
硫酸铵分级盐析方法参见文献[13]。
1.6 SephadexG-100凝胶柱层析
盐析获得的沉淀物溶解于0.2mol/L pH7.4硼酸缓冲液中,活性炭脱色后,用0.2mol/L的硼酸缓冲液透析至透析液中检测不到铵根离子,过Sephadex G-100柱(3cm× 100cm),用相同的缓冲液进行洗脱,流速为15mL/h,用核酸/蛋白检测仪检测,分步收集有酶活性组分,每管2mL,用去离子水透析过夜,冷冻浓缩后于4℃保存,用于SDS-PAGE电泳和酶学性质研究。
1.7 SDS-PAGE电泳
采用垂直式SDS-PAGE凝胶电泳,12%的分离胶和5%的浓缩胶,其具体实验操作方法和步骤见文献[14],用凝胶成像系统对电泳所得的条带进行分析,以验证各纯化步骤的效果并确定弹性蛋白酶的分子质量。
1.8 地衣芽孢杆菌弹性蛋白酶酶学性质研究
1.8.1 地衣芽孢杆菌弹性蛋白酶分子质量测定
将样品与已知分子质量的蛋白Marker进行SDSPAGE电泳,然后以相对迁移率计算出地衣芽孢杆菌弹性蛋白酶的分子质量。
1.8.2 地衣芽孢杆菌弹性蛋白酶最适反应pH值测定
将地衣芽孢杆菌弹性蛋白酶分别加到pH值为6.0、6.5、7.0、7.4、8.0、8.5、9.0的缓冲液中,在37℃条件下测定酶活力,以最高酶活力为100%,其他与之相比计算相对酶活力,考察酶最适反应pH值。
1.8.3 地衣芽孢杆菌弹性蛋白酶最适反应温度测定
地衣芽孢杆菌弹性蛋白酶在最适反应pH值条件下,分别在不同温度(30、37、45、50、55、60、70℃)条件下测定酶活力,以最高酶活力为100%,其他与之相比计算相对酶活力,考察酶最适反应温度。
1.8.4 金属离子对地衣芽孢杆菌弹性蛋白酶活性的影响
将地衣芽孢杆菌弹性蛋白酶分别加到含0.3、3mol/L的Ca2+、K+、Mg2+、Mn2+、Zn2+和Al3+的溶液中,37℃保温4h后,在37℃、pH7.4条件下测定酶活力,以浸泡前的酶活力为对照,计算相对酶活力,考察酶的金属离子稳定性。
1.8.5 弹性蛋白酶的反应动力学
在pH7.4条件下,配制不同浓度的刚果红-弹性蛋白底物,37℃条件下反应,测定弹性蛋白酶的反应初始速率,以反应速率倒数1/v为纵坐标,底物浓度倒数1/[S]为横坐标作图,得到斜率为Km/vmax的直线,由此得到Km值。
2 结果与分析
2.1 地衣芽孢杆菌弹性蛋白酶的纯化
在最佳产酶条件下,发酵制备得到地衣芽孢杆菌的发酵液,经过离心,其上清液即为粗酶液。粗酶液经不同饱和度的硫酸铵沉淀后测定酶活力。结果表明地衣芽孢杆菌弹性蛋白酶主要集中在40%~70%硫酸铵饱和度的沉淀中,因此硫酸铵分级沉淀范围为40%~70%饱和度。将硫酸铵分级沉淀后得到的蛋白溶液透析浓缩,用Sephadex G-100凝胶层析柱层析纯化,结果见表1,两步纯化后,地衣芽孢杆菌蛋白酶纯化了近13倍。
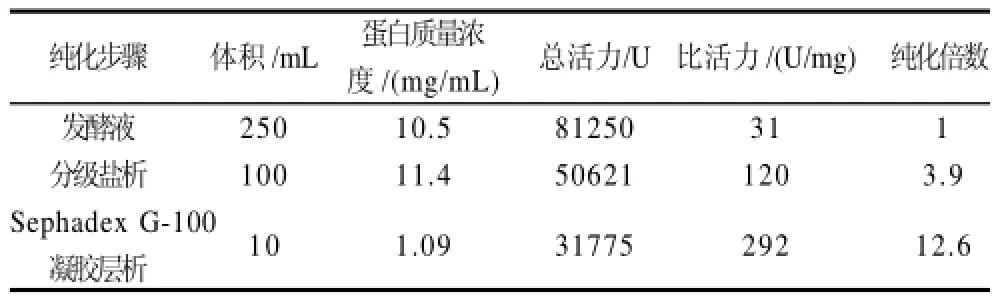
表1 地衣芽孢杆菌弹性蛋白酶纯化步骤及其结果Table 1 Separation and purification procedures for Bacillus sp. EL31410 elastase
2.2 SDS-PAGE检测地衣芽孢杆菌弹性蛋白酶的纯度

图1 SDS-PAGE凝胶电泳结果Fig.1 SDS-PAGE of crudely separated elastase and purified elastase
从图1可以看出,经各步纯化后电泳图谱中蛋白质条带依次减少,Sephadex G-100柱层析后得到一条带,即纯化后的地衣芽孢杆菌弹性蛋白酶条带。将该条带与Marker标准蛋白分子质量对比并根据相对迁移率可计算出地衣芽孢杆菌弹性蛋白酶分子质量大约为29.5kD。
2.3 地衣芽孢杆菌弹性蛋白酶酶学性质分析
2.3.1 酶的最适作用pH值
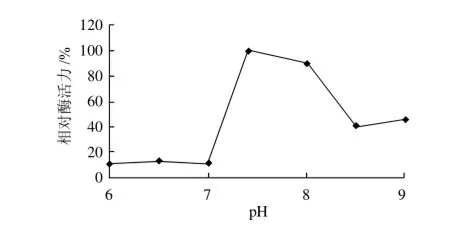
图2 地衣芽孢杆菌弹性蛋白酶的最适作用pH值Fig.2 Optimal reaction pH of Bacillus sp.EL31410 elastase
如图2所示,地衣芽孢杆菌弹性蛋白酶与底物的最适反应pH值为7.4,且在pH7.4~8.0的碱性条件下酶活力较好。
2.3.2 酶的最适反应温度

图3 地衣芽孢杆菌弹性蛋白酶的最适作用温度Fig.3 Optimal reaction temperature of Bacillus sp.EL31410 elastase
如图3所示,地衣芽孢杆菌弹性蛋白酶在55℃时酶活力最高,故最适反应温度为55℃,而且在60℃时相对酶活力与55℃非常接近,仅下降了8%,而60~70℃时相对酶活力下降很快,70℃时酶活力只剩最高时的55%。
2.3.3 金属离子对地衣芽孢杆菌弹性蛋白酶活性的影响

表2 不同金属离子对地衣芽孢杆菌弹性蛋白酶活性的影响Table 2 Effect of different metal ions on Bacillus sp.EL31410 elastase activity
从表2可知,高浓度的金属离子对地衣芽孢杆菌弹性蛋白酶活力影响很大,尤其是高浓度的Zn2+和Al3+,在此条件下酶几乎失活。在这6种金属离子中,低浓度的Ca2+和K+能激活地衣芽孢杆菌弹性蛋白酶活性,而Mg2+、Mn2+、Zn2+和Al3+可不同程度地抑制地衣芽孢杆菌弹性蛋白酶活性,与谷新晰等[15]在重组毕赤酵母中获得的弹性蛋白酶性质相似。
2.3.4 弹性蛋白酶的酶解动力学
以刚果红-弹性蛋白为底物测定了地衣芽孢杆菌弹性蛋白酶的酶解动力学常数,以1/v对1/[S]做图得一直线,经计算得出线性方程为y=44.139x+4.5637。如图4所示,直线的斜率为Km/vmax,直线与纵轴交于1/vmax,与横轴交于-1/Km。从方程可知,Km为9.67mg/mL。
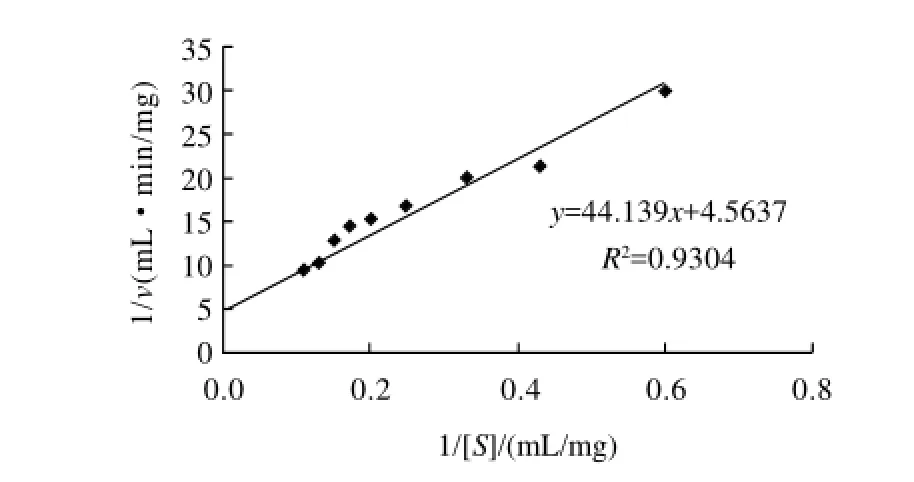
图4 地衣芽孢杆菌弹性蛋白酶的酶解Lineweaver-Burk图Fig.4 Lineweaver-Burk plot of elastase with elastin-Congo red as the substrate
3 结 论
3.1 本实验采用两步法纯化地衣芽孢杆菌弹性蛋白酶,同时用SDS-PAGE测定其分子质量。结果显示,利用40%~70%的硫酸铵分级盐析和Sephadex G-100凝胶层析后,地衣芽孢杆菌弹性蛋白酶比活力较粗酶液提高了近13倍,在SDS-PAGE凝胶图谱中得到比较明晰的条带,计算出其分子质量约为29.5kD。
3.2 通过对层析纯化后地衣芽孢杆菌弹性蛋白酶的酶学性质研究表明,其最适作用温度为55℃,最适作用pH值为7.4。此外,考察了多种金属离子对地衣芽孢杆菌弹性蛋白酶活力的影响,发现低浓度Ca2+和K+对其有激活作用,而其他离子可不同程度地抑制其活性。以刚果红-弹性蛋白为底物,对地衣芽孢杆菌弹性蛋白酶的酶解动力学常数进行了研究,其酶解反应的米氏常数Km为9.67mg/mL。
[1] 陈启和. 弹性蛋白酶发酵工艺及其发酵动力学研究[D]. 杭州: 浙江大学, 2003.
[2] 兰辛. 弹性蛋白酶在调节血脂及预防改善酒精肝方面的作用研究[J].现代食品科技, 2008, 24(11): 17-19.
[3] 刘小杰, 陈启和, 孙桥. 弹性蛋白酶的研究进展[J]. 中国食品添加剂, 2004(4): 29-32.
[4] 章海锋, 刘婧, 杨潞芳, 等. 微生物产弹性蛋白酶分子研究进展[J].粮油加工, 2008(8): 110-112.
[5] 颜子颖, 关国雄. 微生物弹性蛋白酶的研究进展[J]. 微生物学通报, 1991, 18(6): 356-359.
[6] MORIHARA K, TSUZUKI H, OKA T, et al. Pseudomonas aeruginosa elastase isolation, crystallization, and preliminary characterization[J]. J Biol Chem, 1965, 240(18): 3295-3303.
[7] SHIIO I, OZAKI H. Properties of elastolytic enzymes from Flavobacterium immotum[J]. J Biochem, 1975, 77: 171-180.
[8] KAUR M, TRIPATHI K K, GUPTA M, et al. Production and partial characterization of elastase of Bacillus subtilis isolated from the cervices of human females[J]. Canad J Microbiol, 1988, 34: 855-859.
[9] 刘双发, 安德荣, 苟丽霞, 等. 新的产弹性蛋白酶菌株的筛选与鉴定[J]. 微生物学报, 2009, 36(9): 1345-1349.
[10] 张娟, 刘书亮, 吴琦, 等. 产弹性蛋白酶芽孢杆菌的筛选与鉴定[J].四川农业大学学报, 2007, 25(3): 253-256.
[11] 方尚玲, 吉园. 弹性蛋白酶产生菌的分离鉴定和发酵条件研究[J]. 食品科学, 2007, 28(11): 306-309.
[12] 陈启和, 何国庆, 邬应龙. 弹性蛋白酶产生菌的筛选及其发酵条件的初步研究[J]. 浙江大学学报: 农业与生命科学版, 2003(1): 59-64.
[13] 赵永芳. 生物化学技术原理及其应用[M]. 4版. 武汉: 武汉大学出版社, 2008.
[14] HAMES B D, RICKWOOD D. Gel electrophoresis of proteins: a practical approach[M]. 2nd ed. Oxford: Oxford University Press, 1990.
[15] 谷新晰, 许文涛, 黄昆仑, 等. 重组弹性蛋白酶诱导表达、纯化及酶学特性研究[J]. 食品科学, 2009, 30(19): 227-231.
Purification and Characteristics of Elastase Produced by Bacillus licheniformis
FU Ming-liang,LIU Xiao-jie,LIU Jing,HE Guo-qing,CHEN Qi-he*
(School of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310029, China)
The fermentation supernatant (rich in elastase) of Bacillus licheniformis ZJUEL31410, a strain isolated from soil, was used as a crude enzyme solution, from which elastase was separated by (NH4)2SO4segmentation precipitation and purified by Sephadex gel column chromatography. The enzymatic characteristics of purified elastase were measured. The specific activity of elastase could be increased to 120 U/mg through (NH4)2SO4precipitation with 40%-70% saturation degree and continually increased to 292 U/mg after Sephadex gel column purification and the purification fold was 12.6. SDS-PAGE studies demonstrated that the enzyme had a molecular weight of 29.5 kD. The optimum reaction temperature and pH were 55 ℃ and 7.4, respectively, and the Michaelis constant Km was 9.67 mg/mL with elastin-Congo red as the substrate. Low concentrations of Ca2+and K+could enhance elastase activity, while Mg2+, Mn2+, Zn2+and Al3+revealed an inhibition effect.
Bacillus licheniformis ZJUEL31410;elastase;purification;enzymatic properties
TS201
A
1002-6630(2011)07-0216-04
2010-06-06
浙江省自然科学基金项目(Y307405)
傅明亮(1987—),男,硕士研究生,研究方向为食品科学。E-mail:fuml@zju.edu.cn
*通信作者:陈启和(1975—),男,副教授,博士,研究方向为生物技术与生物工程。E-mail:chenqh@zju.edu.cn

