酸菜来源植物乳杆菌S4-5的降胆固醇作用
李常营,卢晓霆,于志会,张 雪,李 达,牛春华,王 辑,杨贞耐,,,*
(1.长春工业大学化学与生命科学学院,吉林 长春 130012;2.吉林大学生物与农业工程学院,吉林 长春 130022;3.吉林省农业科学院农产品加工研究中心,吉林 长春 130033;4.吉林农业大学食品科学与工程学院,吉林 长春 130018)
酸菜来源植物乳杆菌S4-5的降胆固醇作用
李常营1,卢晓霆1,于志会2,张 雪3,李 达3,牛春华3,王 辑4,杨贞耐2,3,4,*
(1.长春工业大学化学与生命科学学院,吉林 长春 130012;2.吉林大学生物与农业工程学院,吉林 长春 130022;3.吉林省农业科学院农产品加工研究中心,吉林 长春 130033;4.吉林农业大学食品科学与工程学院,吉林 长春 130018)
对酸菜来源植物乳杆菌S4-5的体外降胆固醇作用进行研究。采用单因素试验研究胆盐添加量、胆固醇添加量、培养基初始pH值及培养时间对植物乳杆菌S4-5降胆固醇能力的影响,结果表明:在胆盐质量浓度为1.0mg/mL和胆固醇质量浓度为175.7mg/L时,植物乳杆菌S4-5有最高的胆固醇移除率,分别为67.7%和62.2%;植物乳杆菌S4-5在培养基不同初始pH值条件下对胆固醇的移除率均在71.3%~77.2%之间;培养时间对植物乳杆菌S4-5的降胆固醇作用有显著性影响(P<0.01),在培养2h(延滞期结束)、14h(指数期结束)、24h和48h后植物乳杆菌S4-5对胆固醇的移除率分别为4.8%、66.7%、75.3%和84.0%。
酸菜;植物乳杆菌;胆固醇
人们普遍认为高血清胆固醇是引发心脑血管疾病的重要因素之一,由于使用药物降低体内胆固醇有一定的副作用,目前人们正寻找更加安全、有效的降低血清胆固醇的方法。Shaper等[1]和Mann等[2]均发现肯尼亚北部马赛人的血脂水平较低,并认为和他们长期饮用自制发酵乳制品有关系。Mathara等[3]从这种发酵乳中分离出了23株乳酸菌,并对这些乳酸菌的益生作用进行了研究,结果表明部分乳杆菌有体外降胆固醇作用。而Nguyen等[4]从婴儿肠道中分离出了植物乳杆菌PH04,并证实其有降胆固醇作用。因此利用乳酸菌降低胆固醇成为国内外研究的热点,国内研究起步较晚但是发展较快,Zeng 等[5]从酸菜汁中分离出了一株布赫内氏乳杆菌P2,研究结果表明该菌株具有43.95%的体外胆固醇移除率。我国台湾Wang等[6]在用乳杆菌发酵的薏苡乳灌喂田鼠的实验中发现乳杆菌有显著降低田鼠体内血清胆固醇水平的作用,并增加低密度脂蛋白的比例。但是不同的菌株对胆固醇的移除能力有差异,尤其是对作用机理的研究还不是很充分。
目前研究人员从发酵乳制品[3,7]、藏灵菇[8]、发酵肉制品[9]、发酵蔬菜制品[5]及人体肠道[4,10]等不同来源中均分离出了乳酸菌,并证实均有降胆固醇作用。东北酸菜是我国东北地区传统的发酵食品,经过自然发酵而成,并含有大量的乳酸菌。因此从酸菜中分离出具有降胆固醇作用的菌株,开发新型功能性产品具有重要意义,本实验对酸菜来源的一株植物乳杆菌S4-5进行体外降胆固醇研究,为研究乳酸菌降胆固醇的作用机理及其生产应用提供参考。
1 材料与方法
1.1 材料与试剂
植物乳杆菌S4-5由吉林省农业科学院农产品加工研究中心提供,分离于东北酸菜。
胆盐(bile salt)、胆固醇(分析纯)、巯基乙酸钠(分析纯) 美国Sigma公司;正己烷(分析纯) 国药集团化学试剂有限公司。
MRS培养基:葡萄糖2.0g、蛋白胨 1.0g、牛肉膏1.0g、酵母浸粉0.5g、无水乙酸钠0.5g、柠檬酸钠0.5g、磷酸氢二钾0.2g、吐温-80 0.1mL、七水硫酸镁0.05g、硫酸锰0.005g、加水至100mL,pH6.6。
MRS-THIO培养基:巯基乙酸钠0.2g,MRS培养基100mL。
1.2 仪器与设备
Evolution RC高速离心机 美国Thermo Sorvall公司;722可见分光光度计 上海光谱仪器有限公司。
1.3 方法
1.3.1 胆固醇质量浓度的测定[11]
将培养后的菌液于4℃、6000×g离心10min,取上清液0.5mL于18mm×18cm试管中,依次加入3mL 体积分数为95%的乙醇和2mL 质量浓度为0.5g/mL的氢氧化钾溶液,漩涡振荡混匀后置于60℃水浴中皂化10min,迅速冷却后加入5mL正己烷,漩涡振荡1min进行萃取,静置10min后加入3mL水,重复振荡1min后在室温静置10min,待分层后取2.5mL正己烷层于15mm× 15cm试管中,置于60℃水浴中用氮气吹干溶剂,加入4mL邻苯二甲醛显色剂,漩涡振荡1min后静置10min,加入2mL浓硫酸振荡1min,室温静置10min后于波长550nm处测吸光度,根据胆固醇与吸光度标准曲线回归方程计算胆固醇的质量浓度。
1.3.2 绘制胆固醇质量浓度与吸光度标准曲线
在含1.0mg/mL胆盐的MRS-THIO培养基中添加不同质量浓度的胆固醇,37℃培养24h后测定培养基中胆固醇的质量浓度,以吸光度为横坐标,胆固醇的质量浓度为纵坐标绘制工作曲线,进行函数拟合得到曲线回归方程,用于计算胆固醇的质量浓度。胆固醇的移除率按下列公式计算:

式中:ρ1为培养后上清液胆固醇的质量浓度;ρ0为初始培养基总胆固醇的质量浓度。
1.3.3 胆盐质量浓度对植物乳杆菌S4-5降胆固醇能力的影响
在添加175.7mg/L胆固醇的MRS-THIO培养基中添加不同质量浓度的胆盐,按体积分数3%接种量接种后37℃培养24h,4℃、6000×g离心10min后测定培养基中胆固醇的质量浓度,以未接种的高胆固醇培养基作为空白对照。每个实验重复3次。
1.3.4 胆固醇质量浓度对植物乳杆菌S4-5降胆固醇能力的影响
在含1.0mg/mL胆盐的MRS-THIO培养基中添加不同质量浓度的胆固醇,按体积分数3%接种量接种后37℃培养24h,4℃、6000×g离心10min后测定上清液中胆固醇的质量浓度,以未接种的高胆固醇培养基作为空白对照。每个实验重复3次。
1.3.5 培养时间对植物乳杆菌S4-5降胆固醇能力的影响
在含1.0mg/mL胆盐的MRS-THIO培养基中添加胆固醇,使其最终质量浓度为175.7mg/L,按体积分数3%接种量接种后37℃培养,在不同培养时间测定培养基中残留胆固醇的质量浓度,同时在600nm波长处测定光密度值(OD600nm)绘制生长曲线,以未接种的高胆固醇培养基作为空白对照。每个实验重复3次。
1.3.6 培养基初始pH值对植物乳杆菌S4-5降胆固醇能力的影响
在含1.0mg/mL胆盐的MRS-THIO培养基中添加胆固醇,使其最终质量浓度为175.7mg/L,并调节pH3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,按体积分数3%接种量接种后37℃培养24h,4℃、6000×g离心10min后取上清液测定胆固醇质量浓度,以未接种的高胆固醇培养基作为空白对照。每个实验重复3次。
2 结果与分析
2.1 胆固醇质量浓度与吸光度标准曲线
以吸光度(A550nm)为横坐标,胆固醇质量浓度(mg/L)为纵坐标绘制曲线。结果显示在较高胆固醇质量浓度时,胆固醇质量浓度和吸光度并不成线性关系,用Microsoft Excel 2003进行函数拟合。拟合方程为y =-302.5x2+ 517.62x-13.455(R2=0.9991),式中:x为吸光度(A550nm)y为胆固醇的质量浓度/(mg/L)。
2.2 胆盐质量浓度对植物乳杆菌S4-5降胆固醇能力的影响
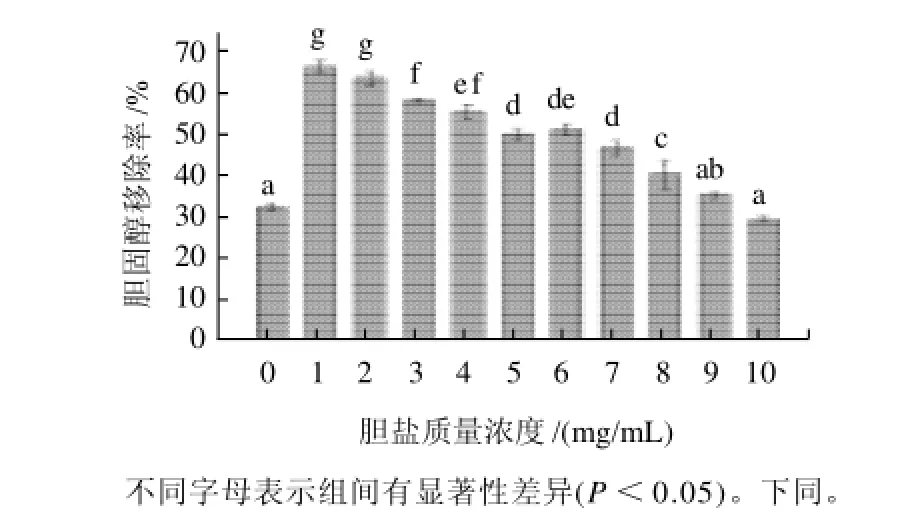
图1 植物乳杆菌S4-5在不同胆盐质量浓度时的胆固醇移除率Fig.1 Cholesterol removal by L. plantarum S4-5 in the presence of different concentrations of bile salt
如图1所示,胆盐质量浓度对植物乳杆菌S4-5的降胆固醇能力有显著影响(P<0.05),随着胆盐质量浓度的升高其降胆固醇能力逐次降低。在胆盐质量浓度为1.0mg/mL时,植物乳杆菌S4-5对胆固醇的移除率为67.7%,随着胆盐质量浓度的升高,相应移除率逐渐降低;当胆盐质量浓度达到10.0mg/mL时,只有约30.1%胆固醇被移除,和不加胆盐的作用相似(32.9%),这说明当胆盐的质量浓度过高时会抑制植物乳杆菌S4-5降低胆固醇。Ramasamy等[12]的研究结果表明部分乳杆菌降胆固醇能力和胆盐水解有一定的关系,说明了胆盐的存在有利于菌体对胆固醇的移除,同时Parvez 等[13]通过实验证实在胆盐存在下双歧杆菌有降胆固醇作用。但是高质量浓度胆盐反而会降低移除率,这可能和高质量浓度胆盐抑制菌体生长有关。
2.3 胆固醇质量浓度对植物乳杆菌S4-5降胆固醇能力的影响

图2 植物乳杆菌S4-5在不同胆固醇质量浓度时的胆固醇移除率Fig.2 Cholesterol removal by L. plantarum S4-5 in the presence of different concentrations of cholesterol
如图2所示,在添加不同质量浓度胆固醇的MRS-THIO培养基中,植物乳杆菌S4-5对胆固醇的移除率是不同的,结果显示胆固醇质量浓度对植物乳杆菌S4-5的降胆固醇能力有显著影响(P<0.05),随着胆固醇质量浓度的增加,相应的胆固醇移除率也增大。当胆固醇添加量为175.7mg/L时,植物乳杆菌S4-5对胆固醇有最大移除率,为62.2%,当胆固醇质量浓度升高到195.2mg/L时其对胆固醇移除率反而下降为60.0%。Zeng等[5]认为同化吸收是布赫内氏乳杆菌P2降胆固醇的主要途径,这表明乳杆菌在生长周期内随着培养基中胆固醇质量浓度升高会吸附更多的胆固醇,当吸附达到饱和时,即使增加环境中胆固醇质量浓度,菌体细胞也不会再吸附更多的胆固醇。
2.4 培养基初始pH值对植物乳杆菌S4-5降胆固醇能力的影响
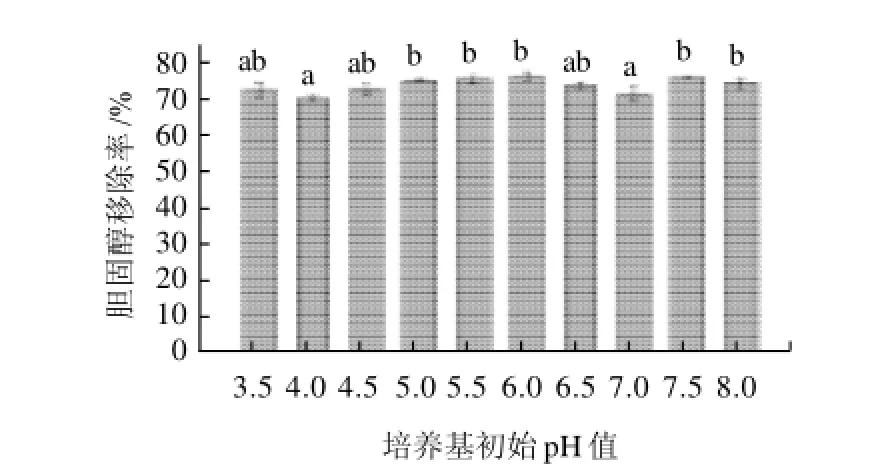
图3 植物乳杆菌S4-5在不同培养基初始pH值条件下的胆固醇移除率Fig.3 Effect of initial pH of medium on cholesterol removal by L. plantarum S4-5
如图3所示,在不同初始pH值MRS-THIO培养基中添加胆盐(1.0mg/mL)和胆固醇(175.7mg/L)后,接种培养24h后发现植物乳杆菌S4-5对培养基中胆固醇的移除率均在71.3%~77.2%之间,即使在低酸(pH3.5)环境下依然有较高的胆固醇移除率74.0%,这说明酸性环境可能促使胆固醇被移除。Klaver 等[14]研究结果表明酸性环境有利于胆酸和胆固醇共沉淀发生,从而降低胆固醇水平。在pH4.0~7.0范围内,pH6.0时有最大胆固醇移除率(77.2%),但是在偏碱性(pH8.0)环境下,植物乳杆菌S4-5仍有较高的胆固醇移除能力(75.2%)。其移除机理目前还不明确,但可能和菌体生长产酸使培养基酸化有关系。
2.5 培养时间对植物乳杆菌S4-5降胆固醇能力的影响
植物乳杆菌S4-5在不同培养时间胆固醇移除率有显著差异(P<0.01,图4),随着培养时间延长其胆固醇移除率逐渐增大。在0~2h培养阶段(延滞期,图5)植物乳杆菌S4-5的胆固醇移除率增加缓慢,从0.6%增加到4.8%,在2~8h 培养阶段(指数生长前期,图5)胆固醇移除率缓慢增加,从4.8%增加到22.2%,而在8~14h培养阶段(指数生长期后期,图5)植物乳杆菌的移除率增加较快,相应的移除率为22.2%~66.7%,这说明植物乳杆菌S4-5的降胆固醇作用和菌体生长状态有一定关系。Zhao等[15]的研究结果表明乳酸菌在培养初期12h有最大的移除量,本研究结果也表明植物乳杆菌S4-5在对数生长期对胆固醇的移除率快速增加,这说明胆固醇的移除和细胞生长有一定关系,Wang等[8]通过灌喂含植物乳杆菌制剂发现小鼠体内的胆固醇通过菌体细胞表面吸附方式随粪便排出体外,进一步说明胆固醇的移除量和菌体的生长量有关系。Mishra等[16]的实验结果表明干酪乳杆菌NCDC17在培养48h后有最大胆固醇移除量,本实验结果也表明在培养48h后发现植物乳杆菌S4-5对胆固醇的移除率可达到84.0%(图4),进一步说明乳酸菌的降胆固醇作用和培养时间有关。

图4 植物乳杆菌S4-5在不同培养时间的胆固醇移除率Fig.4 Time course of cholesterol removal by L. plantarum S4-5 during incubation
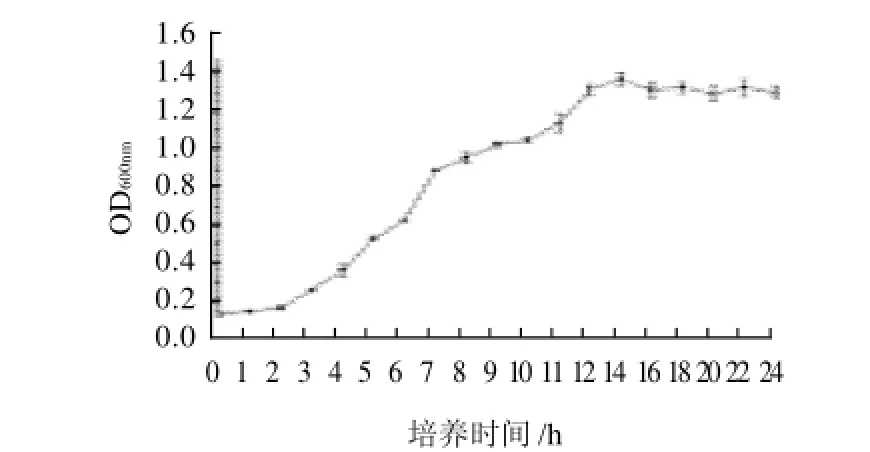
图5 植物乳杆菌S4-5在MRS-THIO培养基中的生长曲线Fig.5 Growth curve of L. plantarum S4-5 in MRS-THIO medium
乳酸菌降低胆固醇的作用机理一直是讨论的热点,研究人员主要是针对胆盐、菌体细胞生长及培养基酸度等方面提出各种作用机理,有胆盐共沉淀[14],细胞表面吸附[11]等理论。但是随着进一步研究,又有新的理论解释乳酸菌降低胆固醇的现象,如Lye等[17]提出了5种降胆固醇作用机理,并认为是同时在起作用。同时,报道的布赫内氏乳杆菌P2在体外的胆固醇移除率为43.95%[5],在大鼠饲喂中发现植物乳杆菌PH04有7%的降低体内总胆固醇作用[4],而在本实验中发现植物乳杆菌S4-5在体外的降胆固醇移除率达到了75.3%,对其体内的降胆固醇作用还需进一步研究。同时其作用机理目前还不明确,还需要进一步实验说明培养基pH值对植物乳杆菌S4-5降胆固醇作用的影响。
3 结 论
植物乳杆菌S4-5在体外表现出良好的降胆固醇能力,在本实验条件下培养24h能够移除培养基中75.3%的胆固醇,在培养48h后其移除率可达到84.0%。其胆固醇移除率和菌体的生长状态有关,同时培养时间越长胆固醇移除率越大,在低pH值环境下(pH3.5),植物乳杆菌S4-5仍有较高的胆固醇移除率(74.0%),这说明酸性环境有利于胆固醇的降低。为进一步研究植物乳杆菌S4-5的体内降胆固醇作用及移除胆固醇的作用机理提供参考。
[1] SHAPER A G, JONES K W, JONES M, et al. Serun lipids in three nomadic tribes of Northern Kenya[J]. The Aerican Journal of Clinical Nutrition, 1963, 13: 135-146.
[2] MANN G V, SPOERRY A. Studies of a surfactant and cholesteremia in the Maasai[J]. The American Journal of Clinical Nutrition, 1974, 27: 464-469.
[3] MATHARA J M, SCHILLINGER U, GUIGAS C, et al. Functional characteristics of Lactobacillus spp. from traditional Maasai fermented milk products in Kenya[J]. International Journal of Food Microbiology, 2008, 126(1/2): 57-64.
[4] NGUYEN T D T, KANG J H, LEE M S. Characterization of Lactobacillus plantarum PH04, a potential probiotic bacterium with cholesterol-lowering effects[J]. International Journal of Food Microbiology, 2007, 113(3): 358-361.
[5] ZENG Xiaoqun, PAN Daodong, GUO Yuxing. The probiotic properties of Lactobacillus buchneri P2[J]. Journal of Applied Microbiology, 2010, 108(6): 2059-2066.
[6] WANG Chungyi, WU Sheching, NG Changchai, et al. Effect of Lactobacillus-fermented adlay-based milk on lipid metabolism of hamsters fed cholesterol-enriched diet[J]. Food Research International, 2010, 43(3): 819-824.
[7] LIU Jeruei, WANG Shengyao, CHEN Mingju, et al. Hypocholesterolaemic effects of milk-kefir and soyamilk-kefir in cholesterol-fed hamsters[J]. British Journal of Nutrition, 2006, 95(5): 939-946.
[8] WANG Yanping, XU Nv, XI Aodeng, et al. Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-cholesterol diet[J]. Applied Microbiology and Biotechnology, 2009, 84(2): 341-347.
[9] MANDAL V, SEN S K, MANDAL N C. Effect of prebiotics on bacteriocin production and cholesterol lowering activity of Pediococcus acidilactici LAB 5[J]. World Journal of Microbiology & Biotechnology, 2009, 25(10): 1837-1847.
[10] PEREIRA D I A, GIBSON G R. Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut[J]. Applied Environmental and Microbiology, 2002, 68(9): 4689-4693.
[11] GILLILAND S E, NELSON C R, MAXWELL C. Assimilation of cholesterol by Lactobacillus acidophilus[J]. Applied and Environmental Microbiology, 1985, 49 (2): 377-381.
[12] RAMASAMY K, ABDULLAH N, WONG M, et al. Bile salt deconjugation and cholesterol removal from media by Lactobacillus strains used as probiotics in chickens[J]. Journal of the Science of Food and Agriculture, 2010, 90(1): 65-69.
[13] PARVEZ S, KIM H Y, LEE H C, et al. Bile salt hydrolase and cholesterol removal effect by Bifidobacterium bifidum NRRL 1976[J]. World Journal of Microbiology & Biotechnology, 2006, 22(5): 455-459.
[14] KLAVER F A, van der MEER R. The assumed assimilation of cholesterol by Lactobacilli and Bifidobacterium bifidum is due to their bile salt-deconjugating activity[J]. Applied Environmental and Microbiology, 1993, 59(4): 1120-1124.
[15] ZHAO Ruixiang, SUN Junliang, MO Haizhen, et al. Analysis of functional properties of Lactobacillus acidophilus[J]. World Journal of Microbiology & Biotechnology, 2007, 23(2): 195-200.
[16] MISHRA V, PRASAD D N. Application of in vitro methods for selection of Lactobacillus casei strains as potential probiotics[J]. International Journal of Food Microbiology, 2005, 103(1): 109-115.
[17] LYE H S, RAHMAT-ALI G R, LIONG M T. Mechanisms of cholesterol removal by Lactobacilli under conditions that mimic the human gastrointestinal tract[J]. International Dairy Journal, 2010, 20(3): 169-175.
Cholesterol Removal by Lactobacillus plantarum S4-5 Isolated from Pickle
LI Chang-ying1,LU Xiao-ting1,YU Zhi-hui2,ZHANG Xue3,LI Da3,NIU Chun-hua3,WANG Ji4,YANG Zhen-nai2,3,4,*
( 1. School of Chemistry and Life Science, Changchun University of Technology, Changchun 130012, China;2. College of Biological and Agricultural Engineering, Jilin University, Changchun 130022, China;3. Center of Agro-Food Technology, Jilin Academy of Agricultural Sciences, Changchun 130033, China;4. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130018, China)
The aim of the present study was to evaluate the in vitro cholesterol removal ability of Lactobacillus plantarum S4-5, a strain isolated from pickle. Single factor experiments were carried out to explore the influences of oxgall addition, cholesterol addition, medium pH and incubation time on the ability of the strain to remove cholesterol in vitro. The results showed that the strain revealed the highest cholesterol removal rate in the media containing 1.0 mg/mL of oxgall or 175.7 mg/L of cholesterol, reaching 67.7% and 62.2%, respectively. A cholesterol removal rate ranging from 71.3% to 77.2% was observed under varying medium initial pH conditions. Incubation time had a significant impact on the cholesterol removal ability of Lactobacillus plantarum S4-5, and the removal rates after 2 (the end of the lag phase), 14 (the end of the exponential phase), 24 hours and 48 hours were 4.8%, 66.7%, 75.3% and 84.0%, respectively.
pickle;Lactobacillus plantarum;cholesterol
Q939.11
A
1002-6630(2011)07-0069-04
2010-07-27
国家自然科学基金项目(30670057);国家现代农业产业技术体系建设专项资助项目(nycytx-0502)
李常营(1983—),男,硕士研究生,研究方向为发酵工程。E-mail:liyinglove2008@vip.qq.com
*通信作者:杨贞耐(1965—),男,研究员,博士,研究方向为乳品科学。E-mail:zyang@cjaas.com

