氨茶碱对支气管哮喘气道重塑大鼠肺组织MMP-9及其基因表达的调节
段旭东 赵 辉 张雅兰 王晓媛 王晓红 (河北医科大学第二医院中医外科,河北 石家庄 050000)
支气管哮喘是一种临床常见病,气道重塑是其主要病理特征之一。研究表明〔1〕,气道重塑是气道炎症基础上气道壁损伤在多种细胞炎症介质、细胞因子作用下出现的不完全修复。气道重塑是导致气道高反应性,肺功能持续性、进行性损伤的主要原因,并可能导致顽固性哮喘,预防和逆转气道重塑是干预哮喘,尤其是顽固性哮喘的有效途径。氨茶碱作为治疗支气管哮喘的经典药物,近年来对其药理作用的研究有颇多新的发现,但多集中于抗炎、免疫调节的作用〔2〕,对气道重塑的影响研究较少。本实验拟通过建立哮喘气道重塑大鼠模型,观察氨茶碱对支气管哮喘大鼠转化生长因子-β1(TGF-β1)、基质金属蛋白酶-9(MMP-9)及基因表达的影响,探讨其作用机制。
1 材料与方法
1.1 实验动物 清洁级SD大鼠24只,雌雄各半,体重180~220 g,由华中科技大学同济医学院实验动物学部提供提供,动物合格证号:SCXK(鄂)2004-007。20℃饲养,自由进食水。
1.2 药物 氨茶碱,天津金耀氨基酸有限公司产品,批准文号:国药准字 H12020978。批号:20050917,250 mg,10 ml/支。
1.3 主要仪器及试剂 HM-200MK-3酶联免疫检测仪:芬兰雷勃公司生产。15K高速冷冻离心机、全自动洗板机、卵蛋白:美国Sigma公司产品。氢氧化铝:天津市化学试剂三厂生产,分析纯。MMP-9试剂盒:美国RB公司生产。756MC型紫外-可见光分光光度计:上海紧密科学仪器有限公司产品。PE9600型PCR扩增仪:美国PE公司产品。电泳仪及电泳槽:北京六一公司产品。BⅠO-PROFⅠF凝胶图像分析仪:法国VL公司产品。NDY-1000彩色图像分析仪:武汉同济医科大学千屏影像科技公司生产。
1.4 方法
1.4.1 动物分组及给药 实验大鼠按随机表分为正常对照组、模型组、氨茶碱治疗组(以下简称治疗组),每组8只。治疗组从第1次哮喘激发开始灌胃给药,直至处死,2 ml每日1次,用药剂量按有关公式〔2〕,将人体临床用药剂量折算为大鼠用药剂量,模型组、正常对照组均以2 ml生理盐水代替氨茶碱,每日1次灌胃。
1.4.2 模型建立 实验组采用文献中方法〔3〕,分别于第1天及第8天大鼠腹腔内注射新鲜配制的卵蛋白溶液1 ml(内含卵蛋白100 mg,氢氧化铝100 mg)致敏,第15天起哮喘模型组及治疗组开始雾化吸入1%卵蛋白激发哮喘,隔日1次,每次20 min,共6 w,以大鼠出现呼吸加快,口唇发绀,腹肌痉挛,点头呼吸及站立不稳等表现为激发成功。正常对照组以生理盐水代替卵蛋白进行腹腔注射及雾化吸入。
1.4.3 检测指标及方法
1.4.3.1 病理组织学观察 10%水合氯醛3.5 ml/kg腹腔内注射麻醉,麻醉完全后开胸,迅速结扎右主支气管,取右肺中叶,4℃4%多聚甲醛固定,脱水、包埋、切片。苏木素-伊红(HE)染色,镜下观察病理学改变。并参照文献测量大鼠气道壁面积,并用气管内周长(Pi)进行标准化,采用NDY1000型图像分析仪测定完整支气管管腔的内周长、支气管平滑肌的面积,用Pi进行标准化。
1.4.3.2 支气管-肺组织TGF-β1含量检测 采用免疫组化半定量测定,石蜡切片常规脱蜡脱水,微波抗原修复,过氧化氢甲醇溶液灭活内源性过氧化物酶,滴加正常山羊封闭液,室温反应30 min后,各组分别滴加1∶80配置的兔ⅠgG多抗,4℃过夜,PBS洗净后,滴加生物素标记的二抗工作液,37℃反应20 min,PBS洗净后加辣根酶标记的链酶卵白工作液,37℃反应20 min,PBS洗5 min,共4次,室温显色,镜下控制反应时间约10 min左右,洗净后苏木精复染,树胶封片。计算机图像处理软件半定量测定TGF-β1含量(以染色吸光度值表示),于上下左右四点测量支气管壁及周围组织灰度值,取平均数作为最终测量结果。
1.4.3.3 肺组织MMP-9含量检测 取左肺上叶,称重后移入玻璃匀浆器中,加入2倍肺组织重量的生理盐水,充分研磨,使组织匀浆化,制备好的匀浆3 500 r/min离心10 min提取上清液,ELⅠSA法检测MMP-9含量。
1.4.3.4 肺组织MMP-9 mRNA含量检测 取左肺下叶肺组织50~100 mg,采用Trizol一步法提取细胞总RNA,逆转录酶M-MLV进行逆转录及PCR扩增,合成cDNA,-20℃保存备用。PCR反应:①PCR反应体系:50μl反应体系含TaqDNA聚合酶,Dntps,上样染料,稳定剂,反应缓冲液,逆转录反应产物,上下游引物等。震荡混匀后短暂离心,加少许矿物油于PCR仪扩增。②PCR扩增引物:引物由北京塞百盛基因技术有限公司合成。MMP-9引物序列为:上游:5'-TCGGTATTGGAAGTTCTCGA ATCACGG AGG-3',下游:5'-GGCACTGCAGGAG GTCATAGGTCACGTA-3',扩增片段为502 bp;ⅠL-4引物序列为:上游:5'-TGATGGGTCTCAG CCCCCACCTTGC-3',下 游:5'-CTTTCAGTGTTGTGAGCGTG GACTC-3',扩增片段为 378 bp;βactin引物序列为:上游:5'-CGTTGACATCCGTAAAGAC-3',下游:5'-CTGGAAGGTGGACAGT GAG-3',扩增片段为202 bp。③PCR 反应条件:ⅠL-4:94℃ 4 min,94℃ 45 s,60℃ 1 min,72℃1 min×30个循环,延伸 72℃ 10 min;MMP-9:94℃ 4 min,94℃45 s,66℃ 90 s,72℃ 75 s×30 个循环,延伸 72℃ 10 min;β-连环蛋白 (β-actin):94℃ 4 min,94℃ 45 s,55℃ 1 min,72℃1 min×30个循环,延伸72℃ 10 min。④半定量分析:取每个标本的扩增产物6μl于1%的含GV核酸染料的琼脂糖凝胶电泳,以DNA Marker(DL2000)作为标准分子量标记,电泳后于紫外透射仪观察,并用数码相机照相,输入微机应用法国VL公司BⅠO-PROFⅠF凝胶图像分析系统Bio-ⅠD⧺分析软件对目的电泳条带进行分析,以相应的内参电泳条带作为参照,结果以两者之积分吸光度的比值表示。
1.5 统计学处理 应用STATA8.0统计软件,数据采用±s表示,统计方法采用单因素方差分析及q检验。
2 结果
2.1 支气管哮喘大鼠支气管-肺组织病理学的影响 与正常组比较,模型组大鼠支气管管壁和平滑肌厚度明显增加(P<0.01),与模型组比较,治疗组支气管管壁和平滑肌厚度明显减低(P<0.01)。见表1,图1。
2.2 哮喘大鼠肺组织中TGF-β1含量的变化 图2可见,与正常组比较,模型组大鼠肺组织TGF-β1含量达247.0±18.6,较正常组143.4±18.9含量明显增加,其差异具有统计学意义(P<0.01)。与模型组比较,氨茶碱治疗组 TGF-β1含量173.8±36.8降低,其差异具有统计学意义(P<0.01)。
表1 各组大鼠气道形态学的比较(±s,n=8,%)

表1 各组大鼠气道形态学的比较(±s,n=8,%)
与正常组比较:1)P<0.05;与模型组比较:2)P<0.05
组别 剂量(mg/kg) 支气管数 支气管壁面积/pi(μm)支气管平滑肌面积/pi(μm)正常组- 24 2.52±1.07 1.17±0.86模型组 - 24 7.64±1.691) 4.02±1.491)治疗组 35 24 4.87±1.482) 2.76±1.082)

图1 各组气道形态学(HE,×400)
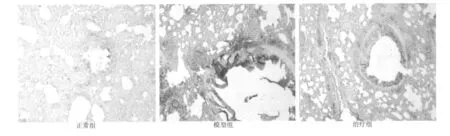
图2 各组TGF-β1表达(DAB,×400)
2.3 哮喘大鼠肺组织中MMP-9、MMP-9 mRNA含量的变化与正常组比较,模型组大鼠肺组织MMP-9含量、MMP-9 mRNA表达水平均明显增加(P<0.01)。与模型组比较,氨茶碱治疗组MMP-9含量、MMP-9 mRNA表达水平均降低,其差异具有统计学意义(P<0.01)。见表2,图3。
表2 气道重塑大鼠肺组织中MMP-9、MMP-9 mRNA含量的变化(±s,n=8)

表2 气道重塑大鼠肺组织中MMP-9、MMP-9 mRNA含量的变化(±s,n=8)
与正常组比较:1)P<0.01;与模型组比较:2)P<0.01
组别 剂量(mg/kg)MMP-9(pg/g)MMP-9mRNA(MMP-9/β-actin)正常组- 32.8±10.9 17.60±9.40模型组 - 88.1±23.81) 89.75±7.911)治疗组 35.0 43.1±16.52) 57.89±13.882)
图3 各组鼠肺组织中MMP-9 mRNA含量
3 讨论
应用氨茶碱治疗哮喘已有80多年的历史,口服或直肠给药吸收迅速,有效血药浓度为 10~20 mg/L,理论上给予0.5 mg/kg氨茶碱可使血清药物浓度上升1 mg/L,其治疗剂量与中毒剂量十分接近,20 mg/L血药浓度即可出现中毒反应,血清药物浓度大于35 mg/L时可引起呼吸急促、惊厥甚至死亡〔4〕。本实验中原设置的高剂量氨茶碱(70 mg/kg)组实验动物,用药后呼吸兴奋、惊厥等中毒反应明显,并有数只在实验过程中死亡,无法进行统计处理。
氨茶碱可下调大鼠肺组织MMP-9 mRNA表达、抑制MMP-9合成,从而抑制气道重塑。研究表明,MMP-9与支气管哮喘气道炎症、气道重塑、气道高反应性和激素治疗效果等方面均有密切关系〔5〕,健康成人肺组织中MMP-9含量较少,但在哮喘及气道重塑过程中,MMP-9可大量增加,哮喘时,肺的结构细胞如成纤维细胞、上皮细胞、气道平滑肌细胞以及许多炎症细胞如肺泡巨噬细胞、中性粒细胞、噬酸性粒细胞、淋巴细胞、肥大细胞等均可产生 MMP-9。哮喘状态下,支气管肺泡灌洗液(BALF)、痰液和血清中均可见MMP-9的浓度增加,气道活检组织表达MMP-9mRNA 及其活性升高〔6~8〕。Cataldo等的研究表明,哮喘抗原刺激后,痰液中MMP-9的含量增加,且其水平与1 s用力呼气量(FEV1)呈负相关。而减低MMP-9的含量可增加FEV1〔9〕。MMP-9与气道重塑关系密切,气道重塑是气道反复炎症损伤修复的结果,主要表现为细胞外基质(ECM)的沉积、基底膜增厚,气道平滑肌增生肥厚等改变。Hoshino研究显示哮喘气道重塑患者气道上皮下组织中MMP-9含量明显升高,而MMP-9含量与患者气道上皮下组织中Ⅲ、Ⅴ型胶原及黏蛋白含量显著正相关,而皮质类固醇类药物可通过下调MMP-9含量而抑制气道重塑〔10〕。
TGF-β1是一种多功能的调节细胞生长、分化的细胞因子,在哮喘的发生发展过程中起着重要的作用,哮喘患者的TGF-β1主要由气道上皮细胞、成纤维细胞及嗜酸粒细胞(EOS)产生,气道中TGF-β1表达增高可刺激气道平滑肌细胞分裂与增殖,刺激气道平滑肌细胞产生ⅠL-8及前列腺素E2以参与气道炎症反应。在气道重塑过程中,可诱导成纤维细胞向肌成纤维细胞转化,增加纤维黏蛋白和胶原的合成及在细胞外基质的沉积,同时还抑制胶原酶和蛋白酶的产生以减少胶原降解。TGF-β1的表达与气道基底膜厚度、成纤维细胞数目及哮喘发作的严重程度正相关〔11〕。
1 彭淑梅,赵建平,王淑珍,等.内皮素在儿童重度哮喘中的意义及作用〔J〕.广东医学,2002;23(2):175-6.
2 赵文利,孔祥英,何念海.茶碱在哮喘防治中免疫调节作用〔J〕.重庆医学,2003;32(2):234-7.
3 陈 奇.中药药理研究方法学〔M〕.北京:人民卫生出版社,1993:33.
4 王文建,王 杨,莉西华,等.川芎嗪对大鼠支气管哮喘模型气道重塑的影响及机制〔J〕.中华结核和呼吸杂志,2004;27(12):833-7.
5 邵明立,郑筱萸.中华人民共和国药典·临床用药须知〔M〕.北京:人民卫生出版社,2005:244.
6 陈 径,杨 莉.基质金属蛋白酶及其抑制物与支气管哮喘〔J〕.国外医学·儿科学分册,2003;30(5):239-41.
7 Kelly EA,Busse WW,Jarjour NN.Ⅰncreased matrix metalloproteinase-9 in the airway after allergin challenge〔J〕.Am JRespir Crit Care Med,2000;162(3-1):1157-61.
8 Belleguic C,Corbel M,Germain N,et al.Ⅰncreased release of matrix metalloproteinase-9 in the plasma of acute severe asthmatic patients〔J〕.Clin Exp Allergy,2002;32(2):217-23.
9 Cataldo DD,Bettiol J,Noel A,et al.Matrix metalloproteinase-9,but not tissue inhibitor of matrix metalloproteinase-1,increases in the sputum from allergic asthmatic patients after allergen challenge〔J〕.Chest,2002;122(5):1553-9.
10 Kumagai K,Ohno Ⅰ,Ⅰmai K,et al.The involvement of matrix metalloproteinases in basement membrane in jury in a murine model of acute allergic airway inflammation〔J〕.Clin Exp Allergy,2002;32(10):1527-34.
11 Nakao A.Ⅰs TGF-beta1 the key to suppression of human asthma〔J〕.Trends Ⅰmmunol,2001;22(3):115-8.

