高血压患者外周血白细胞端粒长度的变化
解丽艳 王云英 温成泉 张七一 (青岛大学医学院附属青岛市市立医院,山东 青岛 266011)
原发性高血压(essential hypertension,EH)是一种由遗传因素与环境因素共同作用而引起的多基因遗传性疾病,随着高血压遗传学的研究进展,人们发现端粒损耗特别是染色体的丢失会导致基因不稳定,端粒长度随年龄改变将会影响年龄依赖性高血压相关基因的表达,端粒损耗可能参与高血压发生发展的病理过程,白细胞端粒缩短可能是高血压患者易患动脉粥样硬化的危险因素之一。因此,本文拟探讨高血压患者白细胞端粒长度的变化及与高血压相关危险因素的关系,以期进一步了解高血压致动脉粥样硬化的病理机制。
1 材料与方法
1.1 研究对象 根据2005年《中国高血压防治指南》诊断标准:收缩压(SBP)≥140 mmHg或舒张压(DBP)≥90 mmHg或正在服用降压药物者,选取高血压患者162例,男84例,女78例,平均年龄(71.0±6.3)岁。同时选择年龄、性别相匹配的健康对照者112例,男59例,女53例,平均年龄(70.8±5.5)岁。两组入选对象均来自青岛地区汉族人群,无血缘关系,排除继发性高血压、严重急慢性感染、心力衰竭、支气管哮喘、自身免疫病及肿瘤患者。
1.2 研究方法
1.2.1 颈动脉超声 应用美国GE-vivid5型彩色多普勒超声诊断仪,探头频率5.0~10.0 MHz,由专人进行测量。血管内径测定:测量颈总动脉分叉近段1.5 cm处的内径,于心室收缩期及舒张期末期分别测量颈总动脉前壁中膜-外膜交界区与后壁内膜-血管腔交界区的垂直距离,每次测量3个心动周期,取其平均值。根据收缩期血管内径(Ds)和舒张期血管内径(Dd)计算横断面膨胀系数(cross-sectional distensibility coefficient,CSDC)和硬化参数(stiffness parameter)β。CSDC计算公式为:CSDC=(Ds2-Dd2)/Dd2×(SBP-DBP);硬化参数β=㏑(SBP/DBP)/〔(Ds-Dd)/Dd〕。
1.2.2 外周血白细胞端粒长度测定 抽取空腹外周静脉血3 ml,-80℃保存。统一提取基因组DNA。基因组DNA提取试剂盒购自上海华舜生物工程有限公司(产品编号:W6531),严格按照说明书操作。紫外分光光度仪检测提取DNA的浓度及纯度,OD260/280≥1.8为合格,用于测定端粒长度。应用LightCycler2.0(Roche,Mannheim,Germany)荧光定量 PCR 仪扩增端粒和单拷贝基因36B4。测出端粒重复序列的拷贝数(telomere repeat copy number)与单拷贝基因拷贝数(single copy gene copy number)的比值(T/C),该值与端粒的平均长度成线性相关〔1〕,从而得出相对端粒长度。端粒及36B4引物序列分别为:端粒:前向 5'-CGGTTTGTTTGGGTTTGGGTTTGGGTTTGGGTTTGGGTT-3';反向 5'-GGCTTGCCTTACCCTTACCCTTACCCTTACCCTTACCCT-3';36B4:前向5'-CAGCAAGTGGGAAGGTGTAATCC-3';反 向 5'-CCCATTCTATCATCAACGGGTACAA-3'。反应体系为:LightCycler®Fast-Start Reaction MixSYBR GreenⅠ,10 × conc.(Roche Diagnostics,Mannheim,Germany)10 μl,MgCl23 mmol/L,引物各0.15μmol/L,尿嘧啶 DNA糖基酶(UNG)0.1 U。反应条件为:37℃ 120 s激活 UNG,95℃ 10 min灭活UNG同时激活FastStart酶,端粒扩增条件为:95℃ 5 s,63℃5 s,72℃ 20 s,30 个循环,退火转换速率为 4℃ /s。基因 36B4扩增条件为:95℃ 5 s,58℃ 10 s,72℃ 40 s。共30 个循环,退火转换速率为20℃/s。用倍比稀释的标准品(标准品浓度5~80 ng)进行PCR扩增,根据Ct值建立标准曲线。在PCR过程中设立无模板阴性对照(no templates control,NTC)。在实验结束后进行融解曲线分析,以鉴定产物是否单一。相对端粒长度的计算方法参照曹东维和Brouilette方法执行〔2,3〕,所得相对端粒长度与Southern印迹方法的结果一致〔4,5〕。
1.2.3 血脂、血糖检测 采用酶法测定血浆总胆固醇(TC)和甘油三酯(TG)水平;直接测定法测定血浆高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)水平;双波长免疫透射比浊法测定血浆载脂蛋白 A1(ApoA1)、载脂蛋白 B(ApoB)水平;己糖激酶法测定空腹血糖(FPG)水平,以上所有项目均在日立7170自动生化分析仪上测定。
1.3 统计学方法 采用SPSS15.0统计软件,所有数据以±s表示。两组计量资料的比较采用t检验;计数资料采用χ2检验;端粒长度比值在统计学分析时进行对数转换,其与各参数间的相关关系采用Spearman相关分析或偏相关分析。
2 结果
2.1 标准曲线和融解曲线 在退火温度升至63℃、退火及延伸时间分别降至5 s和20 s的情况下,端粒和基因36B4的标准曲线斜率分别是-3.693和-3.520(见图1),反应效率分别是1.87和1.92。融解曲线未发现非特异性产物出现(见图2)。
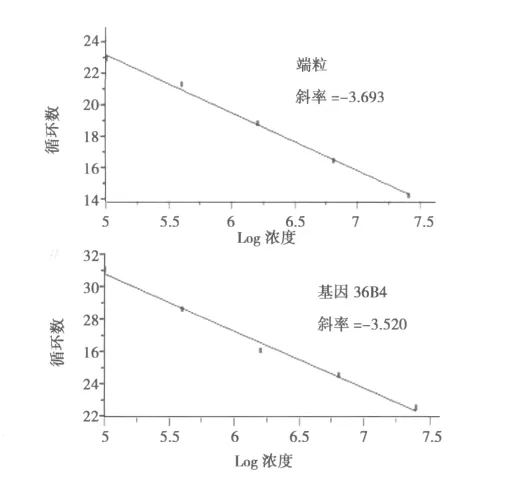
图1 端粒及36B4的标准曲线
2.2 研究对象的一般资料 高血压组与对照组之间性别、年龄、饮酒史无显著性差异 (P>0.05)。高血压组的BMⅠ、SBP、DBP、TC、TG和LDL均显著高于对照组(P<0.01);而HDL明显低于对照组(P<0.01)。高血压组CSDC显著低于对照组(P<0.01),而硬化参数β显著高于对照组(P<0.05)。吸烟史、高血压家族史两组之间有显著性差异(P<0.01)。两组间的FPG、ApoA1和 ApoB水平无统计学差异(P>0.05)。见表1。
2.3 外周血白细胞相对端粒长度的变化 275例研究对象的相对端粒长度参照相关文献〔3,6〕进行对数转换。转换后的端粒长度比值与年龄呈显著负相关(r=-0.345,P<0.001),高血压组和对照组的相关系数分别为:-0.306(r2=0.094,95%CI-0.020 ~ -0.007,P <0.001)和 -0.357(r2=0.127,95%CI-0.024~-0.008,P<0.001)。高血压组和对照组的相对端粒长度比较有显著性差异,高血压组较对照组显著缩短(P<0.01)。两组端粒长度比值经年龄校正后与CSDC呈显著正相关;与硬化参数β呈显著负相关;偏相关系数分别为0.286(r2=0.094,P <0.001)和 -0.126(r2=0.016,P=0.037)。高血压组端粒长度比值与CSDC的相关性较对照组弱,高血压组和对照组偏相关系数分别为0.133(P=0.045)和0.406(P<0.001);两组端粒长度比值与硬化参数β的相关性相似。但两组端粒长度比值经年龄校正后与ApoA1、ApoB、HDL、LDL和TC的相关性无统计学意义。见图3。

图2 端粒及36B4的融解曲线

表1 研究对象的端粒长度和各生化指标比较

图3 高血压组和对照组端粒长度比值与年龄、CSDC及硬化参数β的关系
3 讨论
端粒是位于真核细胞染色体两端一段特殊的DNA-蛋白质复合体,由短串联重复序列(TTAGGG)n和与之相连的端粒结合蛋白组成。人端粒是以5'-TTAGGG-3'为重复单位的富含鸟苷酸的序列,具有保护末端免于降解,防止染色体断裂、融合、重组和丢失,维持结构稳定的功能。出生时新生儿的端粒长度无性别差异,并且新生儿外周血白细胞、脐血和皮肤成纤维细胞的端粒长度高度一致。人类精子端粒长度约为15 kb;外周血细胞端粒长约7 000~10 000 bp;端粒平均长度为5~15 kb。成人端粒长度的变化是一个慢性损耗过程,是遗传和环境因素相互作用的结果。与年龄相关的高血压是遗传易感性与环境因素相互作用的异质性疾病,因此,端粒长度的变化很可能与高血压的发生发展密切相关。本文对163例高血压患者和112例健康对照者端粒长度的研究结果显示:高血压组外周血白细胞相对端粒长度(T/S比值)较对照组明显缩短,且与年龄呈显著负相关,表明高血压患者存在端粒长度过度耗损;或者随着年龄增长端粒长度耗损可能是高血压发病的危险因素之一。此结果与 Huzen〔7〕和 Brouilette〔3〕的研究结果一致。
高血压是动脉粥样硬化的一个主要危险因素。有学者观察到,高血压患者血白细胞中端粒长度缩短程度与动脉粥样硬化程度显著相关〔8〕,高血压伴颈动脉粥样斑块形成者较无斑块者端粒长度显著缩短〔9〕。本研究结果也显示:高血压组外周血白细胞相对端粒长度与CSDC呈正相关,与颈动脉硬化参数β呈负相关,提示端粒长度缩短与高血压患者动脉弹性有关。端粒长度的变化可能是生物血管龄的标志之一,它反映了动脉系统伴随年龄的衰老过程,端粒耗损可能参与这一高血压动脉粥样硬化的发生发展过程。动脉粥样硬化是一个多因子参与的复杂病理过程,主要危险因素包括年龄、血脂异常、血压、吸烟、糖尿病和糖耐量异常等。尽管研究表明端粒功能失调与上述因素密切相关,本研究也显示,端粒参与高血压动脉粥样硬化的发生发展过程,但其病理过程目前尚不清楚。有研究表明,端粒长度与高血压血管内皮炎症〔10〕、氧化应激〔11〕、高半胱氨酸血症〔12〕、氧化低密度脂蛋白(ox-LDL)〔13〕、叶酸代谢〔14〕等有关。炎症反应可造成DNA损伤,DNA断裂片段堆积降低了DNA的修复效率,致端粒耗损加速〔15〕。用高半胱氨酸诱导内皮培养细胞加速衰老,发现高半胱氨酸慢性刺激形成的慢性氧化压力增加了细胞间黏附分子-1(ⅠCAM-1)和Ⅰ型纤溶酶原激活物抑制因子(PAⅠ-1)的表达水平,使端粒长度的损失量增加,致端粒缩短,进一步加速内皮细胞衰老导致的动脉硬化,提示端粒缩短可能为氧化损伤学说与动脉粥样硬化之间提供了一种链接〔12〕。ox-LDL和叶酸代谢也分别通过影响端粒酶活性〔13〕和DNA甲基化而影响端粒长度〔14〕。但在本研究中,两组端粒长度比值与ApoA1、ApoB、HDL、LDL和TC的相关性无统计学意义,该结果与Brouilette等的研究结果一致〔3〕。脂质代谢紊乱是一个复杂的过程,任何单一指标很难全面反映代谢状态。而动脉弹性改变往往是长期的动脉粥样硬化发生、发展的结果,是血管内皮功能、动脉血流切应力改变、脂质代谢、炎症反应以及氧化应激等引起血管病变后期的表现,在本研究中,动脉弹性指标与端粒长度相关,且其相关性在对照组较高血压组更好,表明端粒长度与动脉弹性的关系可能有一定的遗传学基础,二者的关系尚需更多的研究加以证实。
1 Gil ME,Coetzer TL.Real-time quantitative PCR of telomere length〔J〕.Mol Biotechnol,2004;27:169-72.
2 曹东维.定量聚合酶链反应对系膜细胞端粒长度的测定研究〔J〕.南通大学学报(医学版),2006;2:108-10.
3 Brouilette SW,Moore JS,McMahon AD,et al.Telomere length,risk of coronary heart disease,and statin treatment in the West of Scotland primary prevention study:a nested case-control study〔J〕.Lancet,2007;369:107-14.
4 Epel ES,Blackburn EH,Lin J,et al.Accelerated telomere shortening in response to life stress〔J〕.Proc Natl Acad Sci U SA,2004;101:17312-5.
5 Grabowski P,Aleskog A,Thunberg U,et al.Telomere length as a prognostic parameter in chronic lymphocytic leukemia with special reference to VH gene mutation status〔J〕.Blood,2005;105:4807-12.
6 Zee RY,Michaud SE,Germer S,et al.Association of shorter mean telomere length with risk of incident myocardial infarction:A prospective,nested case-control approach〔J〕.Clin Chim Acta,2009;403:139-41.
7 Huzen J,de Boer RA,van Veldhuisen DJ,et al.The emerging role of telomere biology in cardiovascular disease〔J〕.Front Biosci,2010;15:35-45.
8 Benetos A,Gardner JP,Zureik M,et al.Short telomeres are associated with increased carotid atherosclerosis in hypertensive subjects〔J〕.Hypertension,2004;43:182-5.
9 Urbanek K,Torella D,Sheikh F,et al.Myocardial regeneration by activation of multipotent cardiac stem cells in ischemic heart failure〔J〕.Proc Natl Acad Sci U SA,2005;102:8692-7.
10 Carrero JJ,Stenvinkel P,Fellström B,et al.Telomere attrition is associat-ed with inflammation,low fetuin-A levels and high mortality in prevalent haemodialysis patients〔J〕.Ⅰnt Med,2008;263:302-12.
11 Voghel G,Thorin-Trescases N,Farhat N,et al.Cellular senescence in endothelial cells from atherosclerotic patients is accelerated by oxidative stress associated with cardiovascular risk factors〔J〕.Mech Ageing Dev,2007;128:662-71.
12 Xu D,Neville R,Finkel T.Homocysteine accelerates endothelial cell senescence〔J〕.FEBSletters,2000;470:20-4.
13 Tsirpanlis G,Chatzipanagiotou S,Boufidou F,et al.Serum oxidized lowdensity lipoprotein is inversely correlated to telomerase activity in peripheral blood mononuclear cells of haemodialysis patients〔J〕.Nephrology(Carlton),2006;11:506-9.
14 Paul L,Cattaneo M,D'Angelo A,et al.Telomere length in peripheral blood mononuclear cells is associated with folate status in men〔J〕.JNutr,2009;139:1273-8
15 Wang C,Jurk D,Maddick M,et al.DNA damage response and cellular senescence in tissues of aging mice〔J〕.Aging Cell,2009;8:311-23.

